↓ ↘
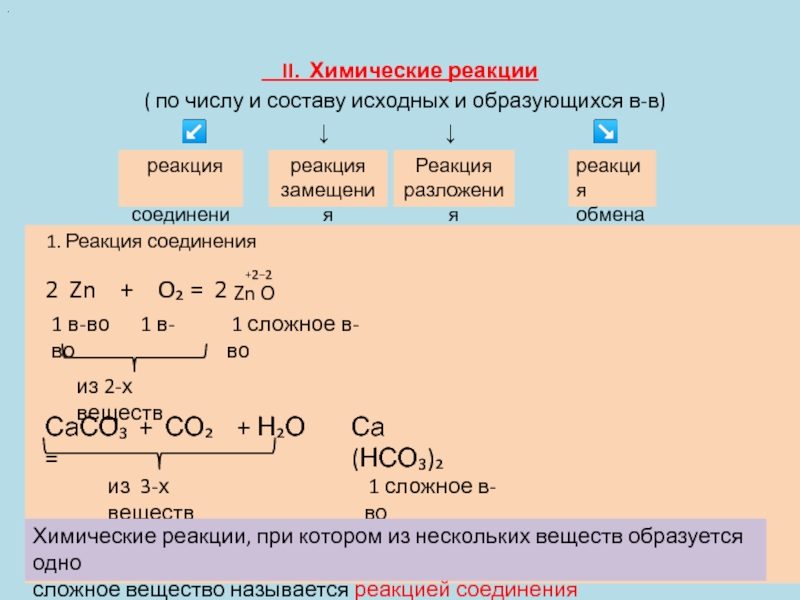
1. Реакция соединения
ZnO
⁺² ⁻²
Zn⁰ = Zn⁺²
- 2e
O₂⁰ = 2O⁻²
+4e
2
ок-ся, в-ль
вос-ся, ок-ль
2
2
Реакция соединения
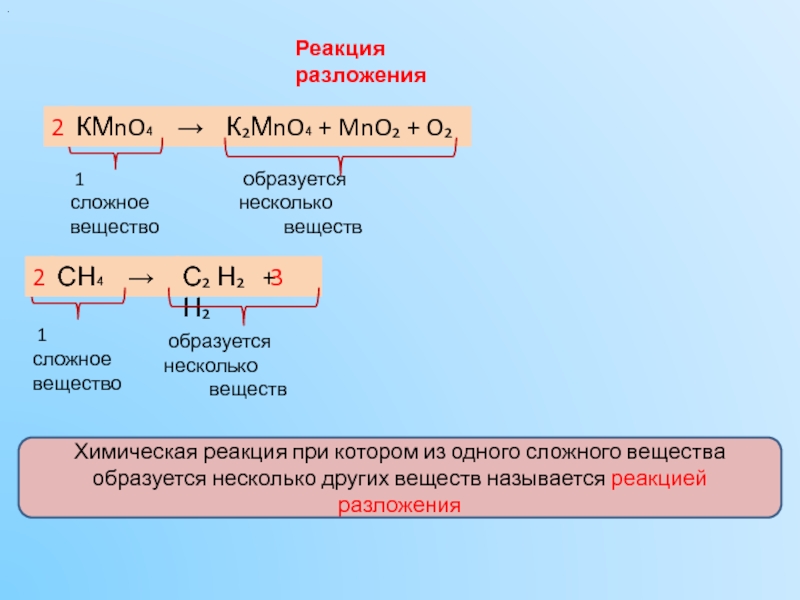
Реакция разложения
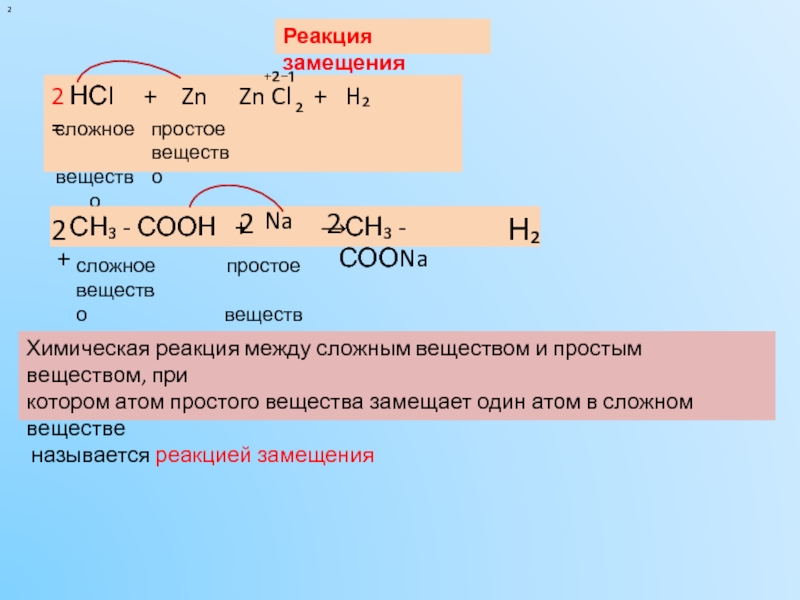
Реакция замещения
Zn⁰ + O₂⁰=
2. Реакция разложения
Н₂О →
Н₂⁰ + О₂⁰
⁺¹ ⁻²
Н⁺¹ =
Н₂⁰
2
+2 е
О⁻² =
О₂⁰
2
- 4 е
2
вос-ся, ок-ль
ок-ся, в-ль
2
2