Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии "Алкены" 10 класс
Содержание
- 1. Презентация к уроку химии "Алкены" 10 класс
- 2. *Общая формула: СnH2nАлкены – ациклические углеводороды, в
- 3. S1P2гибридизацияНегибридизованное электронное облакоВ молекулах алкенов - SP2 –гибридизация120º
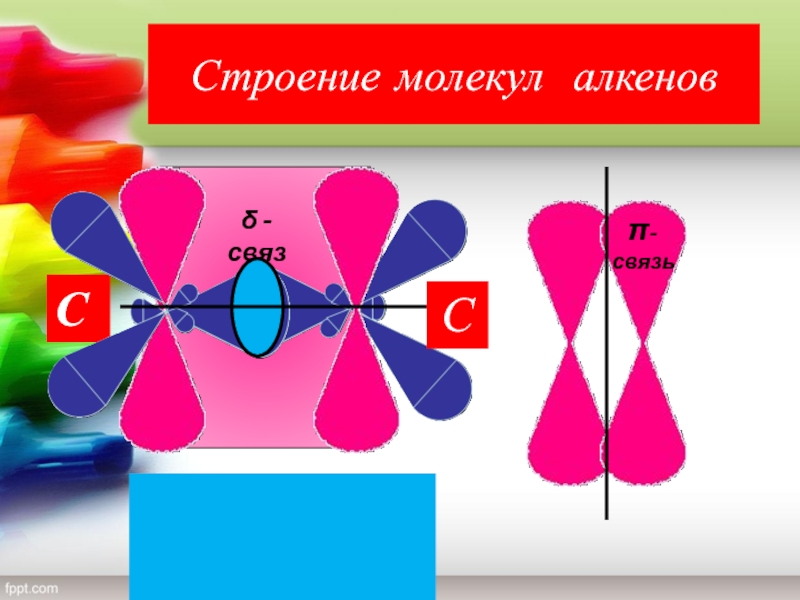
- 4. Строение молекул алкеновδ -связьπ-связьССС = Сδ πС = Сδ π
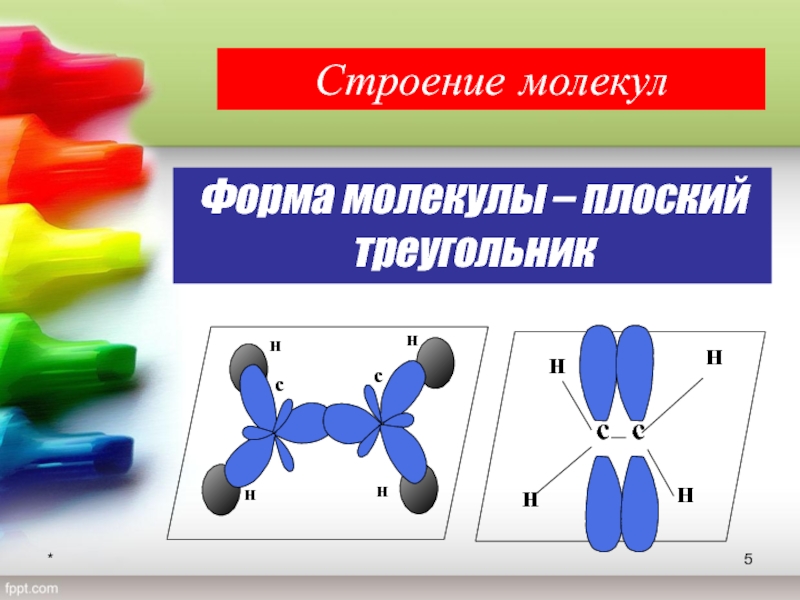
- 5. *Форма молекулы – плоский треугольникСтроение молекул
- 6. Характеристика двойной связи (С ═ С)Вид гибридизации
- 7. Характеристика двойной связи (С ═ С)π –
- 8. Гомологический ряд алкеновЭтен ПропенБутенПентенГексенГептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14Общая формула СnН2n
- 9. Изомерия алкеновДля алкенов возможны два типа изомерии: 1-ый
- 10. Номенклатура Название алкенов по систематической номенклатуре
- 11. Примеры изомеров углеродного скелета (С5Н10) 1
- 12. Примеры изомеров положения двойной связи ( С5Н10)
- 13. Межклассовая изомерия
- 14. Примеры межклассовых изомеров ( С5Н10)СН2 = СН –СН2 – СН2 – СН3пентен -1циклопентан
- 15. Пространственная изомерия (С4Н8 )Для алкенов возможна пространственная
- 16. Физические свойства алкеновАлкены плохо растворимы в воде,
- 17. Химические свойства алкеновПо химическим свойствам алкены резко
- 18. Типы химических реакций, которые характерны для алкеновРеакции присоединения.Реакции полимеризации.Реакции окисления.
- 19. Реакции присоединения1. Гидрирование.CН2 = СН2 + Н2
- 20. Реакции присоединения3. Гидрогалогенировани1
- 21. Присоединение молекул галогеноводородов и воды к молекулам
- 22. Правило В.В. МарковниковаАтом водорода присоединяется к наиболее
- 23. Реакции полимеризации (свободно-радикальное присоединение)Полимеризация – это последовательное
- 24. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата
- 25. Реакции окисления3. Каталитическое окисление. а) 2СН2 = СН2
- 26. Горение алкенов Алкены горят красноватым светящимся пламенем,
- 27. Качественные реакции на двойную углерод-углеродную связьОбесцвечивание бромной
- 28. ВЫВОД: Гидрирование алкенов является реакцией обратимой
- 29. При отщеплении галогеноводорода или воды от вторичных
- 30. Лабораторные способы получения алкеновДегидрогалогенирование галогеналкенов.Н3С ─ СН2─
- 31. Промышленные способы получения алкеновКрекинг алканов.С10Н20
- 32. ПРИМЕНЕНИЕ ЭТИЛЕНА
- 33. Слайд 33
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2*
Общая формула: СnH2n
Алкены – ациклические углеводороды, в молекуле которых кроме
одинарных связей содержится одна двойная связь между атомами углерода.
Слайд 3
S1
P2
гибридизация
Негибридизованное электронное облако
В молекулах алкенов -
SP2 –гибридизация
120º
Слайд 6Характеристика двойной связи
(С ═ С)
Вид гибридизации –
Валентный угол –
Длина связи С = С –
Строение ─
Вид
связи – По типу перекрывания –
Слайд 7Характеристика двойной связи
(С ═ С)
π – связь одинаково распределена над
и под плоскостью молекулы этилена;
π – связь менее прочная, чем
σ – связь;
π – связь легче поляризуется
Слайд 8Гомологический ряд алкенов
Этен
Пропен
Бутен
Пентен
Гексен
Гептен
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
Общая формула
СnН2n
Слайд 9Изомерия алкенов
Для алкенов возможны два типа изомерии:
1-ый тип – структурная
изомерия:
углеродного скелета
положения двойной связи
межклассовая
2-ой тип – пространственная изомерия:
геометрическая
Слайд 10
Номенклатура
Название алкенов по систематической номенклатуре образуют из названий аналогично построенных
алканов, заменяя суффиксы –ан на –ен, цифрой указывается номер того
атома углерода, от которого начинается двойная связь.Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
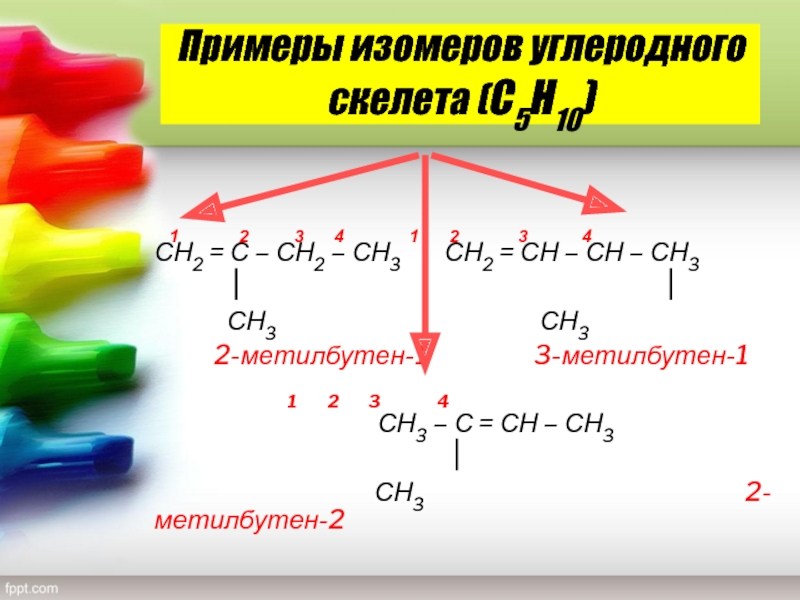
Слайд 11Примеры изомеров углеродного скелета (С5Н10)
1 2
3 4 1 2 3
4 СН2 = С – СН2 – СН3 СН2 = СН – СН – СН3СН3 СН3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН3 – С = СН – СН3
СН3 2-метилбутен-2
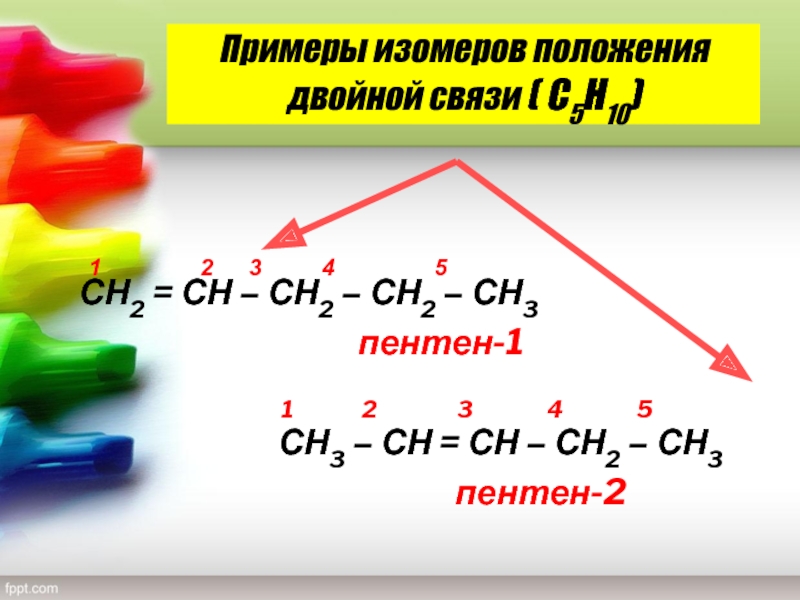
Слайд 12Примеры изомеров положения двойной связи ( С5Н10)
1
2 3
4 5 СН2 = СН – СН2 – СН2 – СН3пентен-1
1 2 3 4 5
СН3 – СН = СН – СН2 – СН3
пентен-2
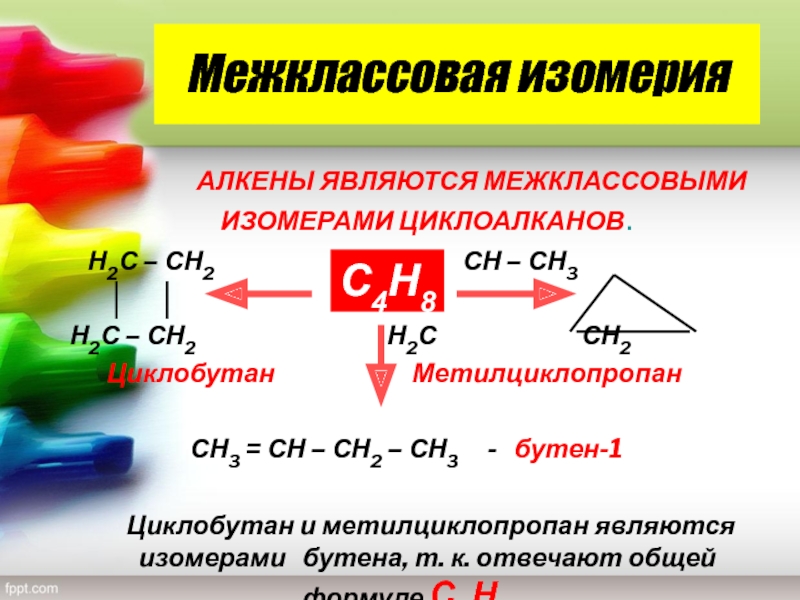
Слайд 13Межклассовая изомерия
АЛКЕНЫ
ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ.
Н2С
– СН2 СН – СН3Н2С – СН2 Н2С СН2
Циклобутан Метилциклопропан
СН3 = СН – СН2 – СН3 - бутен-1
Циклобутан и метилциклопропан являются изомерами бутена, т. к. отвечают общей формуле С4Н8 .
С4Н8
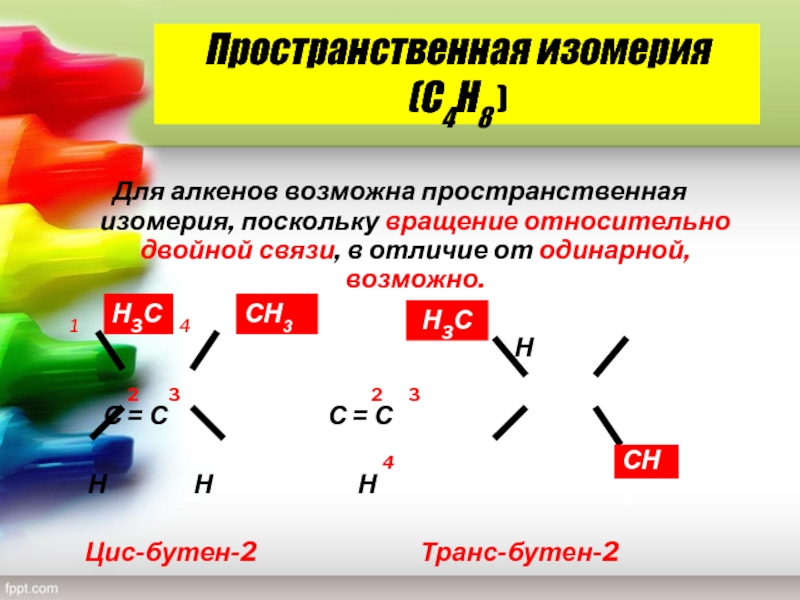
Слайд 15Пространственная изомерия (С4Н8 )
Для алкенов возможна пространственная изомерия, поскольку вращение
относительно двойной связи, в отличие от одинарной, возможно.
1
4 1Н
2 3 2 3
С = С С = С
4
Н Н Н
Цис-бутен-2 Транс-бутен-2
Н3С
СН3
Н3С
СН3
Слайд 16Физические свойства алкенов
Алкены плохо растворимы в воде, но хорошо растворяются
в органических растворителях.
С2– С4 - газы
С5– С16 - жидкости
С17
… - твёрдые веществаС увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Алкены имеют молекулярную кристаллическую решетку
Слайд 17Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов.
Алкены более химически активные вещества, что обусловлено наличием двойной связи,
состоящей из σ- и π-связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π-связи, как менее прочной.Слайд 18Типы химических реакций, которые характерны для алкенов
Реакции присоединения.
Реакции полимеризации.
Реакции окисления.
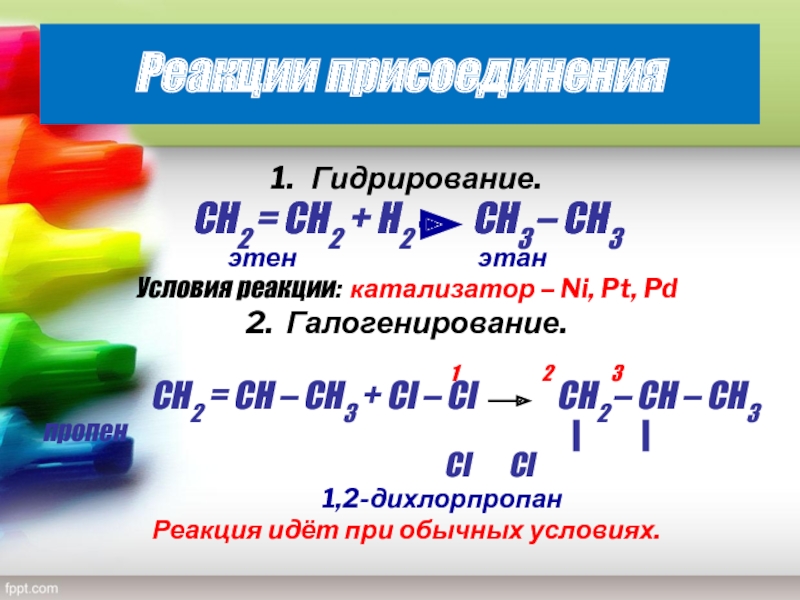
Слайд 19Реакции присоединения
1. Гидрирование.
CН2 = СН2 + Н2 СН3 – СН3
этен этан
Условия реакции: катализатор – Ni, Pt, Pd
2. Галогенирование.
1 2 3
CН2 = СН – СН3 + Сl – Сl СН2 – СН – СН3
пропен
Cl Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
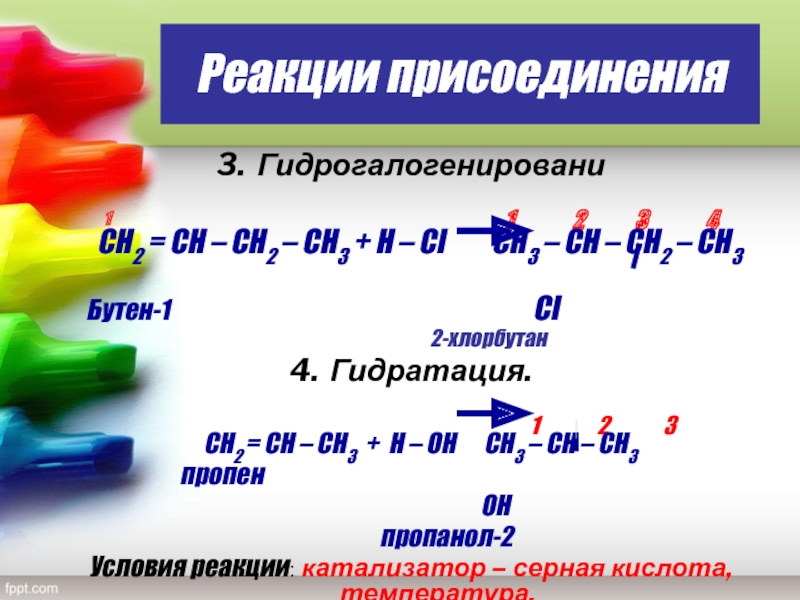
Слайд 20Реакции присоединения
3. Гидрогалогенировани
1
1 2 3 4
СН2 = СН – СН2 – СН3 + Н – Сl CН3 – СН – СН2 – СН3
Бутен-1 Cl
2-хлорбутан
4. Гидратация.
1 2 3
CН2 = СН – СН3 + Н – ОН СН3 – СН – СН3
пропен
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Слайд 21Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в
соответствии
с правилом
В.В. Марковникова.
Слайд 22Правило В.В. Марковникова
Атом водорода присоединяется к наиболее гидрированному атому углерода
при двойной связи, а атом галогена или гидроксогруппа – к
наименее гидрированному.
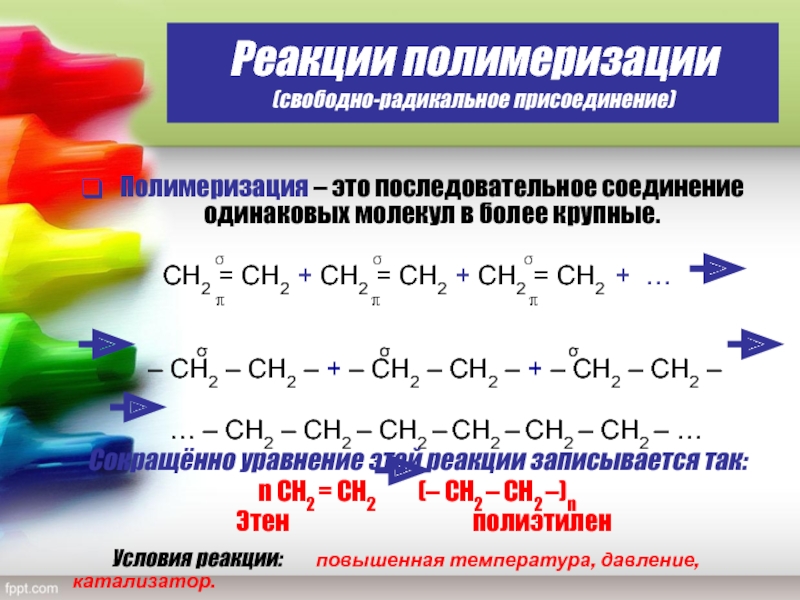
Слайд 23Реакции полимеризации
(свободно-радикальное присоединение)
Полимеризация – это последовательное соединение одинаковых молекул в
более крупные.
σ σ σСН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
π π π
σ σ σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2 (– СН2 – СН2 –)n
Этен полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
Слайд 24Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия).
3СН2 = СН2
+ 2КМnО4 + 4Н2О
3СН2 - СН2 + 2МnО2 + 2КОНОН ОН
этандиол
этен
С2Н4 + (О) + Н2О С2Н4(ОН)2
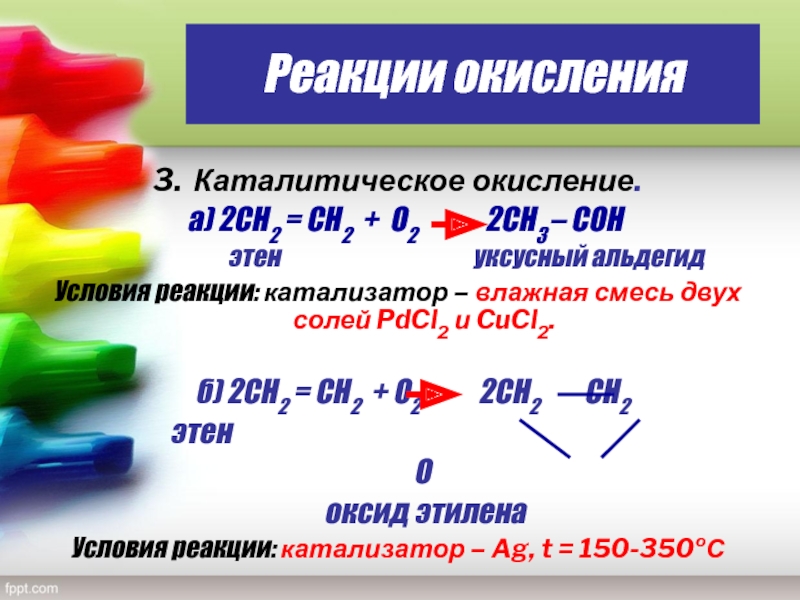
Слайд 25Реакции окисления
3. Каталитическое окисление.
а) 2СН2 = СН2 + О2
2СН3 – CОН
этен уксусный альдегидУсловия реакции: катализатор – влажная смесь двух солей PdCl2 и CuCl2.
б) 2СН2 = СН2 + О2 2СН2 СН2
этен
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350ºС
Слайд 26 Горение алкенов
Алкены горят красноватым светящимся пламенем, в то время
как пламя предельных углеводородов голубое. Массовая доля углерода в алкенах
несколько выше, чем в алканах с тем же числом атомов углерода.При недостатке кислорода
Слайд 27Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды.
СН2 = СН
– СН3 + Вr2 CH2Br –
CHBr – CH3пропен 1,2-дибромпропан
Обесцвечивание раствора перманганата калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1 2 3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
Слайд 28
ВЫВОД:
Гидрирование алкенов является реакцией обратимой дегидрированию алканов СnH2n +
H2 ↔ CnH2n+2
Гидрирование процесс экзотермический
(200 0C) ,
Дегидрирование
процесс эндотермический (400-600 0C) .Слайд 29При отщеплении галогеноводорода или воды от вторичных и третичных галогеналканов
или спиртов атом водорода отщепляется от наименее гидрированного атома углерода.
При
получении алкенов необходимо учитывать правило А.М. Зайцева: Слайд 30Лабораторные способы получения алкенов
Дегидрогалогенирование галогеналкенов.
Н3С ─ СН2─ СНСl ─ СН3
+ КОН → Н3С ─ СН ═ СН ─ СН3
+ КСl + Н2О2-хлорбутан бутен-2
Условия реакции: нагревание.
2) Дегидратация спиртов.
Н3С ─ СН2 ─ ОН → Н2С ═ СН2 + Н2О
этанол этен
Условия реакции: катализатор – Н2SO4(конц.), t = 180ºС.
3) Дегалогенирование дигалогеналканов
Н3С ─ СНCl ─ СН2Сl + Мg → Н3С─СН ═ СН2 + MgCl2
1,2-дихлорпрпан пропен
Слайд 31Промышленные способы получения алкенов
Крекинг алканов.
С10Н20
С5Н12 + С5Н8
Декан пентан пентенУсловия реакции: температура и катализатор.
2. Дегидрирование алканов.
СН3 – СН2 – СН3 СН2 ═ СН – СН3 + Н
пропан пропен
Условия реакции: t = 400-600ºС и катализатор
(Ni, Pt, Al2O3 или Cr2O3).
3) Гидрирование алкинов.
CН ≡ СН + Н2 СН2 ═ СН2
этин этен
Условия реакции: катализатор – Pt, Pd, Ni.