Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по теме"Белки"
Содержание
- 1. Презентация по теме"Белки"
- 2. СодержаниеОпределениеФункции белковСтроение полипептидной цепиСтруктура белкаХимические свойстваПревращения белков в организмеИсточники информации
- 3. Чем являются белки в любом живом организме?
- 4. ОпределениеПептиды и белки представляют собой высокомолекулярные органические
- 5. Слайд 5
- 6. Функции белков1) Структурная (пластическая) – белками образованы многие
- 7. 3) Транспортная – белок гемоглобин транспортирует кислород,
- 8. 5) Регуляторная – ряд гормонов и других биологически
- 9. 7) Опорная – сухожилия, поверхности суставов соединения
- 10. Источники аминокислот Основным источником α- аминокислот для живого
- 11. Строение полипептидной цепи Полипептидная цепь имеет неразветвленное строение
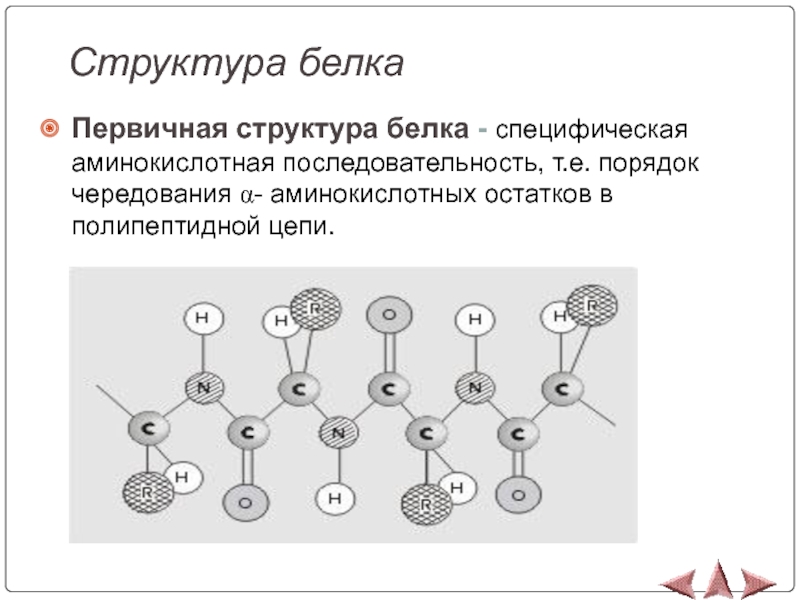
- 12. Структура белкаПервичная структура белка - специфическая аминокислотная
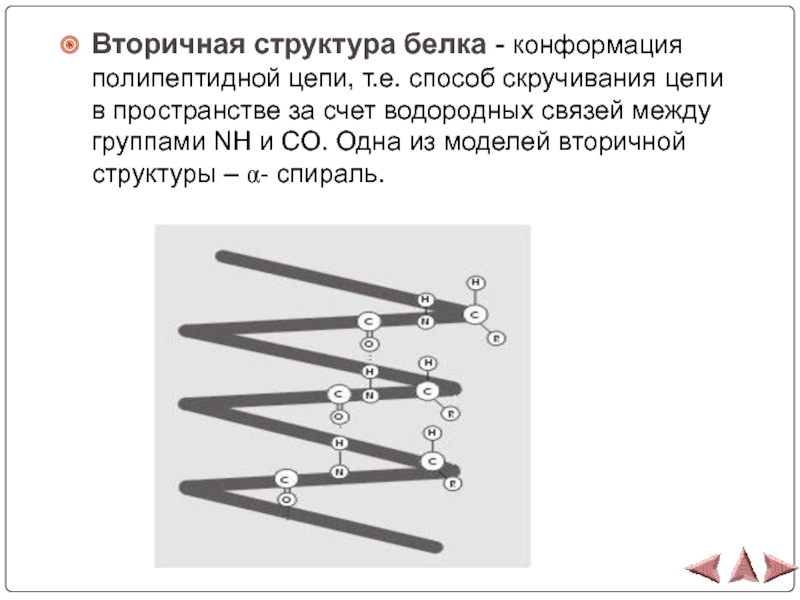
- 13. Вторичная структура белка - конформация полипептидной цепи,
- 14. Третичная структура белка - форма закрученной спирали
- 15. Четвертичная структура белка – агрегаты нескольких белковых
- 16. Химические свойства 1) Амфотерность связана с
- 17. 2) Денатурация. Утрата белком природной (нативной) конформации,
- 18. Денатурация может быть обратимой (так называемая,
- 19. 3) Гидролиз белков – разрушение первичной структуры
- 20. 4) Качественные реакции на белки:a) Биуретовая реакция
- 21. б) Ксантопротеиновая реакция – появление желтого окрашивания
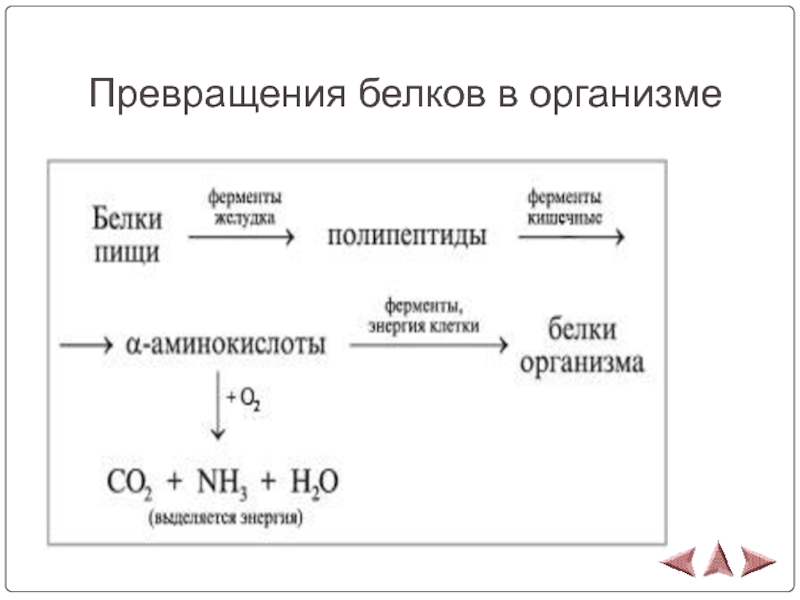
- 22. Превращения белков в организме
- 23. Белки в живом организме постоянно
- 24. Домашнее задание§ 45,46выучить записи в тетрадирешить задачу.
- 25. Источники информации1.http://www.kirensky.ru/books/book/Biochemistry/chapter_02.htm2.http://www.krugosvet.ru/articles/118/1011840/print.htm3.http://www.ximicat.com/info.php?id=84. http://rrc.dgu.ru/res/1september/22-10.htm
- 26. 5.http://www.chemistry.ssu.samara.ru/chem6/hm63.htm6. Петров А.А., Бальян Х.В., Трощенко А.Т.
- 27. Скачать презентанцию
СодержаниеОпределениеФункции белковСтроение полипептидной цепиСтруктура белкаХимические свойстваПревращения белков в организмеИсточники информации
Слайды и текст этой презентации
Слайд 2Содержание
Определение
Функции белков
Строение полипептидной цепи
Структура белка
Химические свойства
Превращения белков в организме
Источники информации
Слайд 4Определение
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из
остатков α- аминокислот, соединенных между собой пептидными связями.
Слайд 6Функции белков
1) Структурная (пластическая) – белками образованы многие клеточные компоненты, а
в комплексе с липидами они входят в состав клеточных мембран.
2) Каталитическая
– все биологические катализаторы – ферменты по своей химической природе являются белками. Слайд 73) Транспортная – белок гемоглобин транспортирует кислород, ряд других белков
образуя комплекс с липидами транспортируют их по крови и лимфе
(пример: миоглобин, сывороточный альбумин).4) Механохимическая – мышечная работа и иные формы движения в организме осуществляются при непосредственном участии сократительных белков с использованием энергии макроэргических связей (пример:
актин, миозин).
Слайд 85) Регуляторная – ряд гормонов и других биологически активных веществ имеют
белковую природу (пр.: инсулин, АКТГ).
6) Защитная – антитела (иммуноглобулины) являются
белками, кроме того основу кожи составляет белок коллаген, а волос – креатин. Кожа и волосы защищают внутреннюю среду организма от внешних воздействий. В состав слизи и синовиальной жидкости входят мукопротеиды.
Слайд 97) Опорная – сухожилия, поверхности суставов соединения костей
образованы в значительной степени белковыми веществами (пр.: коллаген, эластин).
8)
Энергетическая – аминокислоты белков могут поступать на путь гликолиза, который обеспечивает клетку энергией. 9) Рецепторная – многие белки
участвуют в процесса избирательного
узнавания(рецепторы).
Слайд 10Источники аминокислот
Основным источником α- аминокислот для живого организма служат пищевые
белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают
α - аминокислоты. Многие α - аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α - аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми.К ним относятся:
валин, лейцин, треонин, метионин, триптофан и т.д.
Слайд 11Строение полипептидной цепи
Полипептидная цепь имеет неразветвленное строение и состоит из
чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи
заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту.Слайд 12Структура белка
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок
чередования α- аминокислотных остатков в полипептидной цепи.
Слайд 13Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания
цепи в пространстве за счет водородных связей между группами NH
и CO. Одна из моделей вторичной структуры – α- спираль.Слайд 14Третичная структура белка - форма закрученной спирали в пространстве, образованная
главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных
и ионных взаимодействий.Слайд 15Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы),
образованные за счет взаимодействия разных
полипептидных цепей
Слайд 16Химические свойства
1) Амфотерность связана с наличием в молекуле
белка катионообразующих групп – аминогрупп и анионообразующих – карбоксильных группу.
Знак заряда молекулы зависит от количества свободных групп. Если преобладают карбоксильные группы то заряд молекулы отрицательный (проявляются свойства слабой кислоты), если аминогруппы – то положительный (основные свойства).Слайд 17 2) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей
его биологической функции, называется денатурацией. С точки зрения структуры белка
– это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д.Слайд 18 Денатурация может быть обратимой (так называемая, ренатурация) и необратимой.
Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина
при варке яиц.
Слайд 193) Гидролиз белков – разрушение первичной структуры белка под действием
кислот, щелочей или ферментов, приводящее к образованию a- аминокислот, из
которых он был составлен.Слайд 204) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание
при действии солей меди (II) в щелочном растворе. Такую реакцию
дают все соединения, содержащие пептидную связь.Слайд 21б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной
азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Слайд 23 Белки в живом организме постоянно расщепляются на исходные
аминокислоты (с непременным участием ферментов), одни аминокислоты переходят в другие,
затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).Слайд 25Источники информации
1.http://www.kirensky.ru/books/book/Biochemistry/chapter_02.htm
2.http://www.krugosvet.ru/articles/118/1011840/print.htm
3.http://www.ximicat.com/info.php?id=8
4. http://rrc.dgu.ru/res/1september/22-10.htm
Слайд 265.http://www.chemistry.ssu.samara.ru/chem6/hm63.htm
6. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник
для вузов./ Под ред. Петрова А.А. – М.: Высшая школа,1981.
7.
Хомченко Г.П. Пособие по химии для поступающих в вузы. – М.: ООO «Издательство Новая Волна», 2002.8. Оганесян Э.Т. Руководство по
химии поступающим в вузы. Справочное пособие. М.: Высшая школа,1991.
9. Иванова Р.Г., Осокина Г.Н. Изучение химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.