химические свойства спиртов, показать зависимость свойств вещества от строения молекул;
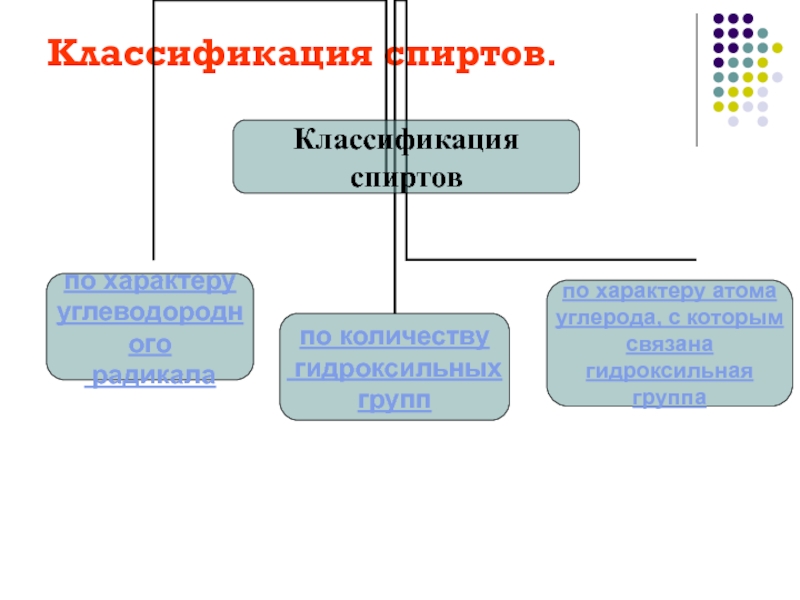
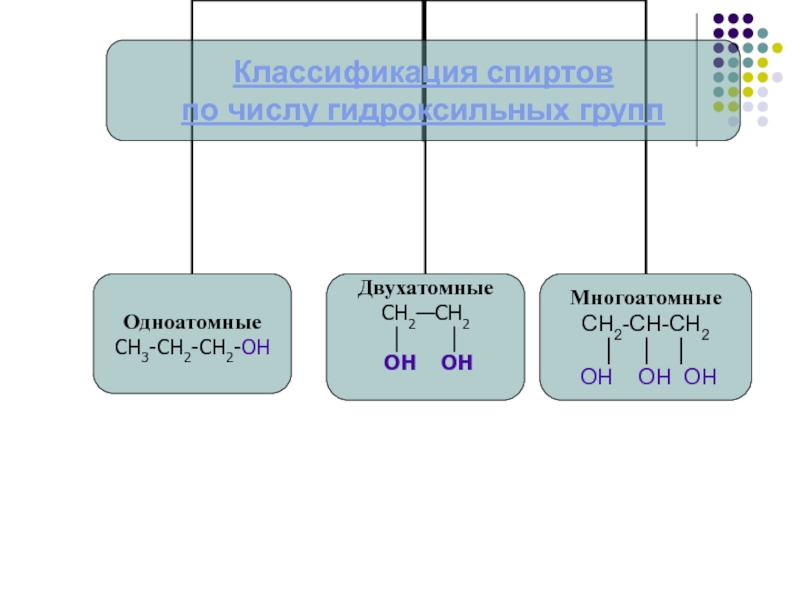
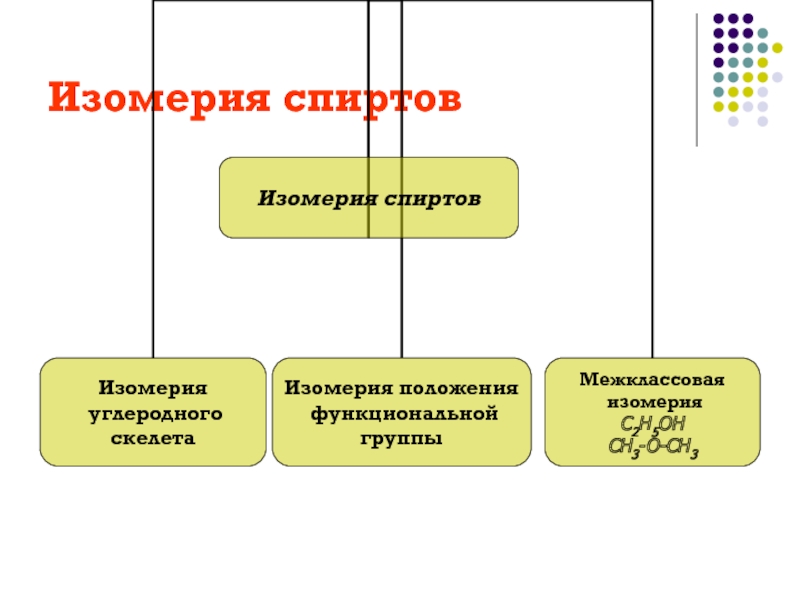
рассмотреть
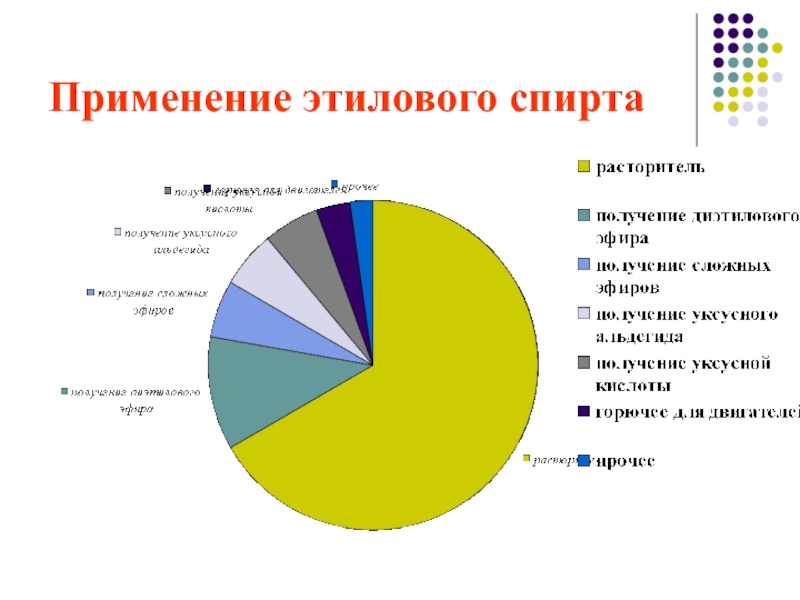
общие способы получение спиртов закрепить представления о применении веществ, основанном на их свойствах.














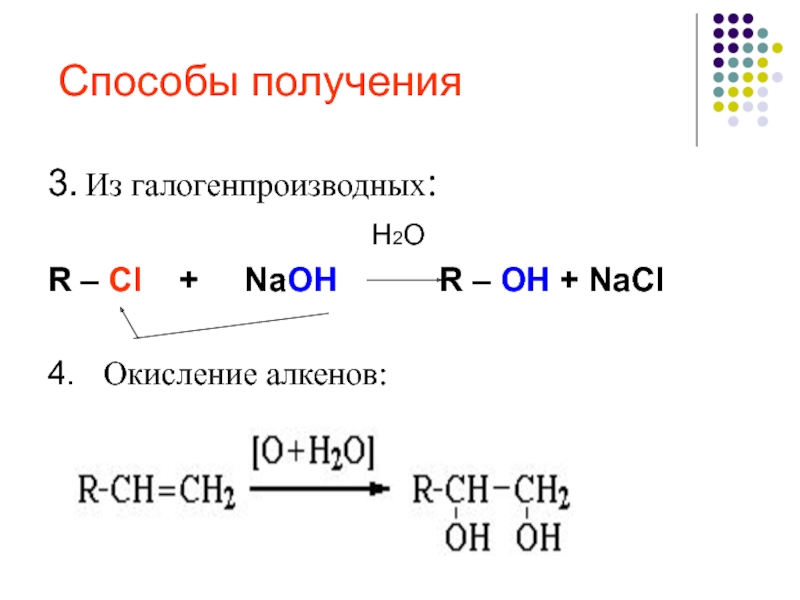

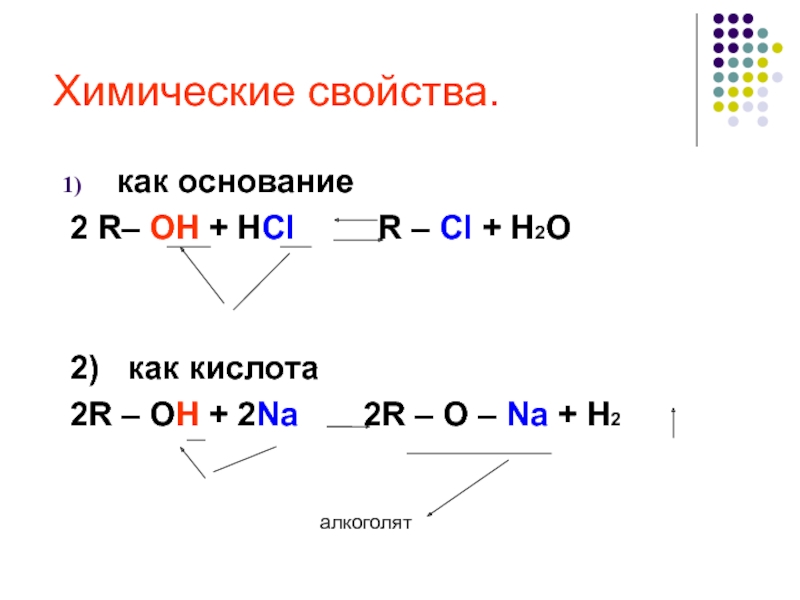
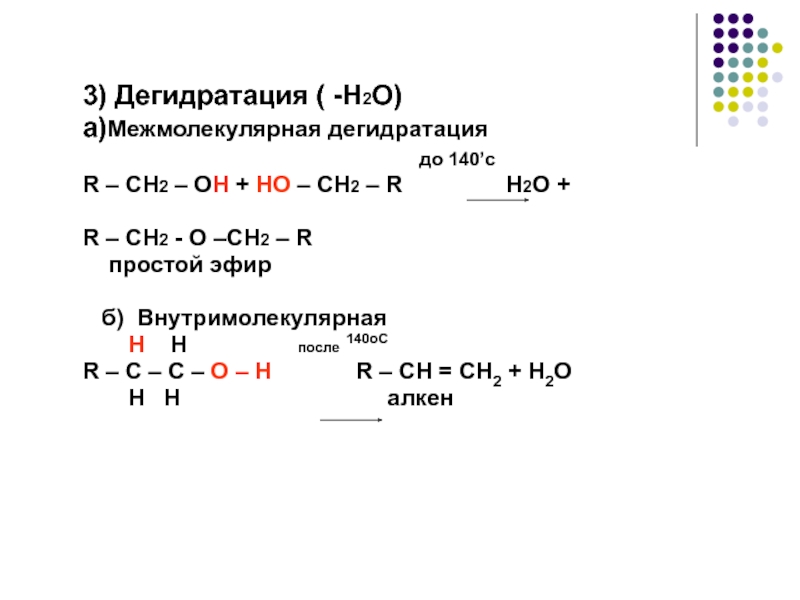

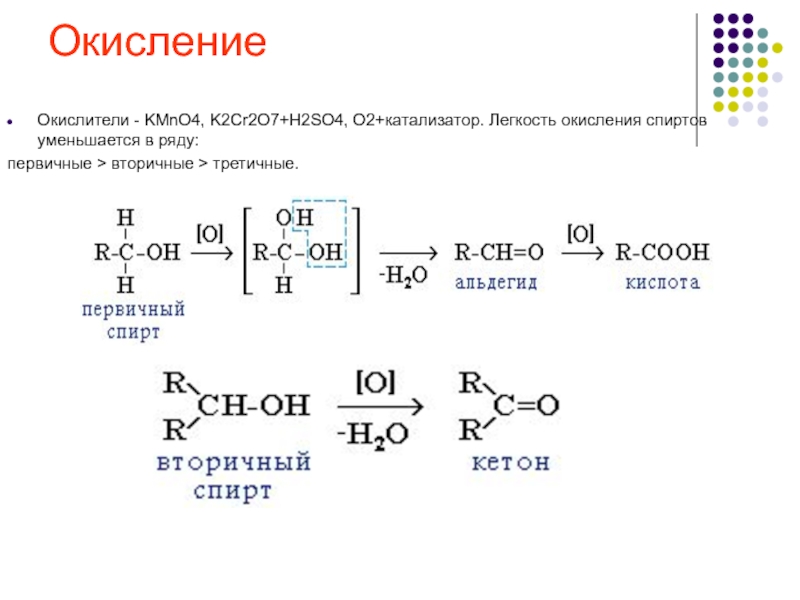 вторичные > третичные." alt="ОкислениеОкислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду: первичные > вторичные > третичные.">
вторичные > третичные." alt="ОкислениеОкислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду: первичные > вторичные > третичные.">