Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота.
Содержание
- 1. Серная кислота.
- 2. Изменение окраски индикатора
- 3. Серная кислота
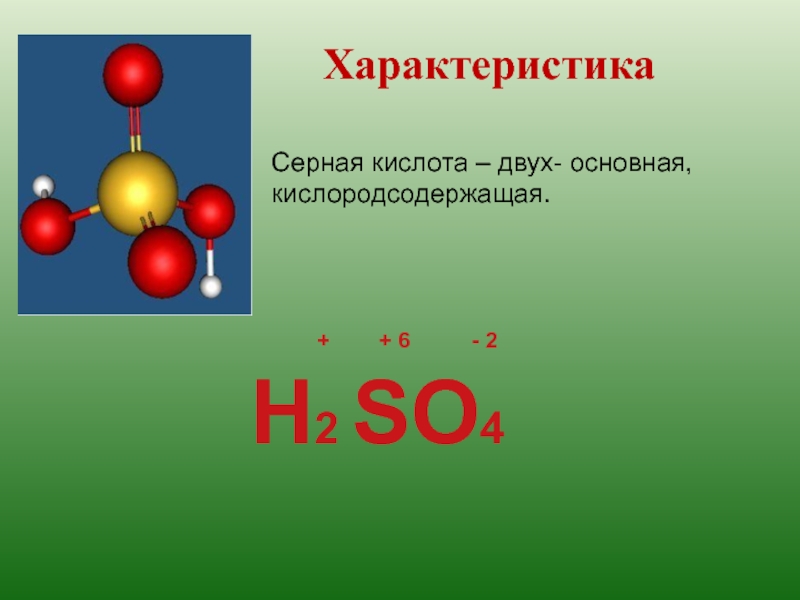
- 4. ХарактеристикаСерная кислота – двух- основная, кислородсодержащая.
- 5. H2 S O4 Двухосновная,Кислородсодержащая,Сильная,Нелетучая, Растворимая,Стабильная,
- 6. Бесцветная маслянистая жидкость =1,83кг/дм3 Большая
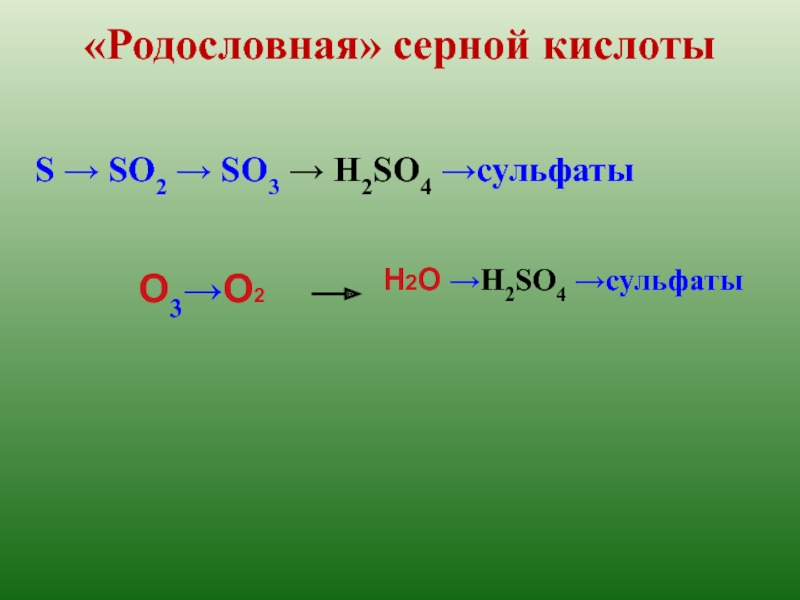
- 7. «Родословная» серной кислоты S → SO2 → SO3 → H2SO4 →сульфатыН2О →H2SO4 →сульфаты O3→О2
- 8. Правило разбавления кислотСначала вода, потом кислота – иначе случится большая беда!Н2Оhttp://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3-aadd474e4be6/index.htm
- 9. Термометр Растворение серной кислоты в водеСначала вода, Потом кислота. Иначе будет большая беда!Раствор серной кислоты
- 10. Слайд 10
- 11. Водоотнимающее свойство H2SO4http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf-1668d25430fb/index.htm
- 12. Разрушающее действие концентрированной серной кислоты(обугливание древесины)http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b-397af5d9adbe/index.htm
- 13. I. Химические свойства разбавленной серной кислоты
- 14. Взаимодействие конц.H2SO4 с металламиhttp://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6-aba916d777ee/index.htm
- 15. Окислительные свойства конц. H2SO4 Cu0 + H2S+6O4
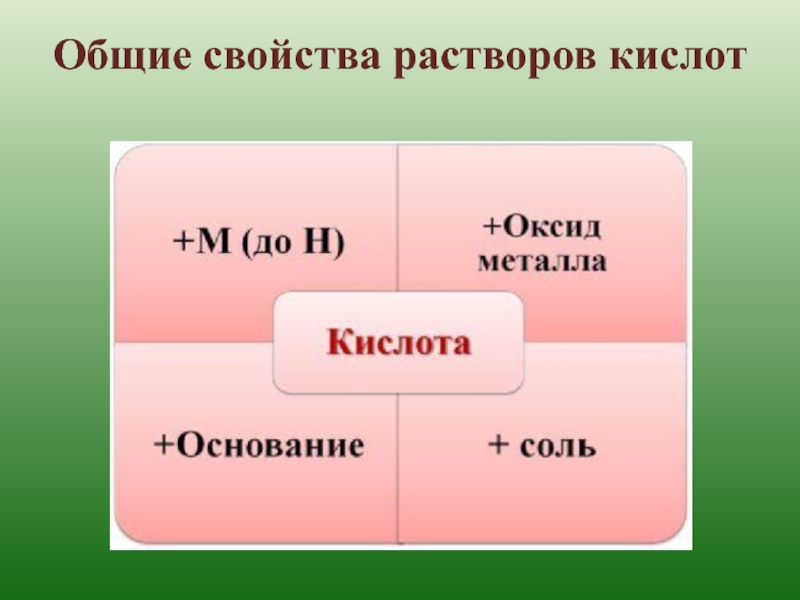
- 16. Общие свойства растворов кислот
- 17. Окислительные свойстваS + 2H2SO4 = 3SO2 +
- 18. Взаимодействие с оксидами металловCuO + H2SO4
- 19. Взаимодействие с основаниями2NaOH + H2SO4 → Na2SO4
- 20. K2CO3 + H2SO4 =
- 21. Качественная реакцияMgSO4+BaCI2→BaSO4↓+ MgCI2Белый молочный осадокhttp://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace-288cbf49a4db/index.htm
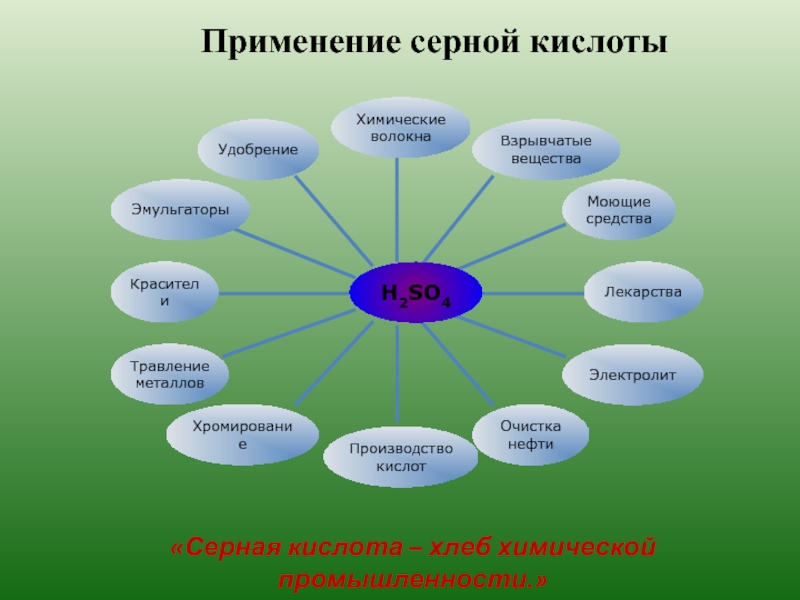
- 22. Применение серной кислоты«Серная кислота – хлеб химической промышленности.»
- 23. Кислота - волшебница http://files.school-collection.edu.ru/dlrstore/e4ae4b80-78f8-6aa5-1967-3de11a099cf3/index.htm http://files.school-collection.edu.ru/dlrstore/09a73a26-340a-0743-b42d-d2372b78657b/index.htm http://files.school-collection.edu.ru/dlrstore/d52658e3-f16c-5c57-d382-2f820fd82d75/index.htm
- 24. Выводы: разбавленная H2SO4 обладает общими свойствами всех
- 25. Домашнее задание§ 23, упр. 3,8 задание в тетради, индивидуальное задание
- 26. Спасибо всем!
- 27. Скачать презентанцию
Изменение окраски индикатора
Слайды и текст этой презентации
Слайд 6 Бесцветная маслянистая жидкость
=1,83кг/дм3
Большая вязкость
Обладает сильным
гигроскопическим свойством
Физические свойства серной кислоты
t кип.
= 340ºС
Слайд 8Правило разбавления кислот
Сначала вода, потом кислота –
иначе случится большая
беда!
Н2О
http://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3-aadd474e4be6/index.htm
Слайд 9
Термометр
Растворение серной кислоты в воде
Сначала вода,
Потом кислота.
Иначе будет большая
беда!
Раствор серной кислоты
Слайд 11Водоотнимающее свойство H2SO4
http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf-1668d25430fb/index.htm
Слайд 12Разрушающее действие
концентрированной серной кислоты
(обугливание древесины)
http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b-397af5d9adbe/index.htm
Слайд 13 I. Химические свойства разбавленной серной кислоты Взаимодействие с металлами ( до
Н )
Zn + H2SO4 → ZnSO4 + H2↑
Mg
+ H2SO4 → MgSO4 + H2↑ Cu + H2SO4 →
Слайд 14Взаимодействие конц.H2SO4
с металлами
http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6-aba916d777ee/index.htm
Слайд 15Окислительные свойства конц. H2SO4
Cu0 + H2S+6O4 → S+4O2 +
Cu+2SO4 + H2О
H2SH2SO4(конц.) + M → M2(SO4)n + S + H2O
SO2
Cu0 + 2е → Cu+2
S+6 + 2е→ S+4
Cu0 + 2H2S+6O4 → S+4O2 + Cu+2SO4 + 2H2О
Cu + H2SO4 → SO2 + CuSO4 + H2О
1 окислитель
1 восстановитель
2
2
Слайд 17Окислительные свойства
S + 2H2SO4 = 3SO2 + 2H2O
C + 2H2SO4
= 2SO2 + 2H2O + CO2
При нагревании концентрированная серная кислота может окислять отдельные неметаллы, а также различные неорганические вещества проявляющие восстановительные свойства.Слайд 18Взаимодействие
с оксидами металлов
CuO + H2SO4 → CuSO4 + H2O
ZnO
+ H2SO4 → ZnSO4 + H2O
CuO + 2H+ → Cu2+
+ H2OZnO + 2H+ → Zn2+ + H2O
Слайд 19Взаимодействие с основаниями
2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH +
H2SO4 → NaHSO4 +H2OКислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
Слайд 21Качественная реакция
MgSO4+BaCI2→BaSO4↓+ MgCI2
Белый молочный
осадок
http://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace-288cbf49a4db/index.htm
Слайд 23Кислота - волшебница
http://files.school-collection.edu.ru/dlrstore/e4ae4b80-78f8-6aa5-1967-3de11a099cf3/index.htm
http://files.school-collection.edu.ru/dlrstore/09a73a26-340a-0743-b42d-d2372b78657b/index.htm
http://files.school-collection.edu.ru/dlrstore/d52658e3-f16c-5c57-d382-2f820fd82d75/index.htm
Слайд 24Выводы:
разбавленная H2SO4 обладает общими свойствами всех кислот;
разбавленная H2SO4
– окислитель при взаимодействии с металлами (Н+);
чистая H2SO4 и
H2SO4 в конц. растворах сильный окислитель (S+6); чистая H2SO4 не реагирует с благородными металлами (Au, Pt) и с Al,
Cr, Fe из-за пассивации;
конц. H2SO4 окисляет некоторые неметаллы (C, S, P) до высшей с.о.;
конц. H2SO4 взаимодействует с металлами (в том числе Cu, Ag, Hg), стоящими в ряду напряжений после водорода;
активные металлы восстанавливают H2SO4 до H2S (щ. и щ/з);
от Zn до Н – до S;
с малой активностью до SO2;
H2SO4 сильный дегидратирующий агент (меры предосторожности);
бурно реагирует с водой (правило разбавления);
будучи нелетучей кислотой, H2SO4 способна вытеснять другие кислоты из их солей.