Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие способы получения металлов
Содержание
- 1. Общие способы получения металлов
- 2. Нахождение металлов в природе:1) в самородном состоянииAuPtРежеAgCuHg
- 3. Металлы в ряду активности до Al – это солиNaClMgSO4CaCO3
- 4. 3) Остальные металлы – оксиды и сульфидыAl2O3ZnSCuSPbS
- 5. Металлургия – область науки и техники, охватывающая процессы получения металлов из руд.Получают около 80 металлов
- 6. Виды металлургических производств:1) Пирометаллургия – получение металлов
- 7. 2) Гидрометаллургия – получение металлов из растворов
- 8. 3)Электрометаллургия – получениек - : Na+ + e =
- 9. Электролиз растворов – более сложный процесс, т.к.
- 10. 2 H2O + 2e = H2 +
- 11. 2) Процессы на аноде: (анод – инертный)22
- 12. Анод – растворимый(Fe, Cu, Zn, Ag и
- 13. Пример:Анод - инертный(ЭД)2+CuSO4 = Cu + SO4к: Cu
- 14. Скачать презентанцию
Слайды и текст этой презентации
Слайд 6Виды металлургических производств:
1) Пирометаллургия – получение металлов из руд под
действием высокой температуры
ZnO + C = Zn + CO
Zn + H2O
ZnS
+ O2 =ZnO + H2 =
ZnO + SO2
Слайд 72) Гидрометаллургия – получение металлов из растворов их солей
FeSO4 + Cu
Восстановители
– более активные металлы
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe =
Слайд 83)
Электрометаллургия – получение
к - : Na+ + e = Na0 а +:
2 Cl - - 2e = Cl2
2 - о-ль
1 -
в-льметаллов из растворов и расплавов их соединений под действием на них постоянного электрического
тока (электролиз)
2 NaCl = 2 Na + Cl2
расплав
Слайд 9Электролиз растворов – более сложный процесс, т.к. могут участвовать молекулы
воды
Правила:
1) Процессы на катоде:
Li ...................Al
2 H 2O + 2e = H
2 + 2 OH-
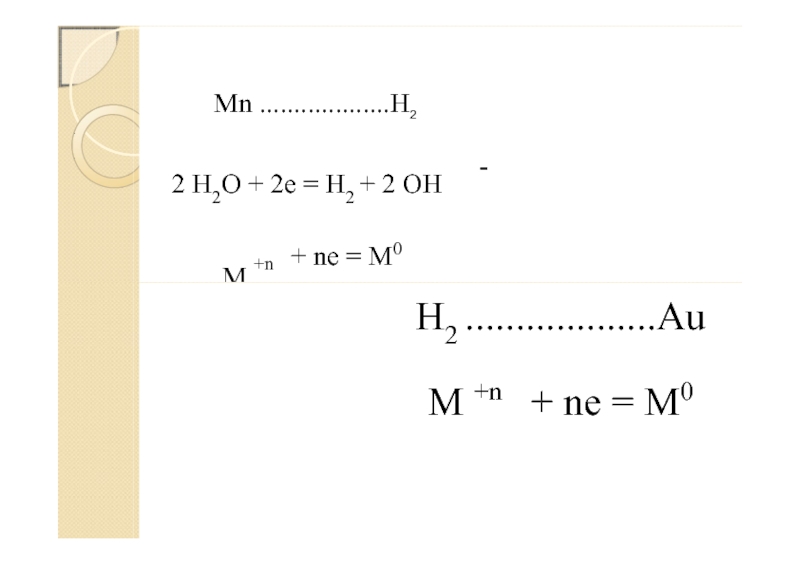
Слайд 102 H2O + 2e = H2 + 2 OH
-
M +n
+
ne = M0
Mn ...................H2
H2 ...................Au
M +n + ne = M0
Слайд 112) Процессы на аноде: (анод – инертный)
2
2 Г - 2e =
Г ( кроме F
-
- )
1)
2)
+
4 OH - 4e = O2 +
2 H2O-
2 CH COO - - 2e =2 CO + C H
3 2 2 6
если соли кислородсодержащих кислот, то окисляется молекула воды
2 H2O - 4e = 4 H + O2
3)
4)
Слайд 13Пример:
Анод - инертный
(ЭД)
2+
CuSO4 = Cu + SO4
к: Cu 2+, H O
2
2-
2+
Cu + 2e
= Cu0
а: SO4 , H2O
+
2 H2O - 4e = 4 H + O2
2
- ок-ль1 - во-ль
2 CuSO4 + 2 H2O = 2 Cu + O2 + 2 H2SO4