AC — железная трубка со смесью соды, угля и мела;
B — холодильник Донни и Мареска; R — приёмник с нефтью.
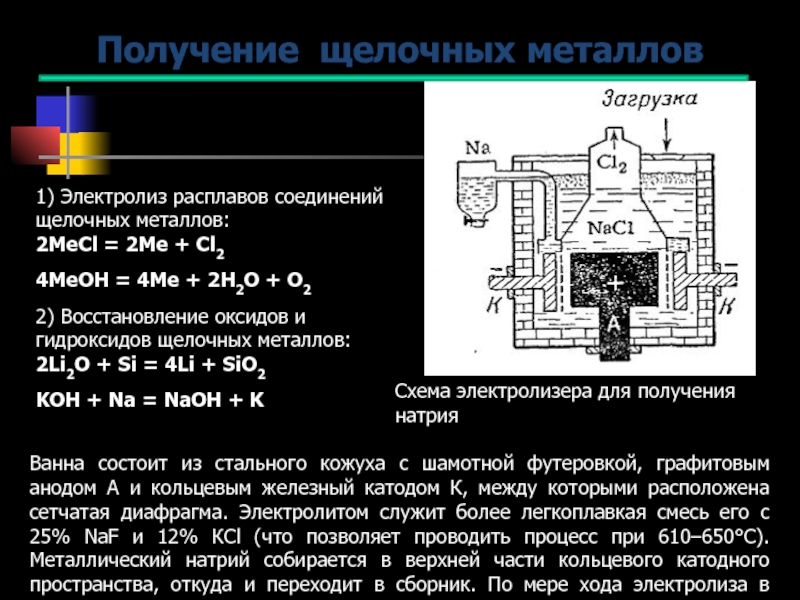
Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля) :
Na2CO3 + 2C => 2Na + 3CO
Аналогично, могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия.
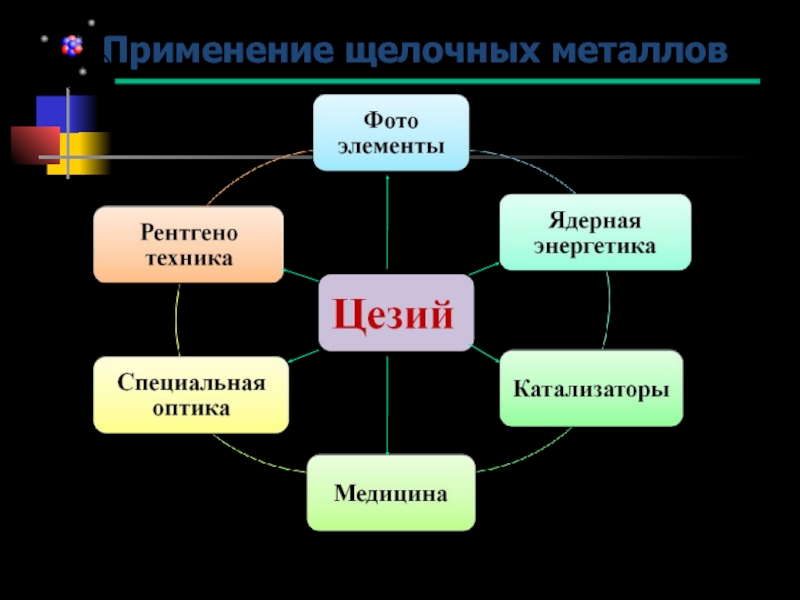
Получение





















![Щелочные металлы ПолучениеОсновными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме ПолучениеОсновными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей цезий входит](/img/thumbs/02be3efc975c9bff432d9ece4a7a9e68-800x.jpg)