Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соль 2
Содержание
- 1. Соль 2
- 2. мелтонкозернистый, мягкий, белый известняк, состоящий из мелких
- 3. мраморот греч. marmaros — блестящий камень, горная
- 4. известнякосадочная горная порода, состоящая главным образом из
- 5. кораллыКАЛЬЦИТ (известковый шпат), минерал класса
- 6. Гипс от греч. gypsos — мел,
- 7. Поваренная сольНАТРИЯ ХЛОРИД (поваренная соль), NaCl, бесцветные
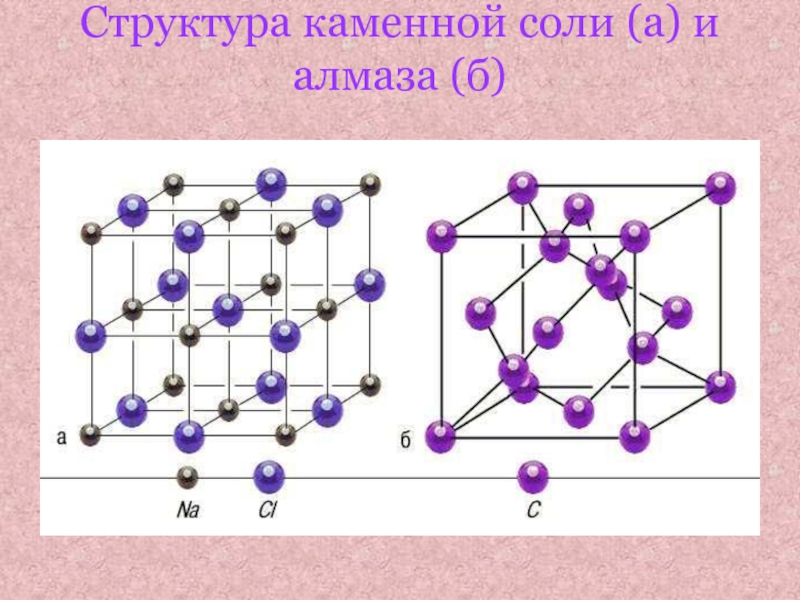
- 8. Структура каменной соли (а) и алмаза (б)
- 9. СОДА Техническое название карбонатов натрия.
- 10. МЕДИ СУЛЬФАТCuSO4 - сернокислая медь. Растворяется в
- 11. АММОНИЯ ХЛОРИДNH4Cl- нашатырь, бесцветные кристаллы. Азотное удобрение
- 12. КАЛИЯ ПЕРМАНГАНАТKMnO4, темно-фиолетовые кристаллы. Растворим в воде.
- 13. ХЛОРАТЫсоли хлорноватой кислоты HClO3. Кристаллы; при обычной
- 14. БУРАNa2B4O7.10H2O. В природе — минерал класса боратов,
- 15. НИТРАТЫсоли азотной кислоты HNO3, твердые хорошо растворимые
- 16. Нахождение в природе и получение Нитрат натрия
- 17. Физиологическое действие Нитраты токсичны. Неорганические нитраты вызывают
- 18. Применение Нитраты аммония, натрия и калия широко
- 19. Скачать презентанцию
мелтонкозернистый, мягкий, белый известняк, состоящий из мелких обломков и целых известковых скелетов микроорганизмов (кокколитов, фораминифер и др.). Применяют в цементной, стекольной, резиновой и др. отраслях промышленности.
Слайды и текст этой презентации
Слайд 1Представители солей.
Важнейшие соли, используемые человеком в жизни.
МОУ лицей №18
Иванова И.
Учитель
химии
Слайд 2мел
тонкозернистый, мягкий, белый известняк, состоящий из мелких обломков и целых
известковых скелетов микроорганизмов (кокколитов, фораминифер и др.). Применяют в цементной,
стекольной, резиновой и др. отраслях промышленности.Слайд 3мрамор
от греч. marmaros — блестящий камень, горная порода, образовавшаяся в
результате перекристаллизации и метаморфизма известняков и доломитов. Разнообразен по окраске,
нередко с красивым узором, хорошо принимает полировку. Декоративный и поделочный камень.Слайд 4известняк
осадочная горная порода, состоящая главным образом из кальцита, редко —
из арагонита; часто с примесью доломита, глинистых и песчаных частиц.
Известняки нередко содержат остатки известковых скелетов ископаемых организмов. Используется в металлургии (флюсы ), строительстве, химической промышленности и др.Слайд 5 кораллы
КАЛЬЦИТ (известковый шпат),
минерал класса карбонатов, СаСО3.
Примеси
Mg, Fe, Mn и др.
Твердость 3; плотность 2,7 г/см3.
Разновидности: исландский шпат, бумажный шпат (листоватый), антраконит — черный кальцит.
Строительный и поделочный материал; металлургический флюс.
Слайд 6Гипс
от греч. gypsos —
мел, известь,
минерал класса сульфатов, CaSO4·2H2O.
Бесцветные,
белые, серые кристаллы,
Твердость 1,5-2; плотность 2,3 г/см3.
Разновидности: гипсовый шпат
(полупрозрачные кристаллы); атласный шпат, или уральский селенит (параллельно-волокнистые агрегаты с шелковистым блеском), и алебастр (снежно-белый тонкозернистый гипс). Используется в строительстве, для гипсования почв, в медицине.
Слайд 7Поваренная соль
НАТРИЯ ХЛОРИД (поваренная соль), NaCl, бесцветные кристаллы. Растворяется в
воде. В природе натрия хлорид широко распространен в виде каменной
соли (галита), содержится в морской воде. Важная пищевая приправа; идет на получение едкого натра, хлора, соды.Слайд 9СОДА
Техническое название карбонатов
натрия. Нормальный карбонат
Na2CO3 называется содой кальцинированной;
гидрокарбонат NaHCO3 — питьевой
(пищевой).
Бесцветные кристаллы, раствори-
мость соответственно 14,9 г и 9,6 г в 100 г
воды при 20 °С; водные растворы имеют
щелочную реакцию. Na2CO3 получают
главным образом насыщением NH3 и СО2
раствора NaCl и дальнейшим нагрева-
нием до 1400 -160 °С, Na2CO3 применяют в
стекольной, мыловаренной, текстильной, целлюлозно-бумажной промышленности, для очистки нефти и т. д.
NaHCO3 — в производстве искусственных минеральных вод, в медицине, быту.
Слайд 10МЕДИ СУЛЬФАТ
CuSO4 - сернокислая медь. Растворяется в воде. Из водных
растворов кристаллизуется CuSO4 5H2O — медный купорос (ярко-синего цвета),
который применяется в сельском хозяйстве (для борьбы с вредителями и для протравливания зерна) и при получении минеральных красок.Слайд 11АММОНИЯ ХЛОРИД
NH4Cl- нашатырь, бесцветные кристаллы. Азотное удобрение
(до 25% N)
для нейтральных и щелочных почв под культуры,
слабо реагирующие
на избыток хлора (сахарная свекла, рис,
кукуруза). Применяют также в производстве сухих гальва-
нических элементов, при
паянии и лужении, в медицине,
как дымообразователь.
Слайд 12КАЛИЯ ПЕРМАНГАНАТ
KMnO4, темно-фиолетовые кристаллы. Растворим в воде. Цвет раствора красно-фиолетовый.
Сильный окислитель. Применяют для отбеливания тканей, в фотографии, аналитической химии,
как антисептическое средство в медицине.Марганцевые руды:
Слайд 13ХЛОРАТЫ
соли хлорноватой кислоты HClO3. Кристаллы; при обычной температуре устойчивы, при
нагревании взрывоопасны. Важны: калия хлорат (бертоллетова соль), хлорат натрия NaClO3
и хлорат магния Mg(ClO3)2. Хлораты применяют как окислители, гербициды и дефолианты. Ядовиты.Слайд 14БУРА
Na2B4O7.10H2O.
В природе — минерал класса боратов, химический осадок усыхающих
бороносных соляных озер (напр., оз. Серлс, США).
Бесцветные кристаллы, tпл
60,8 °С, плохо растворяется в воде.Компонент флюсов для сварки металлов, шихты для глазурей, стекла и керамики, моющих средств, антисептик, консервирующее средство.
Слайд 15НИТРАТЫ
соли азотной кислоты HNO3,
твердые хорошо растворимые в воде вещества.
Традиционное русское название некоторых нитратов щелочных и щелочноземельных металлов и
аммония — селитры (аммонийная селитра NH4NO3, калийная селитра КNO3, кальциевая селитра Са(NO3)2 и др.Слайд 16Нахождение в природе и получение
Нитрат натрия NаNO3 (чилийская селитра) и
нитрат калия КNO3 (индийская селитра) встречаются в природе в Индии
и в Чили.В России натриевую селитру в виде белого налета получали при гниении различных органических остатков растительного и животного происхождения. Так как нитрат натрия гигроскопичен и не годится для изготовления пороха, его превращали в нитрат калия обработкой горячим насыщенным раствором КСl.
В настоящее время нитраты натрия и калия получают при нейтрализации азотной кислоты с использованием соды Na2CO3, поташа K2CO3 и др.
Слайд 17Физиологическое действие
Нитраты токсичны. Неорганические нитраты вызывают отек легких, тошноту, рвоту,
острую сердечно-сосудистую недостаточность. Смертельная доза для человека 8-15 мг/л, допустимое
суточное потребление 5мг/л. Для суммы нитратов Na, K, Ca, NH4 Пдк: в воде 45 мг/л, в почве 130 мг/кг, в овощах и фруктах (мг/кг): картофель 250, капуста белокочанная поздняя 500, морковь поздняя 250, свекла 1400, лук репчатый 80, кабачки 400, дыни 90, арбуз, груши, яблоки 60.Вдыхание паров органических нитратов, попадание их на кожу и в пищеварительный тракт вызывает головную боль, учащенное сердцебиение. Окисляют гемоглобин в метгемоглобин.