Слайд 1Основные положения теории строения органических веществ
А. М. Бутлерова
Слайд 2Задание 1
Рассчитайте степень окисления углерода в молекулах метана (СН4),этана (С2Н6)
и пропана (С3Н8).
Вопросы для обсуждения:
1. Какие значения степени окисления углерода
у вас получились? (-4,-3,-8/3)
2. Какая должна быть степень окисления у углерода? (-4,0,+2,+4)
Слайд 3Задание 2 Используя набор для составления моделей молекул, составьте модели
молекул метана, этана, пропана. Запишите структурные формулы этих веществ.
Вопросы
для обсуждения:
1. Сколько связей у углерода в молекуле метана? а в молекулах этана, пропана?
2. Как называется свойство атомов химических элементов, образовывать определенное количество химических связей?
3. Какова валентность углерода в этих соединениях?
4. В каком порядке соединены атомы в молекулах?
Слайд 4Задание3: Для формулировки положения вставьте пропущенные слова в предложение.
1
положение:
. . . в молекулах органических веществ . . . последовательно, согласно их . . . . Углерод в этих соединениях . . . .
Слайд 5Задание 4
Используя набор для составления моделей молекул, составьте модели молекул
метана (СН4), этана (С2Н6), пропана (С3Н8).
Запишите структурные формулы этих веществ
в тетрадь.
Вопросы для обсуждения:
1. Одинаков ли качественный состав предложенных вам веществ?
2. Одинаков ли количественный состав этих веществ?
3. Существуют ли сходства в строении этих веществ?
Слайд 6Задание 5: Сравните физические свойства метана, этана, пропана.
Газ, без цвета,
без запаха, плохо растворим
Вопросы для обсуждения:
1. Имеются ли сходства в
физических свойствах метана, этана, пропана?
2. Как называются вещества, имеющие сходное строение и свойства, но разный количественный состав?
Слайд 7Задание 6:
Для формулировки положения вставьте пропущенные слова в предложение.
2 положение:
. . . по строению органические вещества, имеют . . . свойства.
Слайд 8Задание 7:
Используя набор для составления моделей молекул, постройте две
молекулы состава С2Н6О так, чтобы соблюдался порядок соединения атомов. Запишите
структурные формулы этих веществ в тетрадь.
Вопросы для обсуждения:
1. Одинаково ли строение у получившихся молекул?
2. Как называются вещества, имеющие одинаковый состав, но разное строение?
Слайд 9Задание 8:
Вещества, которые у вас получились называются диметиловый эфир
и этиловый спирт. сравните свойства двух веществ между собой.
Слайд 10Задание 9:
Вопрос для обсуждения:
Отличаются ли свойства, предложенных сам веществ?
Для формулировки
положения вставьте пропущенные слова в предложение.
3 положение: . .
. веществ зависят не только от их состава, но и от . . . .
Слайд 11Задание 10:
В таблицу со свойствами веществ допишите физические свойства
этилового спирта и сравните свойства обоих веществ между собой.
Слайд 12Вопрос для обсуждения
Как вы думаете, повлиял ли атом кислорода на
другие атомы?
Для формулировки положения вставьте пропущенные слова в предложение.
4
положение: . . . в молекулах органических соединений . . . друг на . . . , изменяя . . . веществ.
Слайд 13Задание 11
Составьте структурные формулы двух изомеров состава С4Н10, расположив их
напротив друг друга.
Допишите к получившимся изомерам из задания 1 гомологи.
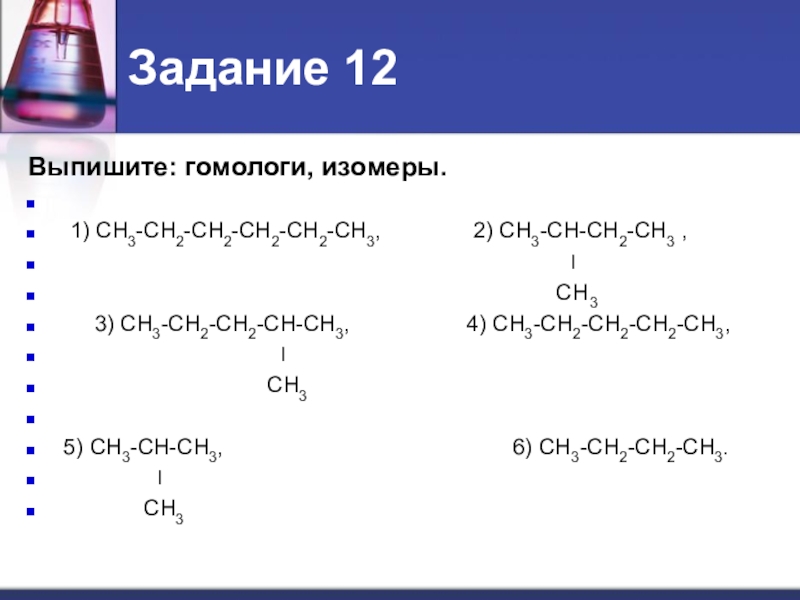
Слайд 14Задание 12
Выпишите: гомологи, изомеры.
1) СН3-СН2-СН2-СН2-СН2-СН3,
2) СН3-СН-СН2-СН3 ,
׀
СН3
3) СН3-СН2-СН2-СН-СН3, 4) СН3-СН2-СН2-СН2-СН3,
׀
СН3
5) СН3-СН-СН3, 6) СН3-СН2-СН2-СН3.
׀
СН3
Слайд 15Строение атома углерода. Ковалентная химическая связь
Слайд 17Формы АО
s-атомная орбиталь (сфера)
р-атомная орбиталь (объемная восьмерка)
Слайд 18Как можно объяснить четырехвалетность атомов углерода?
Основное состояние атома возбужденное
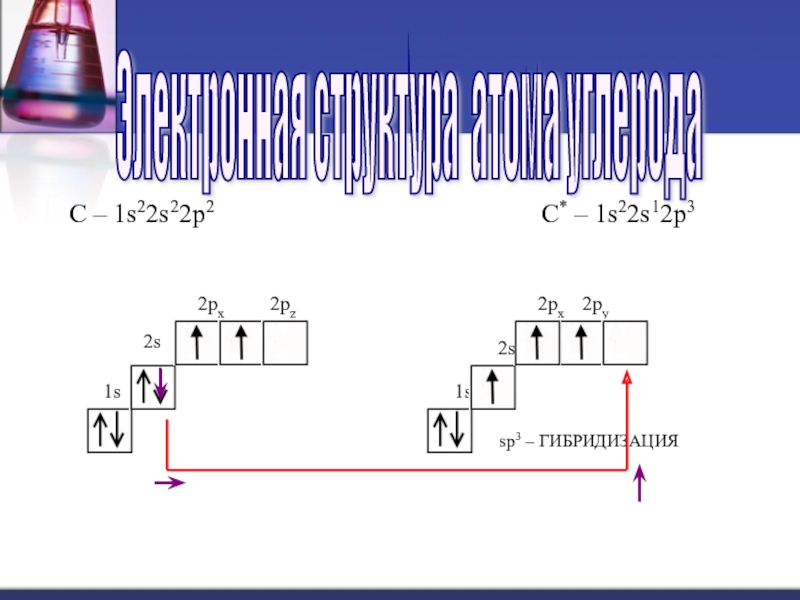
Слайд 191s
2px
2py
1s
2px
2py
2pz
sp3 – ГИБРИДИЗАЦИЯ
Электронная структура атома углерода
2s
2pz
С – 1s22s22p2
С*
– 1s22s12p3
Слайд 20Валентные состояния атома углерода. Гибридизация.
Процессы выравнивания орбиталей
по форме и
энергии
Слайд 21Для атома углерода возможны три типа гибридизации (три валентных состояния).
sр3-Гибридизация
sр2-Гибридизация
sр -Гибридизация
Слайд 22Первое валентное состояние углерода
sр3-Гибридизация - смешение одной 2s- и
трех 2р-орбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве
под углом 109°28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру - тетраэдр
Поэтому sp3-гибридизованный атом углерода часто называют "тетраэдрическим".
Состояние углеродного атома с sp3-гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов - алканов.
sp3 - тетраэдрическое
строение
sр3-Гибридизация
Слайд 23sр2-Гибридизация - смешение одной 2s- и двух 2р-орбиталей, одна 2p
не гибридизована и перпендикулярна плоскости, в которой расположены три sp2-гибридные
орбитали.
Состояние атома углерода с sp2-гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена - алкенов
Второе валентное состояние углерода
sp2 - плоскостное
строение
sр2-Гибридизация
Слайд 24Третье валентное состояние углерода
sр-Гибридизация - смешение одной 2s- и
одной 2р-орбитали. Две гибридные орбитали расположены на одной прямой линии
под углом 180° друг к другу. Остальные две негибридизованные 2р-орбитали расположены во взаимно перпендикулярных плоскостях.
Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда - алкинов.
sp - линейное
строение
sр-Гибридизация
Слайд 25ВОПРОС №1
Какой тип гибридизации не существует и
почему: sр3 , sp2 , sp4 , sp ?
ОТВЕТ:
sp4, т.к.
р – орбиталей только 3
Слайд 26ВОПРОС №2
Определите тип гибридизации каждого атома углерода в
молекулах веществ, структурные формулы, которых записаны ниже.
СН3 - СН2 -
СН3;
2) СН2 = СН - СН2 - СН3;
3) CH ≡ C - СН2 - СН3;
ОТВЕТ: 1. sp3, sp3, sp3
ОТВЕТ: 2. sp2, sp2,sp3, sp3
ОТВЕТ: 3. sp, sp, sp3, sp3
Слайд 27Виды перекрывания АО
Н + Н = Н–Н
С + Н =
С–Н
С + С = С–С
Слайд 28Вопрос
Какой вид химической связи характерен для органических веществ?
Слайд 29Ковалентная химическая связь -
химическая связь, образованная за счет обобществления пары
электронов.
по смещенности общихэл.пар
неполярная
полярная
по числу общихэл.пар
одинарная
двойная
тройная
по механизму образования
Обменный механизм
донорно-акцепторныймеханизм
Слайд 30Количественные характеристики ковалентной связи
Энергия связи-энергия, выделяющаяся при образовании, или поглощающаяся
при ее разрыве. Энергия связи характеризует ее прочность.
Н +
Н Н2+ 436кДж
Н2Н + Н –436кДж
Чем больше Есв., тем выше ее прочность.
Слайд 31Длина связи
-расстояние между центрами связанных атомов. Чем меньше длина, тем
прочнее химическая связь.
Чем больше Lсв., тем ниже ее прочность.