Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
рН среды и здоровье человека
Содержание
- 1. рН среды и здоровье человека
- 2. Автор – Саутенко Александр
- 3. Водородный
- 4. Водородный показатель имеет важное общебиологическое значение, в
- 5. Кислотно-щелочное состояние (КЩС) является важным компонентом гомеостаза.
- 6. В нашем организме существуют регуляторы Кислотно-щелочного состояния
- 7. Гидрокарбонатная буферная система является основным внеклеточным буфером.
- 8. Фосфатная буферная система представляет собой
- 9. Белки крови обладают свойствами слабых
- 10. На её долю которой приходится около 75%
- 11. На этом рисунке показано нормальное кислотно-щелочное состояние (рН) некоторых органов и жидкостей в нашем организме
- 12. Нарушения КЩС классифицируются, исходя из следующих положений.1.
- 13. При повышении концентрации ионов водорода в организме
- 14. Некоторые заболевания, сопровождающиеся раздражением дыхательного центра (травма
- 15. Роль почек в сохранении КЩС заключается в
- 16. Создается впечатление, что без жвачки поддержать кислотно-щелочной
- 17. Для определения кислотно-щелочного состояния существует метод pH-метрии.
- 18. Слайд 18
- 19. Определение кислотно-щелочного состояния в школьных
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3 Водородный показатель отражает активную
реакцию среды и определяется содержанием катионов водорода (Н+) и анионов
гидроксила (ОН-). Наличие этих ионов связано в первую очередь с диссоциацией молекул воды, протекающей по уравнениюHOH = H+ + OH-
При 25 °С произведение концентраций ионов водорода и гидроксила равно 10-14 грамм-ионов на 1 л воды. Когда концентрации обоих ионов равны, содержание каждого из них составляет 10 -7 грамм-ионов на 1 л, и реакция воды нейтральная. Увеличение концентрации одного из ионов вызывает соответствующее смещение реакции в кислую или щелочную область. Обычно о реакции воды судят по концентрации ионов водорода, используя, однако, не значение этой концентрации, а взятый с обратным знаком ее десятичный логарифм. Эта величина называется водородным показателем и обозначается символом рН. Выражение рН<7 указывает на кислую реакцию, рН > 7 - на щелочную; нейтральной среде соответствует рН = 7.
Водородный показатель (рН)
Слайд 4Водородный показатель имеет важное общебиологическое значение, в связи с чем
в процессе эволюции у большинства живых организмов выработался ряд механизмов,
обеспечивающих относительное постоянство этого показателя в клетке. Роль этого фактора определяется в первую очередь его влиянием на активность ферментов и состояние других белковых молекул. Кроме того, поскольку большинство реакций в клетках протекает в водной среде, избыток или недостаток ионов Н+ может существенно влиять на протекание также различных неферментативных реакций. Сказанное является основной причиной того, что большинство клеток, принадлежащих самым разным организмам, способно жить в узком диапазоне рН - от 6,0 до 8,0.Значение
Слайд 5Кислотно-щелочное состояние (КЩС) является важным компонентом гомеостаза. У здорового человека
рН крови находится на строго постоянном уровне, равном 7,4. Изменение
рН крови всего на 0,3 -0,4 в любую сторону приводит к значительному снижению ферментативной активности в средах организма и может закончиться летально. Количество веществ в организме, обладающих кислыми или щелочными свойствами, зависит от количества и характера принимаемой пищи, от интенсивности обменных процессов, от способа выделения этих веществ из организма и других факторов. В тоже время сохранение постоянства КЩС в организме обеспечивается наличием двух систем, препятствующих сдвигу рН крови и сред организма. Это так называемые буферные и физиологические системы.Кислотно-щелочное состояние –
важный компонент гомеостаза
Слайд 6 В нашем организме существуют регуляторы Кислотно-щелочного состояния – буферные системы.
Главным образом выделяют 4 буферных системы – Гидрокарбонатная, фосфатная, белков
крови и буферная система гемоглобин-оксигемоглобин. Механизм их действия достаточно прост. Встречаясь с агрессором, сильной кислотой или сильным основанием, эти системы проявляют свои буферные свойства и ослабляют их химическую активность. К физиологическим системам организма относятся легкие, почки, печень, желудочно-кишечный тракт. Механизм действия этих систем заключается в выделении ряда метаболитов, в результате которых происходит нормализация КЩС.Механизм действия буферных и физиологических
систем
Слайд 7 Гидрокарбонатная буферная система является основным внеклеточным буфером. Она состоит и
угольной кислоты (Н2СО3) и гидрокарбоната натрия (NaHCO3) или калия (KHCO3).
Соль, входящая в состав буферной системы, обладает свойствами основания и может быть акцептором ионов водорода. Образуется почками и является самой мощной буферной системой крови. Ей принадлежит 53% общего буферного действия крови (35% буферного действия плазмы и 18% эритроцита). При нормальном значении рН крови, равном 7,4, соотношение компонентов гидрокарбонатной буферной системы Н2СО3/NaНCO3 составляет 1:20.Действие гидрокарбонатной буферной системы крови при попадании в последнюю сильной кислоты или щёлочи можно иллюстрировать следующими реакциями:
Гидрокарбонатная буферная система
Слайд 8Фосфатная буферная система представляет собой смесь однозамещенного фосфата
NaH2PO4 - слабой кислоты и соли этой кислоты двузамещённого фосфата
Na2HPO4, обладающего щелочными свойствами. Она составляет основу буферной системы тканей и некоторых биологических жидкостей (моча, пищеварительные соки и т.д.). Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Эта буферная система имеет значение для внутриклеточного пространства.Фосфатная буферная система
Слайд 9 Белки крови обладают свойствами слабых кислот и поэтому
в смеси с солью сильного основания могут образовывать буферную систему.
В общем виде её можно представить так:R–COOH R–COO- + H+
R–COONa R–COO- + Na+
Благодаря белкам все клетки и ткани организма обладают определён- ным буферным действием; например, попадающее на кожу небольшое количество щёлочи и кислоты быстро нейтрализуется. В белковые буферные системы крови входят белки плазмы, гемоглобин (Hb) и оксигемоглобин (HbO2) эритроцитов.
Буферная система белков крови.
Слайд 10На её долю которой приходится около 75% буферной емкости крови,
характеризующаяся равновесием между ионами гемоглобина Hb- и самим гемоглобином H2b,
являющимися очень слабой кислотой (КH2b = 6, 3 × 10-9; рКH2b = 8, 2).Hb- + Н+ ⇔ H2b
Hb- + Н2О ⇔ H2b + ОН-
а также между ионами оксигемоглобина HbО2 - и самим оксигемоглобином Н2bО2, который является несколько более сильной, чем гемоглобин, кислотой (КН2bО2 = 1. 12 × 10-7; рКH2bО2 = 6, 95):
HbО2- + Н+ ⇔ H2bО2
HbО2 - + Н2О ⇔ H2bО2 + ОН-
Гемоглобин H2b, присоединяя кислород, образует оксигемоглобин H2bО2
H2b + О2 ⇔ H2bО2
и, таким образом, первые два равновесия взаимосвязаны со следующими двумя.
Буферная система
Оксигемоглобин-гемоглобин
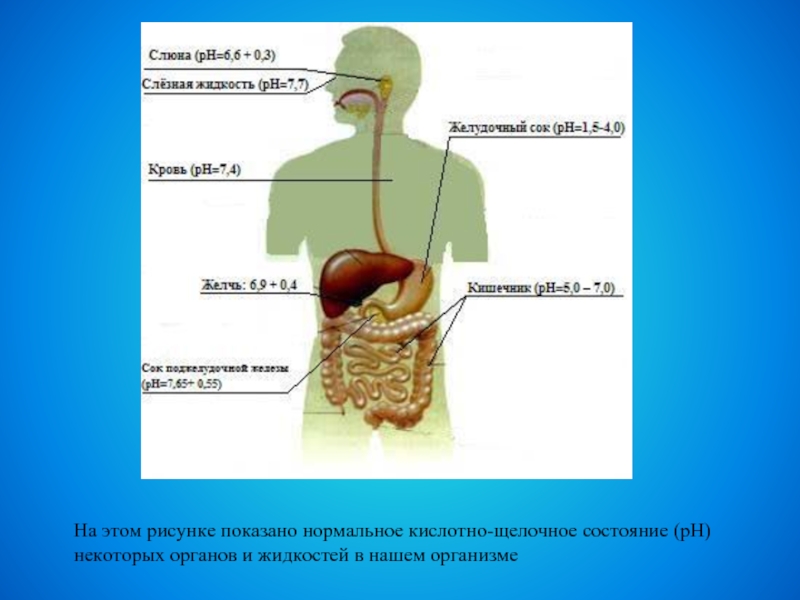
Слайд 11На этом рисунке показано нормальное кислотно-щелочное состояние (рН) некоторых органов
и жидкостей в нашем организме
Слайд 12
Нарушения КЩС классифицируются, исходя из следующих положений.
1. По направлению изменения
показателей КЩС:
Ацидоз. Алкалоз
2. По степени компенсации изменений:
Компенсированный. Декомпенепрованный
3. По этиологии:
Дыхательный.
Метаболический4. По степени участия этиологических факторов:
Простой (только один фактор, например, газовый) Смешанный (несколько этиологических факторов).
Не углубляясь в сложную медицинскую терминологию, рассмотрим один пример.
Классификация
Слайд 13При повышении концентрации ионов водорода в организме (при поступлении или
образовании сильных кислот-агрессоров) бикарбонатная буферная система переводит сильные кислоты в
слабые с последующим их распадом на углекислоту и воду. Углекислый газ раздражает дыхательный центр, возникает одышка, а избыток СО2 выводится из организма. При избыточном накоплении щелочных веществ возникает повышенная потребность в угольной кислоте, которая расходуется на нейтрализацию этих щелочей. При этом в организме уменьшается концентрация СО2 -интенсивность стимуляции дыхательного центра уменьшается: возникает брадипноэ и гиповентиляция. Это приводит к восполнению запасов угольной кислоты в организме.При заболеваниях легких, сопровождающихся ухудшением вентиляции (пневмония, отек легких, ателектаз) углекислота не может быть удалена в достаточной степени. В результате этого происходит накопление ионов водорода, рН крови снижается и возникает респираторный или дыхательный ацидоз.
Респираторный ацидоз
Слайд 14Некоторые заболевания, сопровождающиеся раздражением дыхательного центра (травма черепа, кровоизлияние в
мозг), а также ошибочный выбор параметров искусственной вентиляции легких вызывают
«центральную» одышку и гипервентиляцию. Длительное избыточное выделение СО2 приводит к связыванию ионов водорода и увеличением рН крови. Возникает респираторный алкалоз.Респираторный алкалоз
Слайд 15Роль почек в сохранении КЩС заключается в выведении ионов водорода
из кислой крови или ионов бикарбоната из щелочной. Ионы водорода
экскретируются с мочой благодаря реакции с фосфатным буфером. При этом в канальцевом аппарате почек происходит реабсорбция натрия, который соединяется с ионом бикарбоната и в виде бикарбоната натрия поступает в венозную кровь, пополняя его запасы в организме. При алкалозе поступающий к клеткам почечных канальцев ион водорода задерживается, а ион бикарбоната реабсорбируется и выводится почками.Роль почек в сохранении
КЩС
Слайд 16Создается впечатление, что без жвачки поддержать кислотно-щелочной баланс некому или
нечему. Но это не так. Кислотно-щелочной баланс полости рта -
это некая константа нашего организма, и определяется она кислотно-щелочным балансом слюны. Кислотно-щелочное равновесие (баланс) слюны в свою очередь определяется аналогичным равновесием в крови, которая питает слюнные железы. Буферные системы удерживают рН в допустимом для организма диапазоне. Ими самостоятельно принимаются меры по установлению необходимого равновесия: ощелачивание крови в одном случае и окисление ее - в другом.Поэтому жвачка не может влиять на КЩС. Какое бы изменение она ни вносила в кислотно-щелочной баланс ротовой полости, очень скоро он восстановится до оптимальной для организма величины.
Чтобы существенно влиять на кислотно-щелочной баланс в полости рта, нужно жевать и жевать эту самую жвачку, не переставая. Причем делать это даже ночью.
Вывод: в смысле поддержания "нужного кислотно-щелочного баланса" способности жвачки весьма сомнительны.
Поддерживает ли жвачка кислотно-щелочной баланс в полости рта.
Слайд 17Для определения кислотно-щелочного состояния существует метод pH-метрии. Он очень прост
и максимально точен, так как в этом методе используются самые
передовые компьютеры и новейшие изобретения современной медицины. Этот метод показывает точные значения pH проверяемого раствора.Существует несколько видов таких аппаратов, но принцип их действия сводится к одному. В них находятся два электрона, один из которых – активный и реагирующий с самой средой, а другой – референтный, служит для сравнения с полученными результатами. Мною проводилось несколько опытов по определению КЩС разных сред, один из которых именно этот.
Определение Кислотно-щелочного
состояния в лаборатории