Слайд 1Презентация по химии
для учащихся 9 класса
на тему: «Углекислый газ»
МБОУ
–Раздольненская средняя общеобразовательная школа №19
Новосибирского района Новосибирской области
Выполнила: учитель химии
Евстегнеева
Алевтина Васильевна
с. Раздольное 2011
Слайд 2Структурная формула углекислого газа
О=С=О
Молекулярная формула углекислого газа
СО2
Слайд 3Физические свойства
Оксид углерода (IV) – бесцветный газ, примерно в 1,5
раза тяжелее воздуха, хорошо растворим в воде без запаха, не
горюч, не поддерживает горение, вызывает удушье. Под давлением превращается в бесцветную жидкость, которая при охлаждении застывает.
Слайд 4Образование оксида углерода (IV)
В промышленности – побочный продукт при производстве
извести.
В лаборатории при взаимодействии кислот с мелом или
мрамором.
При сгорании углеродсодержащих веществ.
При медленном окислении в биохимических процессах (дыхание, гниение, брожение).
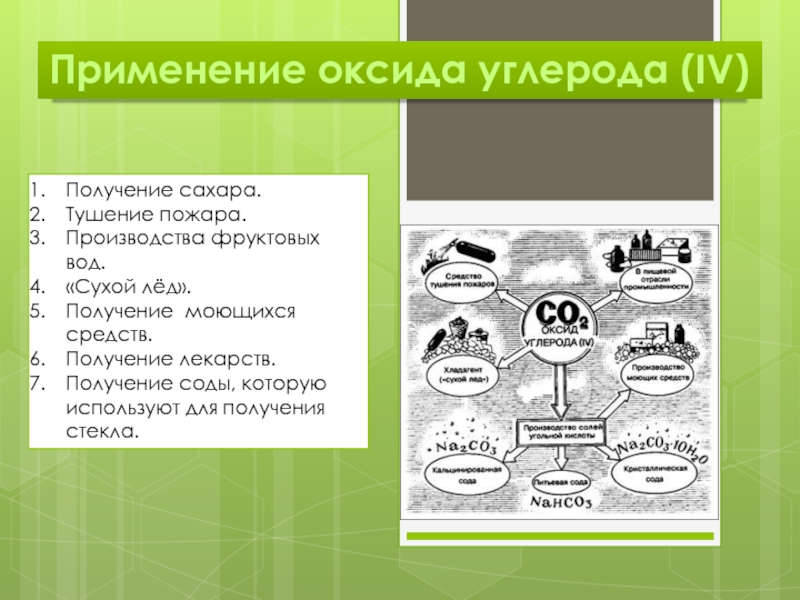
Слайд 5Применение оксида углерода (IV)
Получение сахара.
Тушение пожара.
Производства фруктовых вод.
«Сухой лёд».
Получение моющихся
средств.
Получение лекарств.
Получение соды, которую используют для получения стекла.
Слайд 6Мы ловим дым
Горение связано с появлением дыма. Дым бывает белым,
черным, а иногда – невидимый. Над горячей свечой или спиртовкой
поднимается такой «невидимый» дым, называемый углекислым газом.
Чистую пробирку подержи над свечей и улови немного «невидимого» дыма.
Чтобы он не улетел, быстро закрой пробирку пробкой без отверстия. Углекислый газ будет невидим и в пробирке. Сохрани эту пробирку с углекислым газом для дальнейших опытов.
Слайд 7«Мутная история»
Налей немного известковой воды (чтобы покрыть дно) в ту
пробирку, в которую ты уловил углекислый газ от пламени свечи.
Закрой пробирку пальцем и встряхни ее. Прозрачная известковая вода стала совсем мутной. В этом виноват только углекислый газ. Если возьмёшь известковой воды в пробирку, в которой не было углекислого газа, и встряхнешь пробирку, то вода останется прозрачной. Значит, помутнение известковой воды является доказательством того, что в пробирке был углекислый газ.
Слайд 8Из соды выделяется
углекислый газ
Возьми немного порошка соды и подогрей
его в горизонтальной укреплённой пробирке. Эту пробирку соедини коленчатой трубкой
с другой пробиркой, в которой находится вода. Из трубки начнут появляться пузырьки. Следовательно, из соды в воду поступает какой то газ. Не следует допускать, чтобы стеклянная трубка была опущена в воду после окончания нагрева, иначе вода поднимется по трубке и попадет в горячую пробирку с содой. От этого
пробирка может лопнуть. После того, кок ты увидишь, что из соды при нагревании выделяется газ, попробуй заменить простую воду в пробирке известковой водой.
Она станет мутной. Из соды выделяется углекислый газ.
Слайд 9Лимонадный газ –
это тоже углекислый газ
Если ты откроешь бутылку
с лимонадом или же начнешь её взбалтывать, то в ней
появится множество газовых пузырьков. Закрой бутылку с лимонадом пробкой, в которую вставлена стеклянная трубка, и опусти длинный конец трубки в пробирку с известковой водой. Вскоре вода станет мутной. Значит, лимонный газ – это углекислый газ. Он образуется из содержащей в лимонаде угольной кислоты.
Слайд 10Уксус выгоняет из соды
углекислый газ
Углекислый газ содержит в ряде
веществ, но определить его на глаза невозможно. Если ты польёшь
уксусом кусочек соды, то уксус сильно зашипит и при этом из соды выделится какой то газ. Если ты положишь кусочек соды в пробирку, нальёшь в нее немного уксуса, закроешь пробкой с коленчатой трубкой и опустишь длинный конец трубки в известковую воду, то убедишься, что из соды так же выделяется углекислый газ.
Слайд 11Фабрика лимонада
Даже слабая кислота выгоняет из соды углекислый газ. Покрой
дно пробирки лимонной кислотой и насыпь поверху нее столько же
соды. Смешай эти два вещества. Оба они уживаются, но ненадолго. Высыпь эту смесь в обыкновенный стакан и быстро наполни его свежей водой. Как сильно она шипит и пенится! Как настоящий лимонад. Ты спокойно можешь отпить его. Это абсолютно безвредно, даже вкусно. Надо только в самом начале добавить сахар, просто чтобы было вкуснее.
Слайд 12Лимонад в кармане
Углекислый газ в напитках увеличивает их освежающее
действие.
Ты можешь в любое время приготовить пенящийся лимон. Для этого
надо в пробирке смешать 2 кубических сантиметра порошка лимонной кислоты, 2 кубических сантиметра соды и 6 кубических сантиметра истолченного в порошок сахара. Эти
три вещества надо тщательно перемешать, встряхивая, и высыпая на большой лист бумаги. Это количество надо разделить на равные порции. Каждая порция должна быть такой величины, чтобы её можно было покрыть круглое дно пробирки. Каждую порцию заверни в отдельную бумажку, как заворачивают порошки в аптеке. Из
одного такого пакетика можно получить стакан освежающего лимонада.
Слайд 13Известняк выделяет
углекислый газ
Если при смачивании какого – либо вещества
кислотой появляется пена, почти всегда это происходит от выделяющего
углекислого газа.
Именно он и образует эту пену. Смоченный известняк шипит и пенится, из него выделяется углекислый газ. Если ты не уверен в этом, сделай опыт: положи кусочек известняка в пробирку и подлей кислоты, затем закрой пробирку пробкой со стеклянной трубкой и опусти длинный конец этой трубки в известковую воду. Вода помутнеет. Существует несколько видов извести. Известняк – это углекислый кальций.
Слайд 14Тонущее пламя
Согретый углекислый газ, или дым, легок и свободно поднимается
в воздух, холодный углекислый газ тяжёл, оседает на дно сосуда
и наполняет его постепенно до краёв. В углекислом газе горение невозможно, так как он сам является продуктом горения. Если ты поставишь свечу на дно какого – нибудь сосуда
и некоторое время понаблюдаешь за ней, то увидишь, что пламя вскоре погаснет.
Углекислый газ, преобразовавшийся при горении свечи, постепенно наполнить сосуд до краёв, и пламя «утонет» в углекислом газе.
Слайд 15Источник информации
Д. Шкурко, «Забавная химия», Ленинград, «Детская литература», 1976 г.
Джейм
Верзейм, Крис Окслейд, «Химия. Школьный иллюстрированный справочник», «РОСМЭН», 1995 г.
Ф.Г.
Фельдман,Г.Е. Рудзитис, «Химия 9. Учебник для 9 класса средних общеобразовательных заведений», М. , «Просвещение», 1994 г.
Источники иллюстраций
http://www.tonis.ua/content/news/thumbnail/320x240/349.jpg
http://img.lenta.ru/news/2006/10/27/morgan/picture.jpg
http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h=214
http://him.1september.ru/2004/36/23-1.jpg
http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg
http://img.lenta.ru/science/2004/10/11/carbon/picture.jpg
http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif
http://www.qualenergia.it/sites/default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324
http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg