Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты. Классификация и свойства
Содержание
- 1. Кислоты. Классификация и свойства
- 2. Загадки1. Если в паре элементовКислород вторым стоит,Ты же знаешь эта параНазывается…ОКСИД
- 3. Загадки2. Если формулы началоНачинается с металла,ОН –
- 4. Выполни заданиеHCl, Ca(OH)2, K2O, HNO3, Al2O3, NaOH, H2SO4, Fe(OH)3, Li2OЗаполните таблицу:
- 5. Проверка
- 6. Кислоты
- 7. Цель урока: изучить строение, классификацию и свойства кислот, а также познакомиться с основными представителями данного класса.
- 8. Задание:из приведенных веществ выберите только кислоты и
- 9. Кислоты – это сложные вещества, состоящие из катионов водорода и анионов кислотного остатка.
- 10. Физминутка
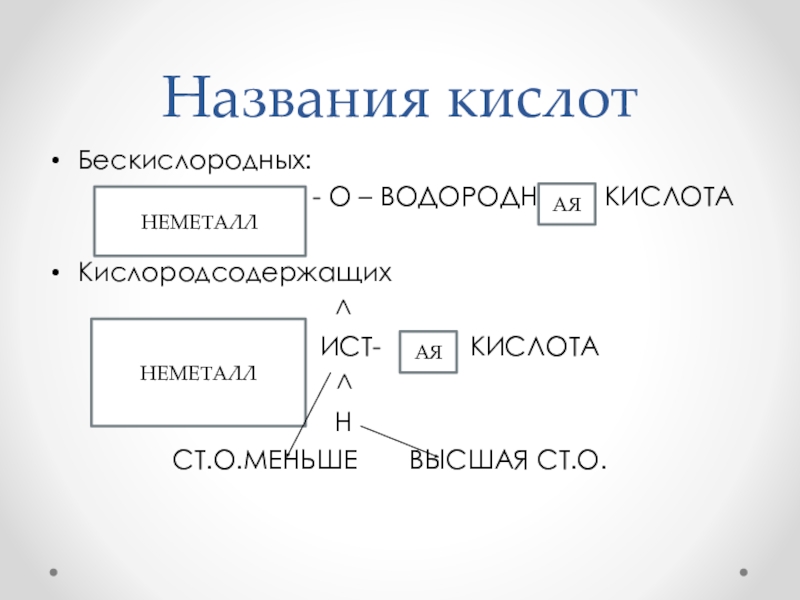
- 11. Названия кислотБескислородных:
- 12. Классификация кислот.Скажите, есть ли отличия в приведенных парах кислот? H2SO4 и H2SHNO2 и HBr
- 13. КИСЛОТЫКИСЛОРОДСОДЕРЖАЩИЕБЕСКИСЛОРОДСОДЕРЖАЩИЕH2SO4HNO2H2SHBr
- 14. Классификация кислотРаспределите представители кислот признакам различия между ними: H2SO4, HNO2, H3PO4HNO2H2SO4H3PO4
- 15. СЕРНАЯ КИСЛОТА
- 16. Техника безопасностиЧтоб с Кислотой без опаски общаться,
- 17. Техника безопасностиИ напомню я вам, наверное, Как
- 18. Техника безопасностиЕсли незнайка, наоборот, На кислоту вдруг
- 19. Техника безопасностиЕсли пролил кислоту на одежду, Сам
- 20. Роберт БойльОднажды английский химик Р. Бойль, изучая
- 21. Распознание кислот
- 22. Итак, подводя итоги… Задание
- 23. HBr H2CO3H3PO4 H2SHCl H2SiO3 H2SO4 Ответ
- 24. Итак, подводя итоги… «Третий лишний»Укажите кислоту, которая
- 25. Ответа)H2S – сероводородная кислотаб) H3PO4 – фосфорная кислотав) HNO3 – азотная кислота
- 26. Итак, подводя итоги…Ребята решили укомплектовать свою учебную
- 27. Ответ
- 28. РефлексияПомоги учителю высушить колбы
- 29. Домашнее задание§20, упр. 3, 4
- 30. Спасибо за урок!
- 31. Скачать презентанцию
Загадки1. Если в паре элементовКислород вторым стоит,Ты же знаешь эта параНазывается…ОКСИД
Слайды и текст этой презентации
Слайд 3Загадки
2.
Если формулы начало
Начинается с металла,
ОН – красуется затем,
Вещества знакомы
всем.
Не надо придумывать им название
Ведь эти вещества - …
ОСНОВАНИЯ
Слайд 7Цель урока:
изучить строение, классификацию и свойства кислот, а также
познакомиться с основными представителями данного класса.
Слайд 8Задание:
из приведенных веществ выберите только кислоты и запишите их в
колонку «Формула кислоты»:
HCl, Ca(OH)2, K2O, HNO3, Al2O3, NaOH, H2SO4,
Fe(OH)3, Li2O, H2S, K2O, HI, Zn(OH)2, HBr, H2SO3, CO2, H2SiO3, Cr(OH)3, H3PO4, ZnO, HNO2, Cu(OH)2, H2CO3, P2O5, H3PO4Слайд 11Названия кислот
Бескислородных:
-
О – ВОДОРОДН КИСЛОТАКислородсодержащих
^
ИСТ- КИСЛОТА
^
Н
СТ.О.МЕНЬШЕ ВЫСШАЯ СТ.О.
НЕМЕТАЛЛ
АЯ
НЕМЕТАЛЛ
АЯ
Слайд 12Классификация кислот.
Скажите, есть ли отличия в приведенных парах кислот?
H2SO4
и H2S
HNO2 и HBr
Слайд 14Классификация кислот
Распределите представители кислот признакам различия между ними:
H2SO4, HNO2,
H3PO4
HNO2
H2SO4
H3PO4
Слайд 16Техника безопасности
Чтоб с Кислотой без опаски общаться,
Надо бы знать, как
с ней обращаться... Так, например, чтобы жертвой не стать, Надо вам знать,
что к чему приливать.Слайд 17Техника безопасности
И напомню я вам, наверное,
Как разбавляют кислоту серную.
Если решили
ее разбавлять,
В воду должны вы ее приливать.
Слайд 18Техника безопасности
Если незнайка, наоборот,
На кислоту вдруг воду польет,
То, чуть коснувшись,
вода закипает –
Брызги летят и в глаза попадают
Слайд 19Техника безопасности
Если пролил кислоту на одежду,
Сам виноват, потому что —
невежда, Свойства кислот не учил ты прежде, И результат – дыра на
одеждеСлайд 20Роберт Бойль
Однажды английский химик Р. Бойль, изучая свойства соляной кислоты,
случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя
некоторое время лепестки стали ярко-красными. Оказалось, что и васильки, и розы, и цветки некоторых других растений изменяли свою окраску при действии кислот.Слайд 22
Итак, подводя итоги…
Задание №1
Дан «текст», в котором «спрятаны» формулы кислот.
Подчеркните и назовите их.
H2OSOHBrNa2CO3MgBaH2CO3SO4KOH
H3PO4P2O5CaH2SHPH3NO2CS2NH3CO3
HClBaSHKSHH2NaOH2SiO3NaClH2SO4
Слайд 24Итак, подводя итоги…
«Третий лишний»
Укажите кислоту, которая не соответствует признаку, объединяющему
две другие. Назовите кислоты.
а)H2S
б)H2SO4 в)HNO3HNO3 H3PO4 HF
H3PO4 H2CO3 HBr