Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углеводы химия
Содержание
- 1. Углеводы химия
- 2. СодержаниеКлассификация углеводовМоносахаридыНахождение в природеИзомерияПолучениеФизические свойстваХимические свойстваИсточники информации
- 3. Классификация углеводовУглеводы входят в состав клеток и
- 4. УглеводыМоносахариды пентозы – рибоза C5H10O5, дезоксирибоза C5H10O4,гексозы
- 5. МоносахаридыУглеводы имеют общую формулу Cn(H2O)m.Моносахариды являются
- 6. Нахождение в природеВ свободном виде глюкоза содержится
- 7. Изомерия Наиболее часто встречаются два
- 8. ПолучениеВ свободном виде в природе встречается
- 9. Впервые глюкоза получена в 1811 году русским
- 10. В промышленности глюкозу получают гидролизом крахмала в
- 11. Физические свойства Моносахариды – твердые вещества, легко
- 12. Химические свойства Моносахариды проявляют свойства спиртов икарбонильных
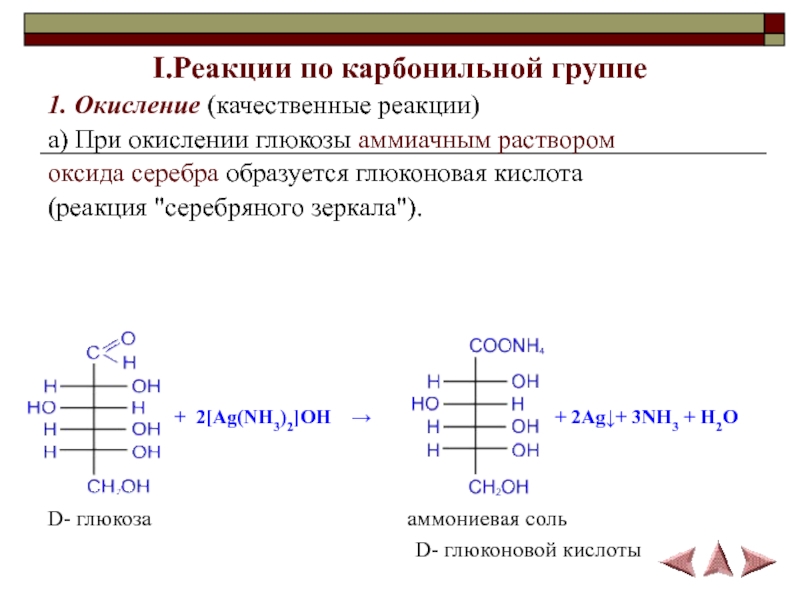
- 13. I.Реакции по карбонильной группе1. Окисление (качественные реакции)а)
- 14. б) Реакция глюкозы с гидроксидом меди при
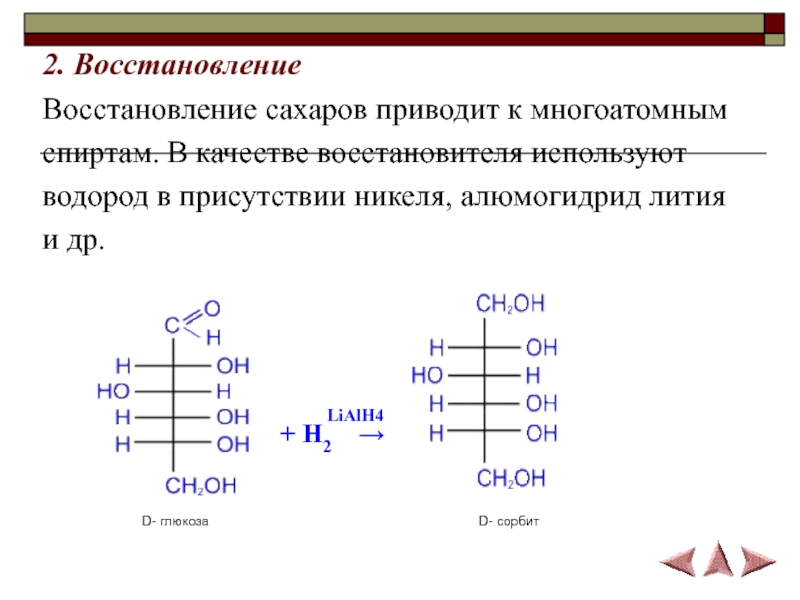
- 15. 2. Восстановление Восстановление сахаров приводит к многоатомнымспиртам.
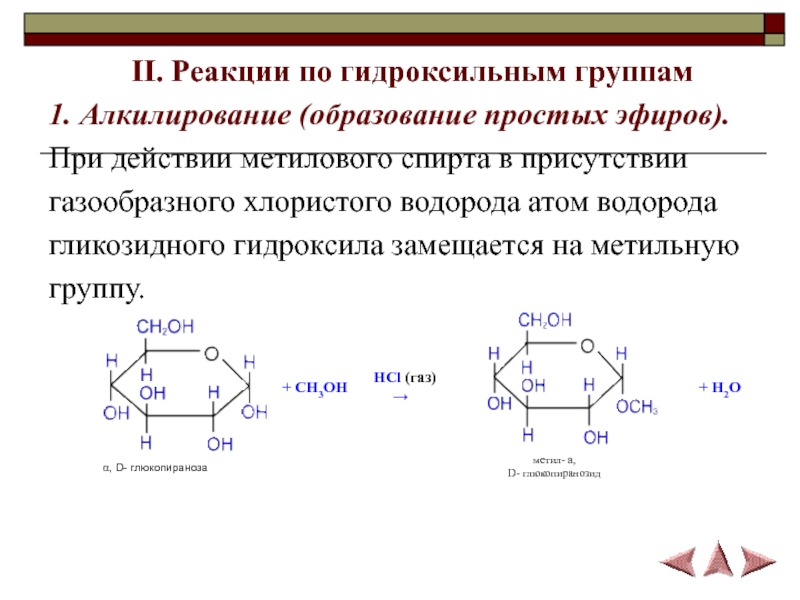
- 16. II. Реакции по гидроксильным группам1. Алкилирование (образование простых
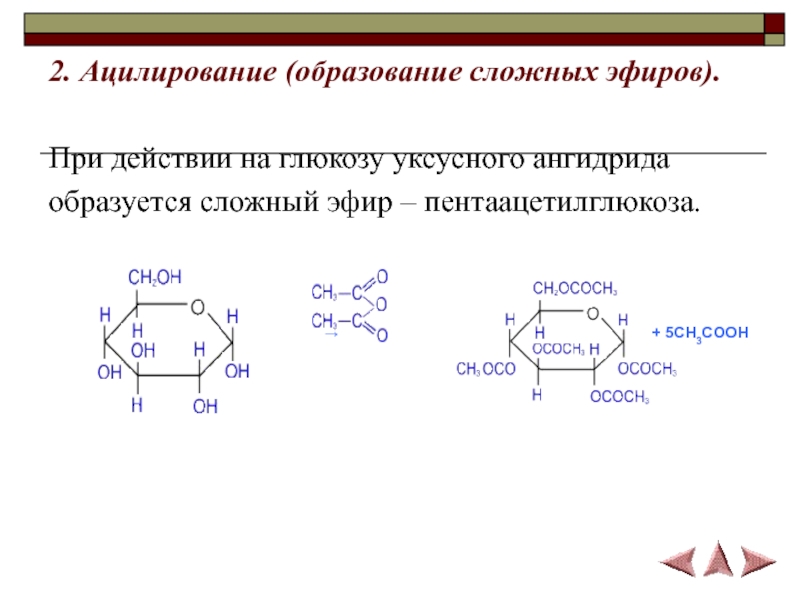
- 17. 2. Ацилирование (образование сложных эфиров).При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
- 18. 3. Как и все многоатомные спирты, глюкоза
- 19. III. Специфические реакцииГлюкоза характеризуется и некоторыми специфическими
- 20. б) молочнокислое брожение
- 21. г) маслянокислое брожение
- 22. IV.Горение и разложение глюкозы.Как все органические вещества,
- 23. Источники информации 1. Денисов В.Г. Химия. 10 класс.
- 24. 4. Хомченко Г.П. Пособие по химии для
- 25. 8. Малыхин З.В. Тестовые задания для проверки
- 26. Скачать презентанцию
СодержаниеКлассификация углеводовМоносахаридыНахождение в природеИзомерияПолучениеФизические свойстваХимические свойстваИсточники информации
Слайды и текст этой презентации
Слайд 2Содержание
Классификация углеводов
Моносахариды
Нахождение в природе
Изомерия
Получение
Физические свойства
Химические свойства
Источники информации
Слайд 3Классификация углеводов
Углеводы входят в состав клеток и тканей всех растительных
и животных организмов и по массе составляют основную часть органического
вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений - углекислого газа и воды (СО2 и Н2О).Углеводы делятся на три группы: моносахариды (монозы), дисахариды(биозы) и полисахариды (полиозы).
Слайд 4Углеводы
Моносахариды
пентозы – рибоза C5H10O5, дезоксирибоза C5H10O4,
гексозы – C6H12O6 глюкоза,
фруктоза.
Дисахариды
Сахароза, мальтоза C12H22O11 .
Полисахариды
Крахмал, целлюлоза, гликоген, хитин (C6H10O5 )n
Слайд 5
Моносахариды
Углеводы имеют общую формулу Cn(H2O)m.
Моносахариды являются гетерофункциональными соединениями. В их
молекулах одновременно содержатся и карбонильная (альдегидная или кетонная) и несколько
гидроксильных групп. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа).Слайд 6Нахождение в природе
В свободном виде глюкоза содержится почти во всех
органах зеленых растений. Особенно её много в соке винограда, поэтому
глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой.В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
Слайд 7Изомерия
Наиболее часто встречаются два моносахарида: глюкоза и
фруктоза. Они являются изомерами и имеют молекулярну
формулу С6H12O6.Глюкоза является
альдегидоспиртом, афруктоза – кетоноспиртом.
глюкоза – это альдоза фруктоза – это кетоза
Слайд 8
Получение
В свободном виде в природе встречается преимущественно глюкоза. Она же
является структурной единицей многих полисахаридов. Другие моносахариды в свободном состоянии
встречаются редко и в основном известны как компоненты олиго- и полисахаридов. В природе глюкоза получается в результате реакции фотосинтеза:6CO2 + 6H2O → C6H12O6(глюкоза) + 6O2
Слайд 9Впервые глюкоза получена в 1811 году русским химиком Г.Э.Кирхгофом при
гидролизе крахмала.
Позже синтез моносахаридов из формальдегида в щелочной среде
предложен А.М.Бутлеровым.O || Ca(OH)2
6 C–H → C6H12O6 | H
Слайд 10В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты.
H2SO4,t°
(C6H10O5)n + nH2O → nC6H12O6
крахмал глюкоза
Слайд 11Физические свойства
Моносахариды – твердые вещества, легко растворимые в воде,
плохо – в спирте и совсем нерастворимые в эфире. Водные
растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов обладают сладким вкусом, однако меньшим, чем свекловичный сахар.Слайд 12Химические свойства
Моносахариды проявляют свойства спиртов и
карбонильных соединений.
Вещества, проявляющие
характерные свойства двух
различных классов органических соединений,
имеют двойственную функцию.
Слайд 13I.Реакции по карбонильной группе
1. Окисление (качественные реакции)
а) При окислении глюкозы
аммиачным раствором
оксида серебра образуется глюконовая кислота
(реакция "серебряного зеркала").
D- глюкоза
аммониевая соль
D- глюконовой кислоты + 2[Ag(NH3)2]OH →
+ 2Ag↓+ 3NH3 + H2O
Слайд 14б) Реакция глюкозы с гидроксидом меди при
нагревании так же
приводит к образованию
глюконовой кислоты.
O O
// t //
CH2OH(CHOH)4 – C + Cu(OH)2 → CH2OH(CHOH)4 – C + CuOH ↓+ H2O
\ \ желтый
H OH
2CuOH → Cu2O↓ + H2O
красный
Слайд 152. Восстановление
Восстановление сахаров приводит к многоатомным
спиртам. В качестве восстановителя
используют
водород в присутствии никеля, алюмогидрид лития
и др.
Слайд 16II. Реакции по гидроксильным группам
1. Алкилирование (образование простых эфиров).
При действии метилового
спирта в присутствии
газообразного хлористого водорода атом водорода
гликозидного гидроксила
замещается на метильную группу.
Слайд 172. Ацилирование (образование сложных эфиров).
При действии на глюкозу уксусного ангидрида
образуется сложный эфир – пентаацетилглюкоза.
Слайд 183. Как и все многоатомные спирты, глюкоза с гидроксидом
меди
(II) дает интенсивное синее окрашивание (качественная
реакция).
O O O O // \\ // \\
C – H H – C C – H H – C
| | | |
H – C – OH HO – C – H H – C – O HO – C – H
| | | |
HO – C – H + Cu(OH)2 H – C – OH → HO – C – H H – C – OH
| | -2H2O | Cu |
H – C – OH HO – C – H H – C – OH HO – C – H
| | | |
H – C – OH HO – C – H H – C – OH O – C – H
| | | |
CH2OH CH2OH CH2OH CH2OH
раствор василькового цвета
Слайд 19III. Специфические реакции
Глюкоза характеризуется и некоторыми
специфическими свойствами – процессами
брожения.
Брожением называется
расщепление молекул сахаров под воздействием
ферментов (энзимов).
а) спиртовое
брожениеC6H12O6 → 2C2H5OH + 2CO2
глюкоза этиловый спирт
Слайд 20б) молочнокислое брожение
молочно-кислые
бактерииC6H12O6 → 2 CH3 – CH – COOH
|
OH
молочная кислота
в) лимоннокислое брожение OH
[O] |
C6H12O6 → HOOC – CH2 – C – CH2 – COOH
грибки |
COOH
лимонная кислота
Слайд 21г) маслянокислое брожение
масляно-кислые
бактерии
C6H12O6 →
CH3 – CH2 – CH2 – COOH + 2H2O +2CO2масляная кислота
Упомянутые виды брожения, вызываемые
микроорганизмами, имеют широкое практическое
значение. Например, спиртовое – для получения
этилового спирта, в виноделии, пивоварении и т.д.,
а молочнокислое – для получения молочной
кислоты и кисломолочных продуктов, лимоннокислое
- для получения лимонной кислоты.
Слайд 22IV.Горение и разложение глюкозы.
Как все органические вещества, глюкоза
может гореть
и разлагаться при
нагревании:
C6H12O6 + 6O2 → 6H2O + 6CO2t
C6H12O6 → 6H2O + 6C
Слайд 23Источники информации
1. Денисов В.Г. Химия. 10 класс. Поурочные
планы. –
Волгоград: Учитель, 2004.
2. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к
государственномуцентрализованному тестированию. – Саратов:
Лицей, 2002.
3. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981
Слайд 24 4. Хомченко Г.П. Пособие по химии для
поступающих в вузы.
– М.: ООО «Издательство
Новая Волна», 2002.
5. Курмашева К.К.
Химия в таблицах и схемах. Серия «Школа в клеточку». – М.: «Лист», 1997.
6. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
7. Штремплер Г.И. Тесты, вопросы и ответы по
химии: Книга для учащихя 8-11 классов
общеобразовательных учреждений. – М.:
Просвещение, 1999.
Слайд 25 8. Малыхин З.В. Тестовые задания для проверки
знаний учащихся по
органической химии. – М.: ТЦ
«Сфера», 2001.
9. Городничева И.Н. Контрольные
и проверочные работы по химии. 8-11 класс. – М.:
Аквариум, 1997.
10. Гаврусейко Н.П. Проверочные работы по
органической химии: Дидактический материал:
Пособие для учителя. – М.: Просвещение, 1991.