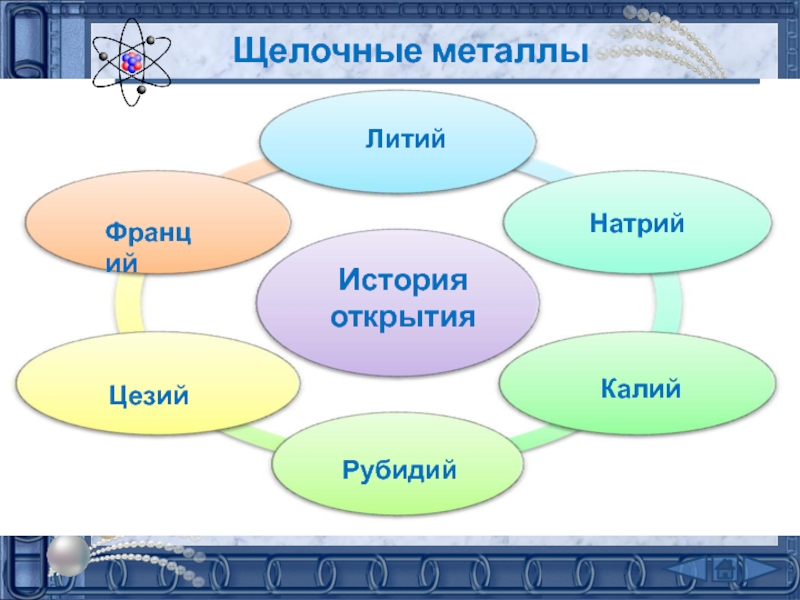
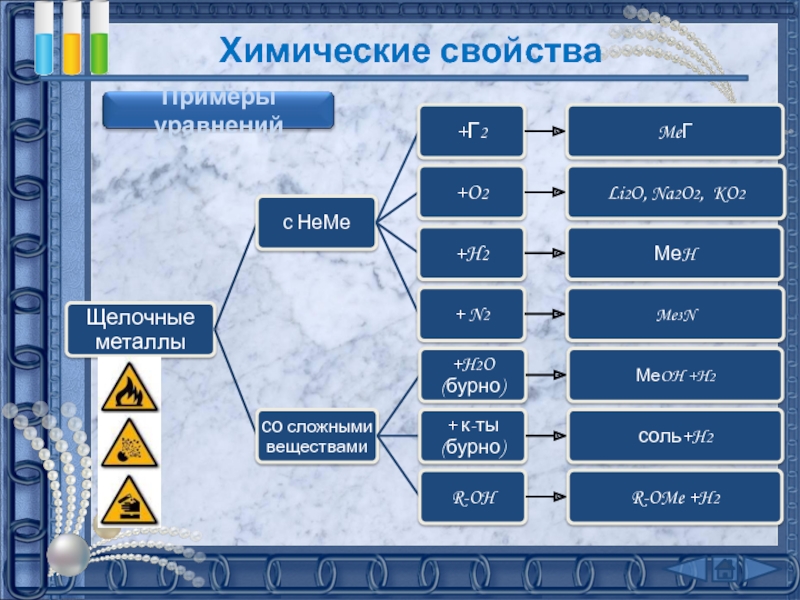
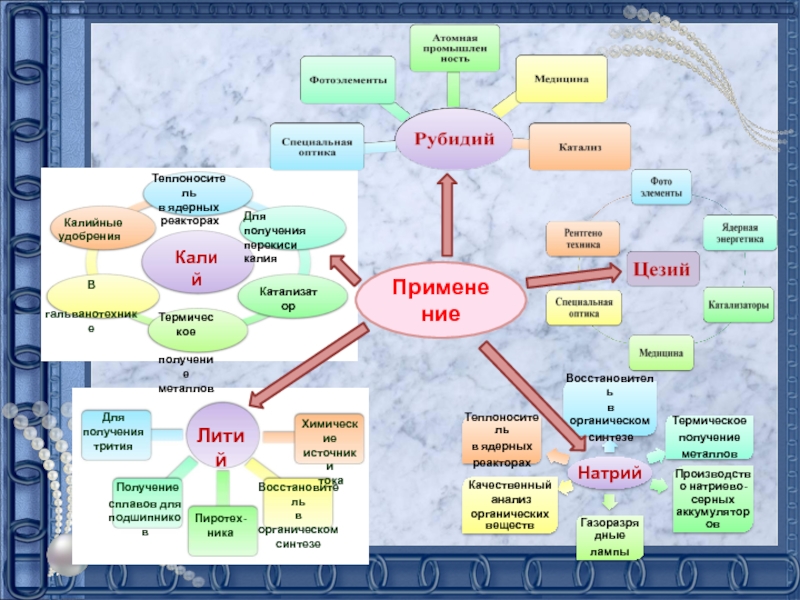
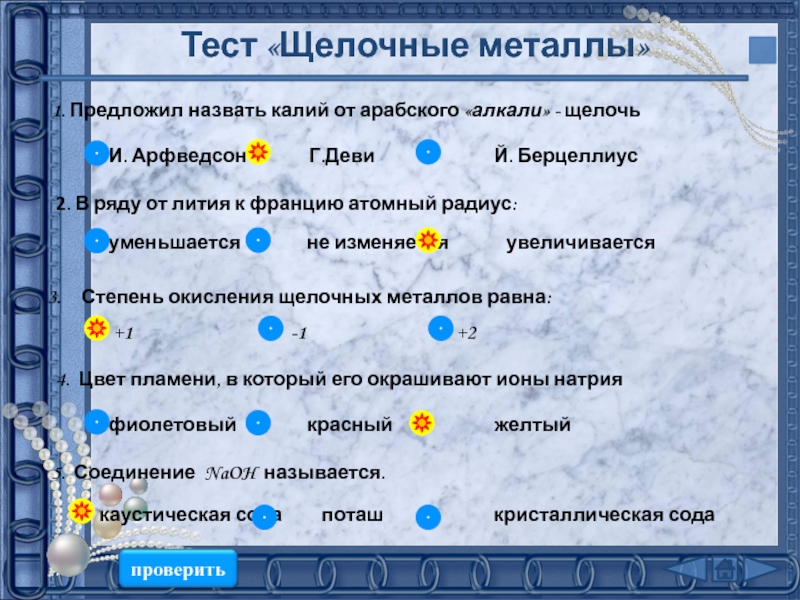
подгруппе:
Число электронов на внешнем слое не изменяется
Радиус атома увеличивается
Электроотрицательность
уменьшаетсяВосстановительные свойства усиливаются
Металлические свойства усиливаются