Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку по химии на тему "Темір"
Содержание
- 1. Презентация к уроку по химии на тему "Темір"
- 2. 113273205014Сандарды сөйлету
- 3. Слайд 3
- 4. №6 М.Мәметова атындағы орта мектебіТемір және оның
- 5. Естігенімді ұмытамын, көргенімді есте сақтаймын, ал өз
- 6. Слайд 6
- 7. Жалпы сипаттама. Периодтық жүйедегі орны және атом
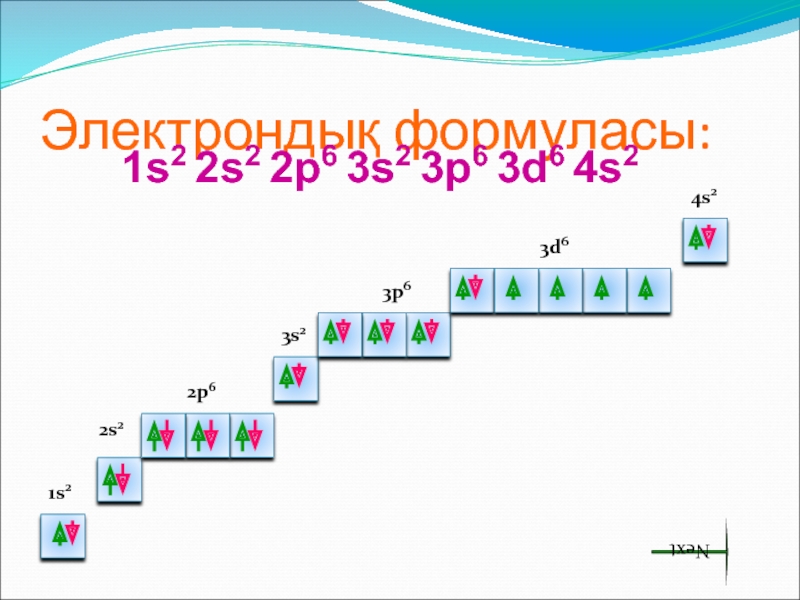
- 8. Электрондық формуласы:1s2 2s2 2p6 3s2 3p6 3d6 4s21s22s22p63s23p63d64s2Next
- 9. Темір химиялық реакцияларда 2 немесе 3 электрон
- 10. Темір Темірдің табиғатта таралуыПирит FeS2 Лимонит Fe2O3*п
- 11. Минералдар:Магнетит Гематит Next
- 12. Лимонит Пирит
- 13. Слайд 13
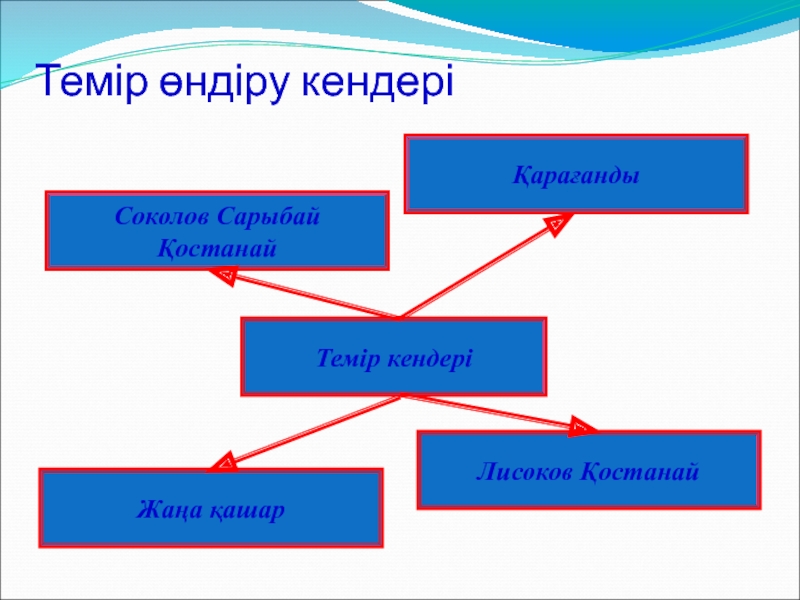
- 14. Темір өндіру кендері
- 15. Өнеркәсіпте алынуы:Темірді 3 түрлі әдіспен алуға болады:Пирометаллургиялық
- 16. Физикалық қасиеттері: Темір – жылтыр, күміс түстес ақ
- 17. Химиялық қасиеттері:I. Жай заттармен әрекеттесуі:Темір оттекте жанғанда
- 18. Ылғалды ауада тат түзеді: 4Fe + 2H2O +
- 19. II. Күрделі заттармен әрекеттесуі:Қатты қыздырылған темір су
- 20. Темірдің маңызды қосылыстары:Темір (ІІ) оксиді немесе (FeO)
- 21. Темір (ІІІ) оксиді Fe2O3 – амфотерлі оксид,
- 22. ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫ. Темірге тотығу
- 23. Темірдің гидроксидтеріТемірдің ІІ және ІІІ валентті оксидтеріне
- 24. ТЕМІР ҚОСЫЛЫСТАРЫН АНЫҚТАУҒе+3 темір ионын анықтау үшін
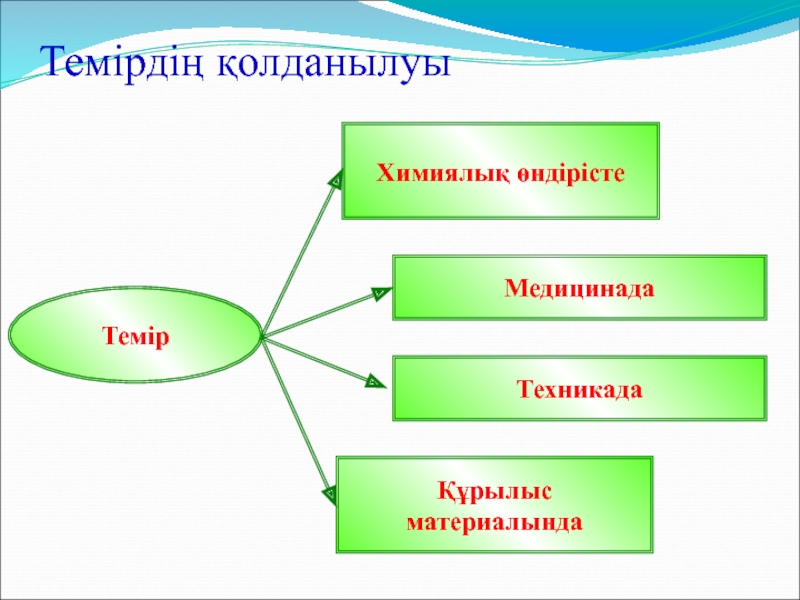
- 25. Темірдің қолданылуыХимиялық өндірісте Темір МедицинадаҚұрылыс материалында Техникада
- 26. Қолданылуы:Темір купоросы (FeSO4 ∙ 7H2O) – ағаш
- 27. Кім жылдам: берілген формулалардың индекстерін қойып шығу
- 28. Сәйкестендіру тестін орындау
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3
Қызығушылықты ояту.
Ой қозғау стратегиясы.Қара металлургияның жанымын
Машина трактордың қанымын.
VІІІ В топшада болсам да,
Металл атаулының ең көп қолданатын санымын.
Слайд 4№6 М.Мәметова атындағы орта мектебі
Темір және оның қосылыстары
Химия пәнінің мұғалімі : Таймасова Клара
Слайд 5Естігенімді ұмытамын, көргенімді есте сақтаймын, ал өз ақыл ойыммен
ітеген ісімді түсінемін ұстанымды алға қойып
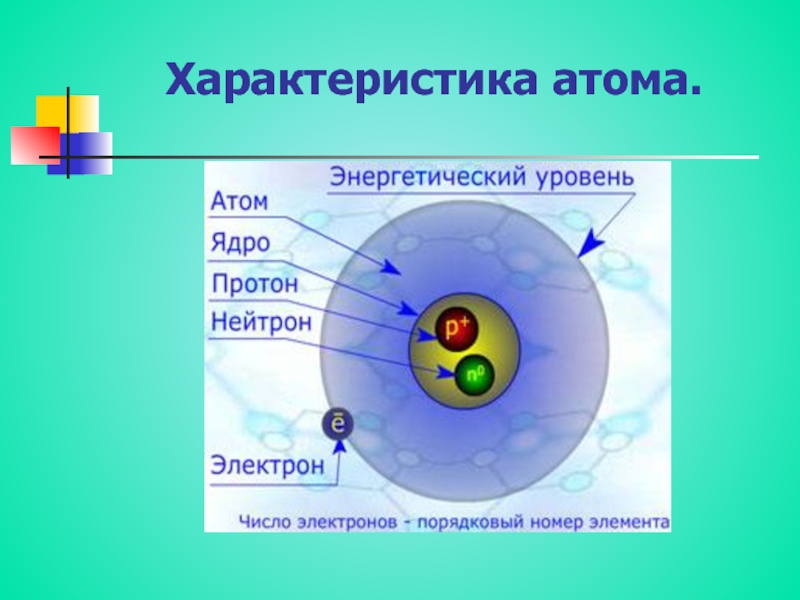
Слайд 7Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір – VIIIБ
топ элементі, d - элемент. Темірдің валенттік электрондары сыртқы s-e
және сырттан санағанда екінші деңгейдегі d-e болып табылады, сондықтан ол ауыспалы тотығу дәрежелерін көрсетеді.Next
Слайд 9 Темір химиялық реакцияларда 2 немесе 3 электрон беріп, өзінің тұрақты
қосылыстарында +2 және +3 тотығу дәрежелерін көрсетеді:
Fe0 – 2e
Fe2+Fe0 – 3e Fe3+
Темірдің тотығу дәрежесі +6 (K2FeO4 – калий ферраты) болатын тұрақтылығы төмен қосылыстары белгілі.
Back
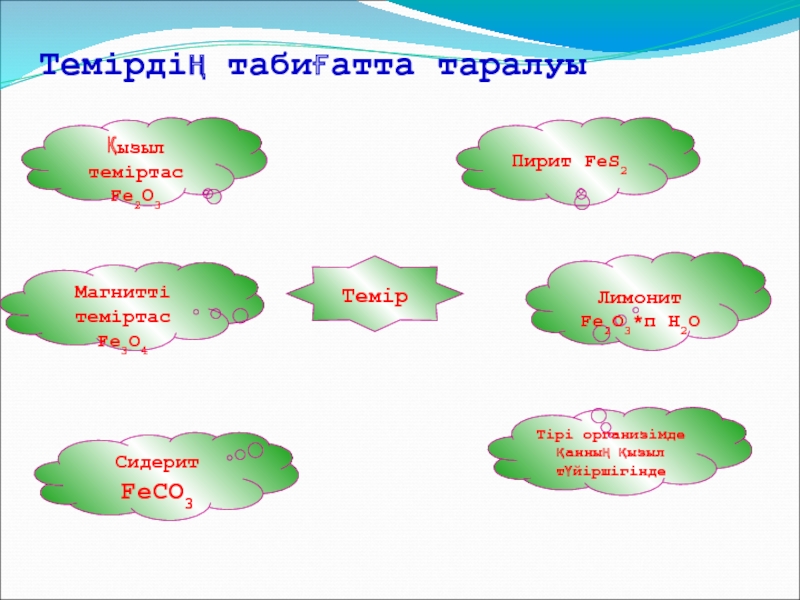
Слайд 10Темір
Темірдің табиғатта таралуы
Пирит FeS2
Лимонит Fe2O3*п H2O
Тірі организімде
қанның қызыл түйіршігінде
Магнитті теміртас Fe3O4
Сидерит FeCO3
Қызыл теміртас
Fe2О3 Слайд 15Өнеркәсіпте алынуы:
Темірді 3 түрлі әдіспен алуға болады:
Пирометаллургиялық әдіспен:
оксидінен тотықсыздандыру арқылы:
Fe2O3
+ 3H2 = 2Fe + 3H2O
соның ішінде алюминтермиялық әдіспен:
Fe2O3 +
2Al = Al2O3 + 2Feжәне көміртек (ІІ) оксидімен тотықсыздан-дыру арқылы:
Fe3O4 + 4CO = 3Fe + 4CO2
Back
Слайд 16Физикалық қасиеттері:
Темір – жылтыр, күміс түстес ақ металл, оның тығыздығы
– 7,87 г/см3. Балқу температурасы жоғары – 15390С. Темір иілімді,
магниттелетін және оны жоғалтатын қасиеті бар, осыған орай техникада кеңінен қолданылады. Темірді электрмотор, электрмагнит трансформаторларының өзекшесін және микрофон мембранасын жасауға қолданылады. Іс жүзінде темірдің құймалары – шойын мен болат көбірек қолданылады.Back
Слайд 17Химиялық қасиеттері:
I. Жай заттармен әрекеттесуі:
Темір оттекте жанғанда екі тотығу дәрежесін
де (+2, +3) көрсетеді, ұшқын шашыратып жанады:
3Fe + 2O2 =
Fe3O4Next
Слайд 18Ылғалды ауада тат түзеді:
4Fe + 2H2O + 3O2 = 4FeO(OH)
Белсенді
бейметалдар темірді тотықтырады:
2Fe + 3Cl2 = 2Fe3+ Cl3-
Fe + S
= FeS3Fe + C = Fe3C
Next
Слайд 19II. Күрделі заттармен әрекеттесуі:
Қатты қыздырылған темір су буымен әрекеттеседі:
Fe +
H2O = FeO + H2
Концентрлі азот және күкірт қышқылдарында темір
енжарланады, өйткені ерімейтін қосылыстардың қорғағыш қабатшасымен қапталады.Сұйылтылған азот және күкірт қышқылдарымен әрекеттесіп, темір тотықсызданады:
Fe + 4HNO3(сұйық) = Fe(NO3)3 + NO + 2H2O
Fe + H2SO4(сұйық) = FeSO4 + H2
Темір белсенділігі төмен металдарды олардың тұздарынан тотықсыздандырып, ығыстырып шығарады:
Fe + CuCl2 = FeCl2 + Cu
Back
Слайд 20Темірдің маңызды қосылыстары:
Темір (ІІ) оксиді немесе (FeO) – негіздік оксид,
оңай тотығатын қара ұнтақ, оны мына реакция бойынша алады:
Fe2O3 +
CO 2FeO + CO2Қышқылдармен және қышқылдық оксидтермен әрекеттесіп тұз түзеді:
FeO + 2HCl = FeCl2 + H2O
FeO + CO2 = FeCO3
Next
Слайд 21Темір (ІІІ) оксиді Fe2O3 – амфотерлі оксид, бірақ негіздік қасиеті
басымдау, ең тұрақты оксид, қызыл-қоңыр түсті, минералы гематит.
І. Алынуы: 1)
2Fe(OH)3 = Fe2O3 + 3H2O2) 3Fe + 2O2 = Fe3O4
3) 3Fe + 4HOH = Fe3O4 + 4H2
ІІ. Химиялық қасиеттері:
қышқылмен Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
қышқылдық оксидпен Fe2O3 + 3SO3 = Fe2(SO4)3
негізбен Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Next
Слайд 22
ТЕМІРДІҢ МАҢЫЗДЫ ҚОСЫЛЫСТАРЫ.
Темірге тотығу дәрежесі +2 және
+3 қосылыстардың екі қатары тән:
Fe О Ғе2О3
Темір (ІІ) оксиді Темір (ІІІ) оксиді
Fe (OH)2 Ғе (ОН)3
Темір (ІІ) гидроксиді Темір(ІІІ)гидроксиді
Ғе+2 тұздары Ғе+3 тұздары
Слайд 23Темірдің гидроксидтері
Темірдің ІІ және ІІІ валентті оксидтеріне екі түрлі гидроксидтері
сәйкес келеді.
Fe (II) гидроксиді – ақ түсті, ал Fe (III)
гидроксиді – қызыл-қоңыр түсті. Олар суда ерімейтін заттар.І. Алынуы. FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
FeCl3 + 2NaOH = Fe(OH)3 + 3NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Next
Слайд 24ТЕМІР ҚОСЫЛЫСТАРЫН АНЫҚТАУ
Ғе+3 темір ионын анықтау үшін калий тиоцианатын реактив
ретінде қолданады.
ҒеСІ3 + 3КSСN Ғе(SСN)3 + 3КСІ
Ғе+2 темір ионын анықтау үшін калий гексацианоферрат (ІІІ) реактив ретінде қолданады
Слайд 26Қолданылуы:
Темір купоросы (FeSO4 ∙ 7H2O) – ағаш сүрлеуде;
Fe3C – цементит
шойында қолданылады.
(NH4)2SO4 ∙ FeSO4 ∙ 6H2O – Мор тұзы,
тотықсыздандырғыш ретінде пайдаланылады.Fe(NH4)2 ∙ (SO4)2 ∙ 12H2O – темір-аммонийлі ашудас, тері илеуде қолданылады.
Fe2O3 – темір сүрегі (бояу) шатырларды бояуда, болат пен шыны беттерін тегістеуде, термиялық пісіруде қолданылады.
Next