Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Задачи на растворы 11 класс
Содержание
- 1. Задачи на растворы 11 класс
- 2. Задачи, связанные с изучением растворов, можно условно
- 3. Рассмотрим первое: вычисление массовой доли растворённого вещества
- 4. Какова массовая доля растворённого вещества в растворе,
- 5. Сколько безводного карбоната натрия и воды надо
- 6. 3. Вычисление молярной концентрации раствора. Исходные уравнение
- 7. В воде растворили гидроксид натрия массой 21,4г.
- 8. Приготовление раствора заданной молярной концентрацииРастворы молярной концентрации
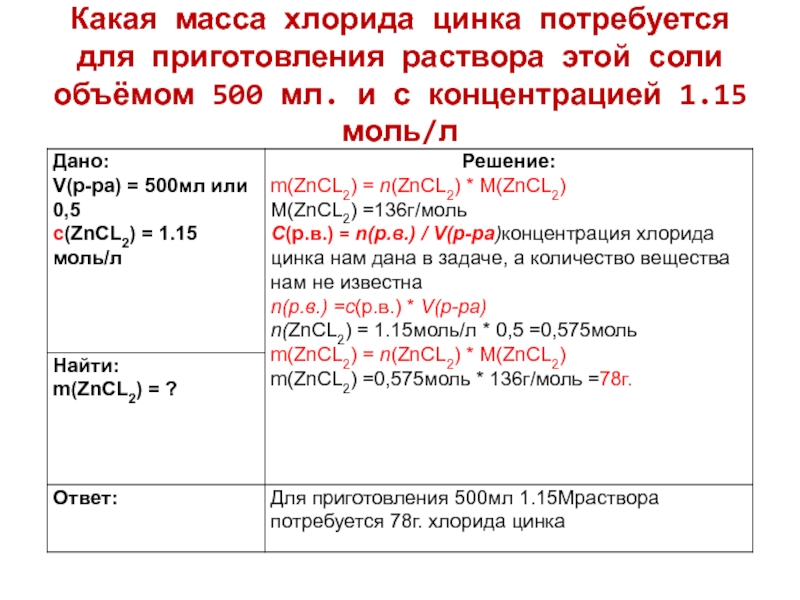
- 9. Какая масса хлорида цинка потребуется для приготовления
- 10. В свежих грибах 92% воды, а в
- 11. 1. ЕГЭ задание № 29 1.При взаимодействии
- 12. 2.ЕГЭ, Задачи № 27 1. К раствору
- 13. Разбор задачи ЕГЭ № 34 Задача. Карбонат
- 14. Определите массу Mg3N2, полностью подвергшегося разложению водой,
- 15. Сколько литров хлора (н.у.) выделится, если к
- 16. Задание 34 № 1 К раствору гидроксида
- 17. Задание 34 № 2При растворении смеси меди и
- 18. Ответ задача 1
- 19. Ответ задача 2
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Задачи, связанные с изучением растворов, можно условно разделить на следующие
группы:
1. вычисление массовой доли растворённого вещества (в процентах) и массы
растворенного вещества;2. вычисление молярной концентрации и массы вещества в растворе определённой молярной концентрации;
3. разбавление растворов с массовой долей растворённого вещества и молярной концентрацией;
4. смещение растворов с массовой долей растворённого вещества и молярной концентрацией;
5. расчёты по химическим уравнениям с применением растворов различной концентрации.
Слайд 3Рассмотрим первое: вычисление массовой доли растворённого вещества (в процентах) и
массы растворенного вещества
Необходимо знать условные обозначения физических величин, которые используются
при решение задачи:m(р.в.), или m, - масса растворённого вещества в растворе, например, m(CаCL2);
m(р-ра.), или m(р.), - масса раствора;
w(р.в.), или w, - массовая доля растворённого вещества.
Растворённое вещество является частью целого – раствора. Следовательно, масса раствора представляет собой сумму масс растворённого вещества и растворителя (воды)
w(р.в.) = m(р.в.)/m(р-ра.)*100% или
Слайд 4Какова массовая доля растворённого вещества в растворе, полученном растворением хлорида
кальция массой 10г в воде 70г?
Слайд 5Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить
раствор массой 70 г с массовой долей карбоната натрия 10%
Слайд 63. Вычисление молярной концентрации раствора.
Исходные уравнение для вычислений:
С(р.в.) = n(р.в)
/ V(р-ра) или С(р.в.) = v(р.в.) / V(р-ра)
С(р.в.) – молярная
концентрация растворённого вещества,n(р.в) или v(р.в.) – количество растворенного вещества,
V(р-ра) – объём раствора.
Слайд 7В воде растворили гидроксид натрия массой 21,4г. Объём раствора довели
до 300 мл.. Определите молярную концентрацию полеченного раствора.
Слайд 8Приготовление раствора заданной молярной концентрации
Растворы молярной концентрации можно готовит из
твёрдых, жидких и газообразных веществ.
В случае жидкого вещества необходимо
знать его плотность; если раствор готовится из газообразного вещества, то применяется молярный объём газов (при н.у.)
Вычисления, связанные с приготовлением молярного раствора, часто являются составным компонентом в расчётах по химическим уравнениям (комбинированные задачи).
Слайд 9Какая масса хлорида цинка потребуется для приготовления раствора этой соли
объёмом 500 мл. и с концентрацией 1.15 моль/л
Слайд 10В свежих грибах 92% воды, а в сухих 8% воды,
сколько сухих грибов можно получить из 23кг свежих?
W% грибов
в свежих грибах 100 – 92% = 8%W% грибов в сухих грибах100 – 8% =92%
23×0,08 -0 =(23-Х)×0,92;
1,84 =21,16 -0,92Х; 0,92Х =19,32; Х= 21кг(это вода)
Масса сухих грибов =23 -21 =2кг.
Ответ m сухих грибов=2кг
Слайд 111. ЕГЭ задание № 29
1.При взаимодействии 0,2 моль сульфида железа
(II) с соляной кислотой выделяется газ объёмом____ л (н.у.). (Запишите
число с точностью до сотых.)2.При взаимодействии избытка раствора хлорида бария с раствором, содержащим 10,26 г сульфата алюминия, образуется осадок массой___ г. (Запишите число с точностью до целых.)
3.В результате взаимодействия 6,5 г. Цинка с избытком раствора нитрата свинца образуется свинец массой ____ г. (Запишите число с точностью до десятых.)
4.При растворении сульфида железа (II) в избытке соляной кислоты выделилось 2,8 л (н. у.) газа. Чему равна масса сульфида железа? (Запишите число с точностью до целых.)
5.При растворении карбоната кальция в избытке соляной кислоты выделилось 11,2 л (н. у.) газа. Чему равна масса карбоната кальция? (Запишите число с точностью до целых.)
6. Какая масса осадка образуется при взаимодействии избытка раствора нитрата вария с раствором, содержащим 3,92 г серной кислоты? (Запишите число с точностью до сотых.)
Слайд 122.ЕГЭ, Задачи № 27
1. К раствору хлорида кальция массой 140
г с массовой долей 5% добавили 10 г этой же
соли. Чему равна массовая доля соли в полученном растворе?2.Определите, чему равна масса раствора уксусной кислоты с массовой долей 80%, которая потребуется для приготовления 500 г раствора этой кислоты с массовой долей 10%.
3.Смешали два раствора: один массой 260 г и с массовой долей 3%, второй – массой 140 г и с массовой долей этой же соли 1%. Чему равна массовая доля соли в полученном растворе?
4.К раствору сульфида кальция массой 60 г и с массовой долей 4% добавили 5,6 г этой же соли. Чему равна массовая доля соли в полученном растворе?
Слайд 13Разбор задачи ЕГЭ № 34
Задача. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл хлороводородной кислоты (ρ =
1, 04 г/мл) с массовой долей 9%. Какова массовая доля хлороводорода в образовавшемся растворе?Алгоритм:
- составление (согласно условию задания) уравнений химических реакций необходимых для проведения стехиометрических расчётов;
- расчёт количества вещества реагентов и продуктов реакций;
- определение (при необходимости) избытка какого-либо из заданных веществ;
- расчёт массовой доли вещества в полученном растворе с учётом выделяющегося из раствора газа или осадка.
Слайд 14Определите массу Mg3N2, полностью подвергшегося разложению водой, если для солеобразования
с продуктами гидролиза потребовалось 150 мл 4%-го раствора соляной кислоты
плотностью 1,02 г/мл.1) Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
2) Mg(OH)2 + 2HCl → MgCl2 + 2H2O
3) NH3 +HCl → NH4Cl
n (HCl) = 150 * 1,02 *0,04/ 36,5 = 0,168 моль
Пусть вступило в реакцию х моль Mg3N2. По уравнению 1, образовалось 3х моль Mg(OH)2 и 2х моль NH3. На нейтрализацию 3х моль Mg(OH)2 потребовалось 6х моль HCl ( по уравнению 2), а на нейтрализацию 2х моль NH3 потребовалось 2х моль HCl (по уравнению 3), всего 8х моль HCl.
8 x = 0, 168 моль,
Х = 0, 021 моль,
n(Mg3N2) = 0, 021 моль,
m(Mg3N2) =М*n = 100 * 0,021 = 2,1 г.
Ответ: 2,1 г
Слайд 15Сколько литров хлора (н.у.) выделится, если к 200 мл 35%-ной
соляной кислоты (плотностью 1,17 г/мл) добавить при нагревании 26,1 г
оксида марганца (IV)? Сколько граммов гидроксида натрия в холодном растворе прореагирует с этим количеством хлора?1) MnO2 + 4 HCl → MnCl2 + 2 H2O + Cl2
2) 2NaOH + Cl2→ NaCl + NaClO + H2O
n(HCl) = 200*1,17* 0,35/ 36,5= 2,24 моль – в избытке
n(MnO2) = 26,1/ 87 = 0,3 моль – в недостатке
По уравнению (1) n(Cl2)= 0,3 моль V(Cl2) = 6,72 л
По уравнению (2) n(NaOH)= 0,6 моль, m(NaOH)=24 г
Ответ: 6,72 л, 24 г