Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок – игра "Основные классы неорганических соединений" 8 класс
Содержание
- 1. Урок – игра "Основные классы неорганических соединений" 8 класс
- 2. Слайд 2
- 3. Общие вопросы 100 Перечислить основные классы неорганических соединенийОксидыКислотыСолиОснования
- 4. Общие вопросы 200Дать определение оксида.Оксиды –
- 5. Общие вопросы 300Дать определения основания и щелочи.Основания
- 6. Общие вопросы 400Дать определение индикатора.Перечислить известные
- 7. Общие вопросы 500Дать определения соли и
- 8. Оксиды 100Как дается название оксида?Назвать вещества:
- 9. Оксиды 200Определение основных оксидов.Число формул основных оксидов:
- 10. Дать определение кислотных оксидов.Выбрать формулы кислотных оксидов
- 11. Оксиды 400Дать определения амфотерных оксидов.Исключить лишние вещества:Al2O3,
- 12. Оксиды 500Исправить ошибки:оксид алюминия- Al2Oоксид марганца (II)
- 13. Основания 100Как даются названия основаниям?Назвать основания:
- 14. Основания 200Выбрать щелочи и назвать их:Fe(OH)2, NaOH,
- 15. Основания 300Составить формулы: гидроксид кальция гидроксид меди (II) гидроксид цинкаCa(OH)2,Cu(OH)2,Zn(OH)2
- 16. Основания 400С помощью какого индикатора можно отличить
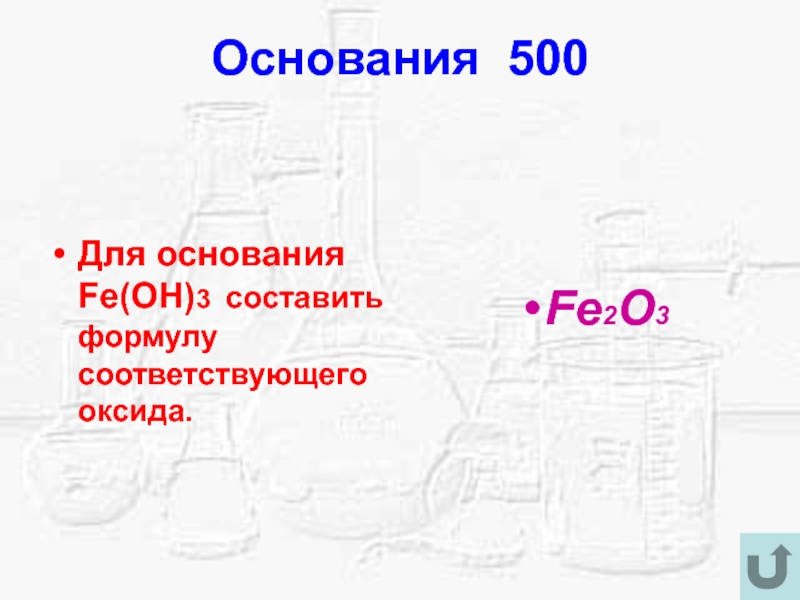
- 17. Основания 500Для основания Fe(OH)3 составить формулу соответствующего оксида. Fe2O3
- 18. Кислоты 100Как по формуле определить заряд кислотного остатка?По числу атомов водорода.
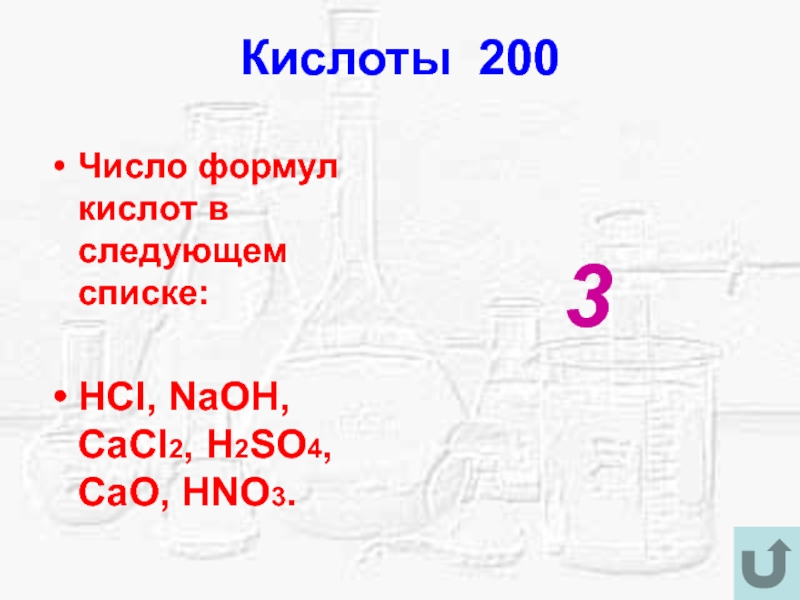
- 19. Кислоты 200Число формул кислот в следующем списке:HCl,
- 20. Кислоты 300Назвать кислоты, определить заряды кислотных остатков:
- 21. Кислоты 400Найти ошибки: H2SO4 –
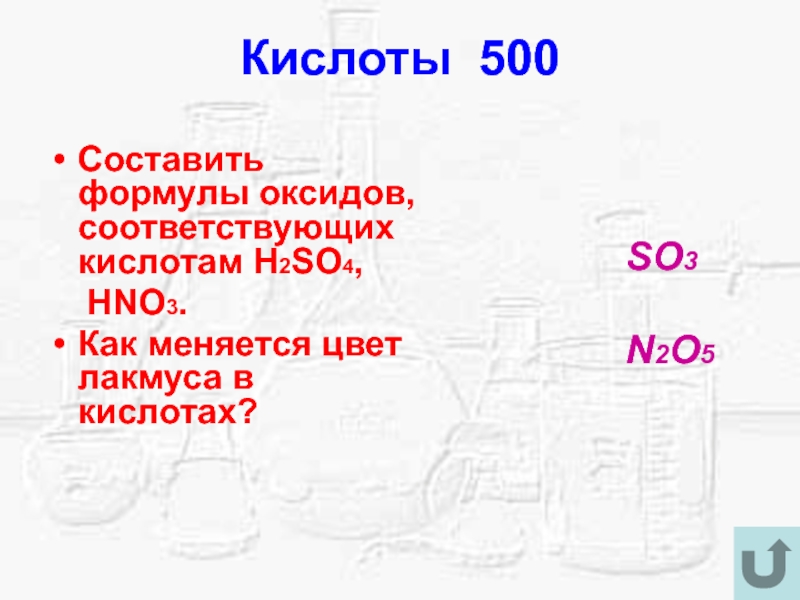
- 22. Кислоты 500Составить формулы оксидов, соответствующих кислотам H2SO4,
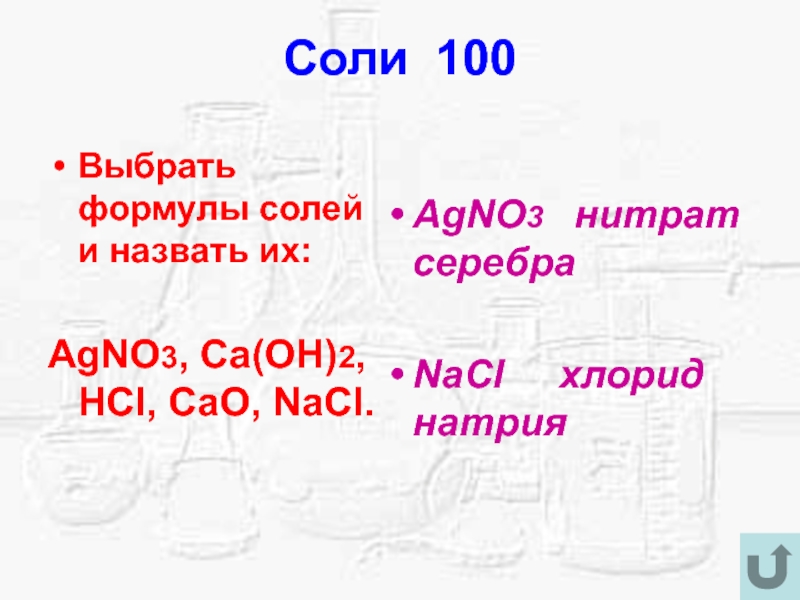
- 23. Соли 100Выбрать формулы солей и назвать их:AgNO3,
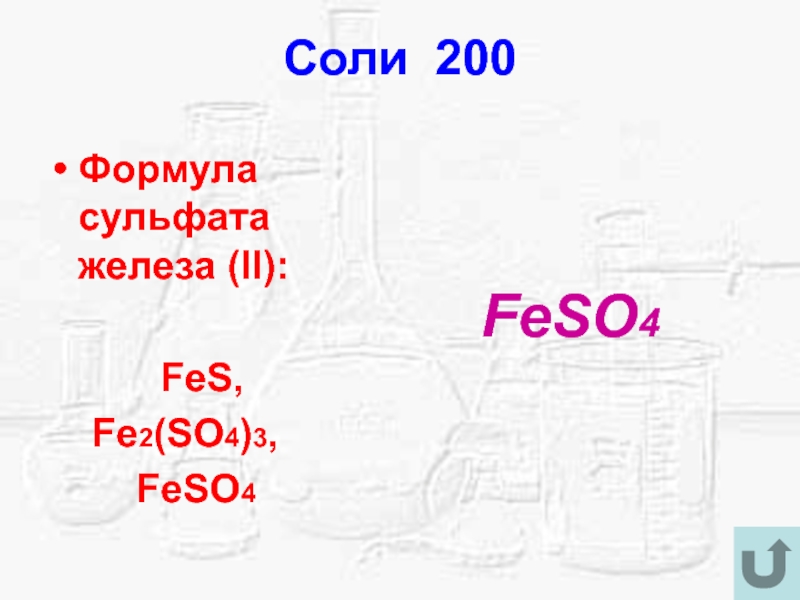
- 24. Соли 200Формула сульфата железа (II):
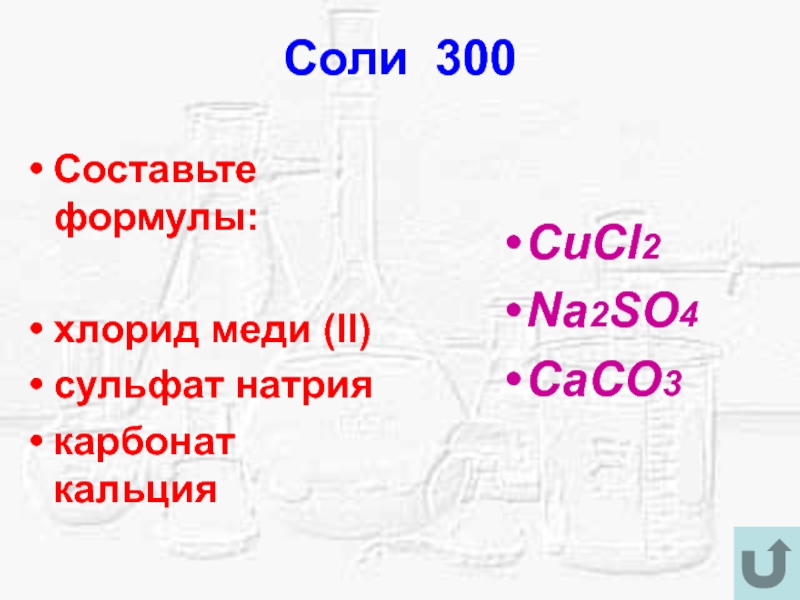
- 25. Соли 300Составьте формулы:хлорид меди (II)сульфат натриякарбонат кальцияCuCl2Na2SO4CaCO3
- 26. Соли 400Какими основанием и кислотой образована соль
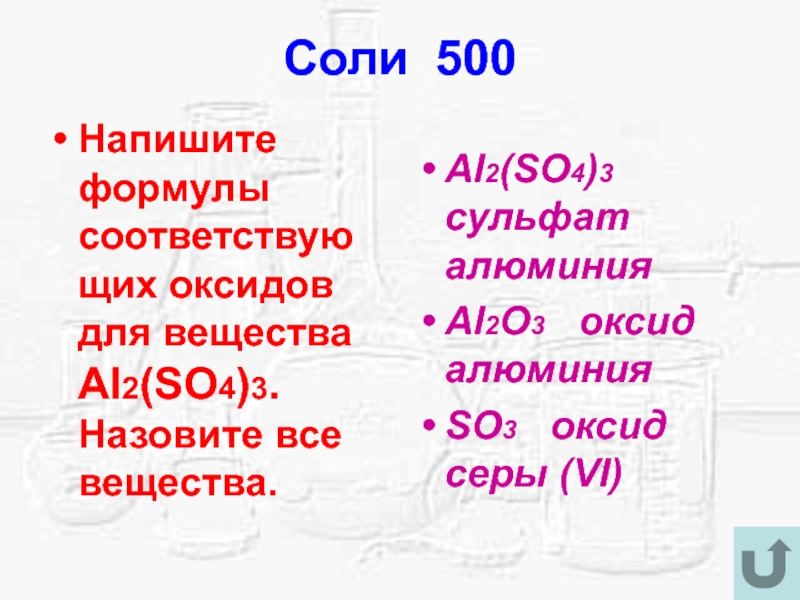
- 27. Соли 500Напишите формулы соответствующих оксидов для вещества
- 28. Ж Е Л А Ю
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Общие вопросы 100
Перечислить основные
классы неорганических соединений
Оксиды
Кислоты
Соли
Основания
Слайд 4Общие вопросы 200
Дать определение оксида.
Оксиды – сложные вещества, состоящие
из двух химических элементов один из которых кислород в степени
окисления - 2.
Слайд 5Общие вопросы 300
Дать определения основания и щелочи.
Основания – сложные вещества,
состоящие из атомов металла и одной или нескольких гидроксогрупп.
Щелочи –
это растворимые или малорастворимые основания.
Слайд 6Общие вопросы 400
Дать определение индикатора.
Перечислить известные вам индикаторы.
Индикаторы –
это вещества, меняющие свою окраску в зависимости от среды.
Лакмус
Метилоранж
Фенолфталеин.
Слайд 7Общие вопросы 500
Дать определения соли и кислоты. Как составляется
название соли?
Кислоты – сложные вещества, состоящие из атомов водорода и
кислотных остатков.Соли – сложные вещества. Состоящие из атомов металла и кислотных остатков.
Название
соли
=
Название
кислотного
остатка
Название
металла
в род пад.
+
+
Степень
окисления
элемента,
если она
переменна
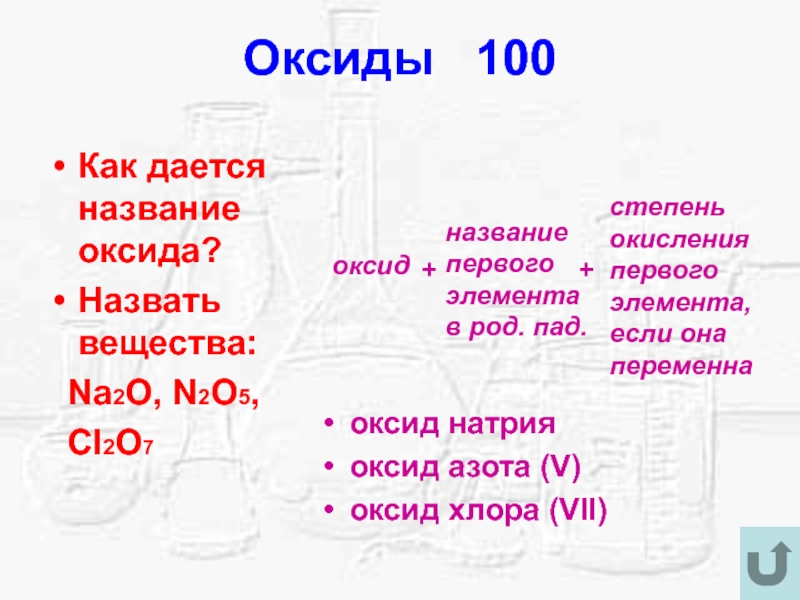
Слайд 8Оксиды 100
Как дается название оксида?
Назвать вещества:
Na2O, N2O5,
Cl2O7
оксид натрия
оксид азота (V)
оксид хлора (VII)
оксид
+
название
первого
элемента
в род. пад.
+
степень
окисления
первого
элемента,
если она
переменна
Слайд 9Оксиды 200
Определение основных оксидов.
Число формул основных оксидов:
Na2O, CuO, HCl,
NaOH, Cl2O7, CO2
Основные оксиды – это оксиды металлов со степенью
окисления +1, +2.2
Слайд 10Дать определение кислотных оксидов.
Выбрать формулы кислотных оксидов и назвать вещества:
H2SO4,
N2O5, Mn2O7, ZnO, NaOH, FeO.
Кислотные оксиды – это оксиды
неметаллов и оксиды металлов со степенью окисления больше 4.N2O5 – оксид азота (V)
Mn2O7 – оксид марганца (VII)
Оксиды 300
Слайд 11Оксиды 400
Дать определения амфотерных оксидов.
Исключить лишние вещества:
Al2O3, MnO2, ZnO, CaO,
Fe2O3, Mn2O5
Амфотерные оксиды – это оксиды металлов со степенью окисления
+3, +4.CaO, Mn2O5
Слайд 12Оксиды 500
Исправить ошибки:
оксид алюминия- Al2O
оксид марганца (II) MnO2
оксид кремния
SiO2
оксид натрия Na2O
оксид кальция (II) CaO
оксид алюминия- Al2O3
оксид марганца
(II) MnOоксид кремния SiO2
оксид натрия Na2O
оксид кальция CaO
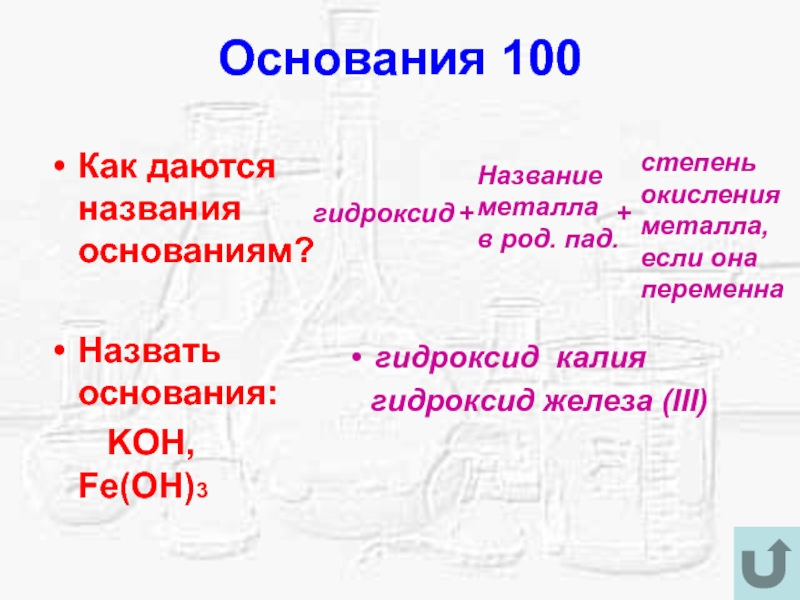
Слайд 13Основания 100
Как даются названия основаниям?
Назвать основания:
KOH, Fe(OH)3
гидроксид
калия
гидроксид железа (III)
гидроксид
+
Название
металла
в род. пад.
+
степень
окисления
металла,
если она
переменна
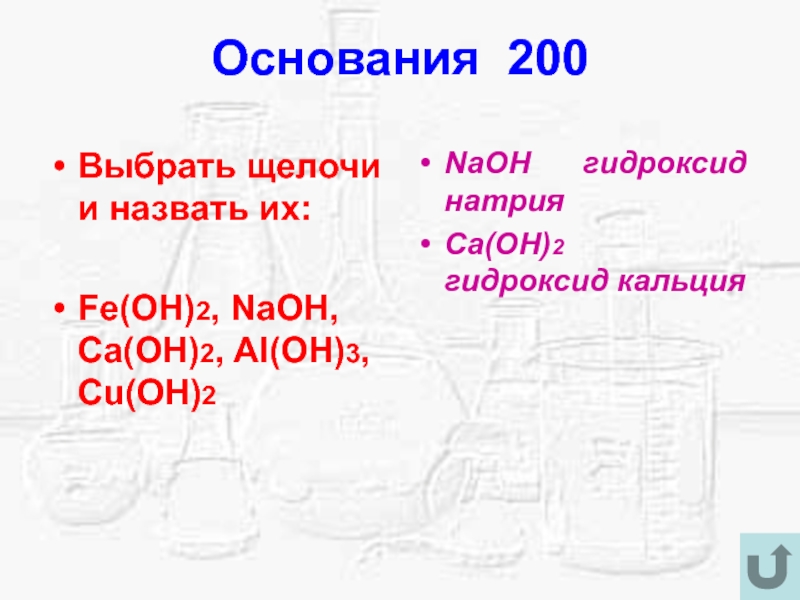
Слайд 14Основания 200
Выбрать щелочи и назвать их:
Fe(OH)2, NaOH, Ca(OH)2, Al(OH)3, Cu(OH)2
NaOH
гидроксид натрия
Ca(OH)2 гидроксид кальция
Слайд 15Основания 300
Составить формулы:
гидроксид кальция
гидроксид меди (II)
гидроксид цинка
Ca(OH)2,
Cu(OH)2,
Zn(OH)2
Слайд 16Основания 400
С помощью какого индикатора можно отличить щелочи от других
веществ?
Фенолфталеин
(малиновый).
Лакмус (синий).
Метилоранж (желтый).
Слайд 20Кислоты 300
Назвать кислоты, определить заряды кислотных остатков:
HCl
H2SO4
HNO3H2SiO3
H3PO4
соляная (хлоро-водородная) -1
серная -2
азотная -1
кремниевая -2
фосфорная -3
Слайд 21Кислоты 400
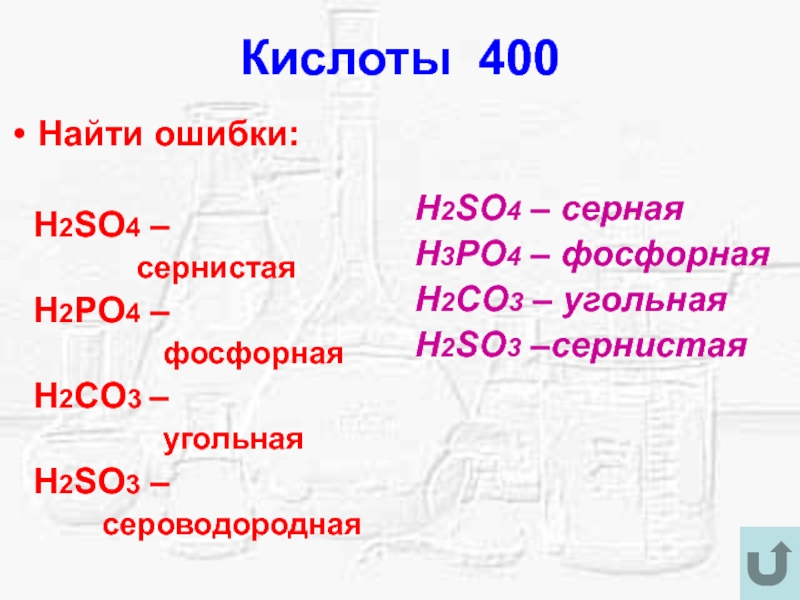
Найти ошибки:
H2SO4 –
сернистая
H2PO4 –
фосфорнаяH2CO3 –
угольная
H2SO3 –
сероводородная
H2SO4 – серная
H3PO4 – фосфорная
H2CO3 – угольная
H2SO3 –сернистая