Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок - исследование "Соединения железа"
Содержание
- 1. Урок - исследование "Соединения железа"
- 2. Проверка домашнего заданияВизитная карточка железа1.Порядковый номер=>26заряд ядра
- 3. Проверка домашнего заданияМеталлические свойства у железа сильнее,
- 4. Проверка домашнего заданияКакое их утверждений неверно:а) железо
- 5. Проверка домашнего задания Составьте уравнения реакций получения
- 6. Слайд 6
- 7. Слайд 7
- 8. Проверь
- 9. Слайд 9
- 10. Вставь пропущенные слова Железо
- 11. СОЕДИНЕНИЯ ЖЕЛЕЗА+3+2 Fe2 O3
- 12. 5. Реагируют при сплавлении с твердыми щелочами
- 13. Соединения железаFe2O3Различия Реагирует
- 14. Слайд 14
- 15. Соединения
- 16. Работа - исследованиеЗадача:получить гидроксиды
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. ГИДРОКСИД ЖЕЛЕЗА ІІПолучение: Химические свойства:-
- 21. Слайд 21
- 22. Fe(OH)3 ГИДРОКСИД ЖЕЛЕЗА ІІІПолучение: Взаимодействие хлорида железа
- 23. Проверь
- 24. Слайд 24
- 25. Качественное определение
- 26. Качественное определение
- 27. Качественное определение
- 28. Соли
- 29. Проверь себя
- 30. Соли железа ІІ
- 31. Проверь себя
- 32. Закрепление материалаГенетический ряд Fe+2Fe+2
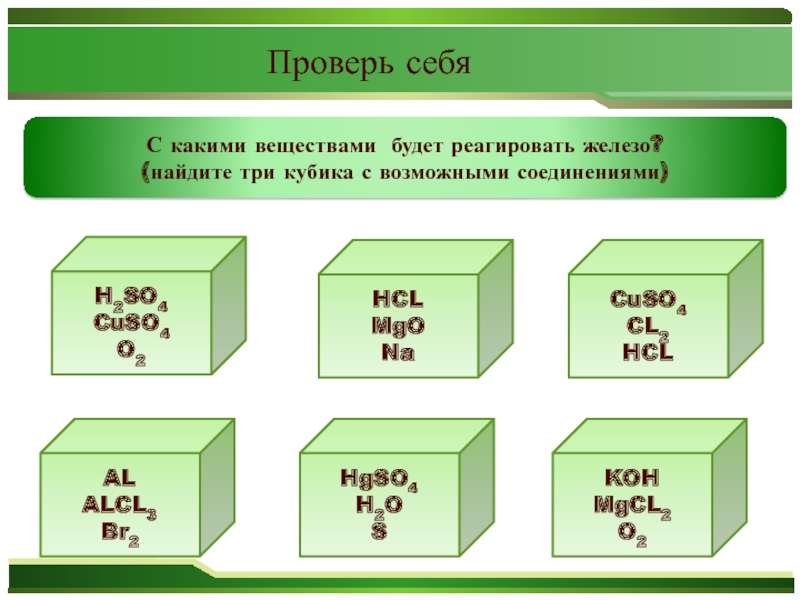
- 33. Проверь
- 34. H2SO4CuSO4O2HCLMgONaKOHMgCL2O2ALALCL3Br2HgSO4H2OSCuSO4CL2HCLС какими веществами будет реагировать железо?(найдите три кубика с возможными соединениями)Проверь себя
- 35. С какими веществами будут реагировать оба
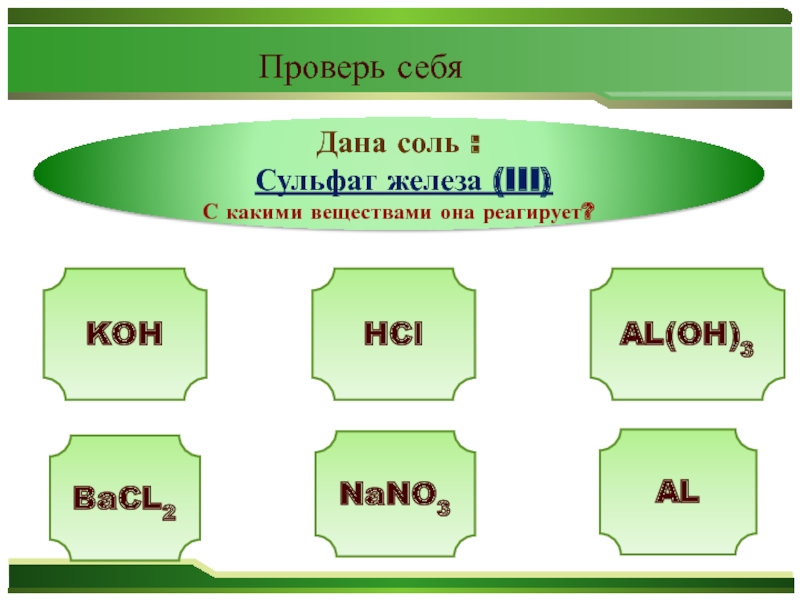
- 36. Дана соль : Сульфат железа (III)С какими веществами она реагирует?KOHAL(OH)3BaCL2ALNaNO3HCl Проверь себя
- 37. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Урок химии в 9 классе
Соединения железа
Выполнил: учитель
МБОУ – СОШ №50 г. Орла
Попова Алла ЕвгеньевнаСлайд 2Проверка домашнего задания
Визитная карточка железа
1.Порядковый номер
=>
26
заряд ядра
+26
2.Период
IV
=>
число энергетических
уровней
4
3.Группа
VIII
подгруппа
В
=>
валентные электроны распределяются на последнем и
предпоследнем уровнях.
4.Электронное
строение атома:+26
2е
8е
14е
2е
Вывод: Fe -
переходный металл
5. Степени ок. Fe
Fe0
Fe+2
Fe+3
Fe+6
Слайд 3Проверка домашнего задания
Металлические свойства у железа сильнее, чем
а) Mg
б)
Zn
в) Cu
Тип связи в простом веществе Fe:
а) ионная
б) ковалентная
в) металлическая
Среда,
в которой коррозия железа происходит наиболее быстро:а) вода
б) воздух
в) влажный воздух
Установите соответствие между исходными веществами и продуктами реакции:
исходные вещества
продукты реакции
Fe + H2SO4(p) ?
FeCl2 + H2
б) FeCl3
в) FeCl2
г) Fe(SO4)3 + H2
е) FeSO4 + H2
Fe + Cl2 ?
Fe + HCl(p) ?
д) FeCl3 + H2
а)
Слайд 4Проверка домашнего задания
Какое их утверждений неверно:
а) железо – элемент с
переменной степенью окисления
б) в химических реакциях металлическое железо проявляет только
восстановительные свойствав) при окислении атом железа способен отдавать электроны не только внешнего, но и предвнешнего энергетического уровня
г) максимальная степень окисления железа равна номеру группы, в которой находится, то есть +8
При взаимодействии, с какими веществами железо образует соединения со степенью окисления +2?
А) СI2
Б) S
В) HNO3
Г) HСl
Правильно записана реакция::
250С
А). 3Fe + 4H2O → Fe3O4 + 4H2
700-9000C
Б). 3Fe + 4H2O → Fe3O4 + 4H2
В). Cu + FeSO4= CuSO4 + Fe
Г). Fe + ZnCl2 = FeCl2 + Zn
Слайд 5Проверка домашнего задания
Составьте уравнения реакций получения железа из его
оксидов Fe2O3 и Fe3O4 , используя в качестве восстановителя:
а) водород б) алюминий в) оксид углерода (II). Для каждой реакции составьте электронный баланс.«4»
«5»
Осуществите превращения по схеме:
Fe2O3 Fe +H2O, t X +CO, t Y +HCl Z
Назовите продукты X, Y, Z?
Слайд 6 Проверь себя
Fe2+3O3 + H2 → Fe0 + H2O
H20
- 2℮ → 2H+ восстановитель, окислениеFe+3 + 3℮ → Fe0 окислитель, восстановление
6
3
2
2
3
3
Fe+2O + H20 → Fe0 + H2+O
H20 - 2℮ → 2H+ восстановитель, окисление
Fe+2 + 2℮ → Fe0 окислитель, восстановление
2
2
2
пирометаллургия
Слайд 7 Проверь себя
алюмотермия
Fe2+3O3 +
Al → Fe0 + Al2O3
Al0 - 3℮
→ Al+3 восстановитель, окисление Fe+3 + 3℮ → Fe0 окислитель, восстановление
3
1
1
Fe+2O + Al0 → Fe0 + Al2+3O3
Fe+2 + 2℮ → Fe окислитель, восстановление
Al0 - 3℮ → Al+3 восстановитель, окисление
6
2
3
2
3
3
2
Слайд 8 Проверь себя
Fe2+3O3 +
СО → Fe0 + СO2
С+2 - 2℮
→ С+4 восстановитель, окислениеFe+3 + 3℮ → Fe0 окислитель, восстановление
6
3
3
2
2
3
+2
+4
Fe+2O + С+2О → Fe0 + С+4O2
С+2 - 2℮ → С+4 восстановитель, окисление
Fe+2 + 2℮ → Fe0 окислитель, восстановление
2
1
1
пирометаллургия
Слайд 9 Проверь себя
Fe2+3O3 +
3СО → 2 Fe0 + 3СO2
Fe2+3O3 + 2 Al →
Fe0 + Al2O3 700-9000C
3Fe + 4H2O → Fe3O4 + 4H2
X – Fe3 O4
Fe3O4+CO → 3Fe+CO2
Y - Fe
Fe + 2HCl → FeCl2 + H2
Z - FeCl2
Fe0 - 2℮ → Fe+2
2Fe0- 6℮ → Fe+3
2H+ +2℮ → H20
8
1
4
восстановитель, окисление
окислитель, восстановление
І
І
ІІ
ІІІ
ІV
Слайд 10 Вставь пропущенные слова
Железо относится к классу
, проявляет
свойства, ē с последнего энергетического уровня.
Ему соответствуют два оксида: проявляет характер и оксид , обладающий характером со слабо выраженной кислотной функцией.
Гидроксиду железа (II) соответствует формула -, это вещество, образующееся при взаимодействии и в виде осадка.
Гидроксиду железа (III) соответствует формула . Имеет
цвет. Является соединением (с преобладанием основных свойств).
?
(FeO · Fe2O3)
железная окалина
+3
металлов
восстановительные
отдавая
FeO
основной
амфотерным
Fe2O3
Fe2O3
FeO
Fe3O4
Fe(OН)2
соли
воды
зеленого
Fe(OН)3
бурый
амфотерным
Слайд 11 СОЕДИНЕНИЯ ЖЕЛЕЗА
+3
+2
Fe2 O3
Fe(OH)3
амфотерный амфотерное основание
оксид
FeO
Fe(OH)2основной слабое основание
оксид
+2
+3
Степень окисления металла в оксиде должна соответствовать степени окисления металла в соответствующем гидроксиде.
Какие реакции подтверждают основный характер оксидов?
Взаимодействие с кислотами
Взаимодействие с кислотными оксидами
Какие вещества называются амфотерными?
Вещества, которые в зависимости от условий реакций проявляют кислотные и основные свойства называются амфотерными
Слайд 125. Реагируют при сплавлении с твердыми щелочами
Соединения железа
- основный оксид
Общие свойства
1. Не растворяются
в водеFeO + 2HCl FeCl2 + H2O
FeO + 2H+ + 2Cl- Fe2+ +2Cl- +H2O
FeO + 2H+ Fe2++ H2O
3. Реагируют с кислотными оксидами
FeO + SO3 FeSO4
4. Реагируют с восстановителями
FeO + H2 Fe + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
Fe2O3+ 6H++6Cl- 2Fe3+ +6Cl- + 3H2O
Fe2O3 + 6H+ 2Fe3++ 3H2O
Fe2O3 + 3SO3 Fe2(SO4)3
Fe2O3 + 3H2 2Fe + 3H2O
+3
- амфотерный оксид
2. Реагируют с кислотами
Задание:
Составить уравнение реакции взаимодействия гидроксида железа (ІІ и ІІІ) с раствором соляной кислоты в ионном виде, оксидом серы (VІ), водородом.
FeO + 4NaOH Na4FeO3 + 2H2O
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
Fe2O3
Слайд 13 Соединения железа
Fe2O3
Различия
Реагирует с конц. HNO3
Реагирует при сплавлении с
основными
оксидами или карбонатами щелочных металлов Fe2O3 + Na2O t˚C→ 2NaFeO2
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
феррит
- Реагирует с сильными окислителями в щелочной среде
Задание:
Расставить коэффициенты методом электронного баланса в уравнениях реакций:
FeO + HNO3 соль+ NO2 + вода
Fe2O3 + KNO3 + KOH K2FeO4 + KNO2 + H2O
Слайд 14 Проверь себя
FeO +
HNO3 Fe(NO3)3 + NO2 +
H2OFe+2 - ℮ Fe+3 восстановитель, окисление
N +5 + ℮ N+4 окислитель, восстановление
1
1
1
Fe2O3 + KNO3 + KOH K2FeO4 + KNO2 + H2O.
+2
+3
+4
+5
+3
+5
+6
+4
Fe+3 - 3℮ Fe+6 восстановитель, окисление
N +5 + ℮ N+4 окислитель, восстановление
3
3
1
4
2
3
4
3
2
2
Слайд 15 Соединения железа
4FeS2 + 11O2 t˚C→ 2Fe2O3 + 8SO2
Fe2O3
1)
Fe(OH)2 t˚C→ FeO + H2O
2) Fe2O3 + CO → 2FeO + CO2
2Fe + O2
→ 2FeO3) при низком давлении кислорода
4) взаимодействием железа с оксидами
железа при температуре 900-1000о
Fe + Fe2O3 → 3FeO
Fe + Fe3O4 → 4FeO
получение
в природе существует как
минерал вюстит
минерал гематит
без доступа воздуха 5) FeCO3 → FeO + CO2
2Fe(OH)3 → Fe2O3 + 3H2O
4Fe(NO3)3 → 2Fe2O3 +12NO2 +3O2
2FeSO4 t˚C→ Fe2O3 + SO2 + SO3
Задание:
1.Составьте уравнение реакции разложения гидроксида
железа (ІІ и ІІІ)
2. Реакцию взаимодействия оксида железа (ІІ) с угарным газом
3. Реакцию взаимодействия железа и пирита с кислородом
Слайд 16 Работа - исследование
Задача:
получить гидроксиды железа, исследовать их
свойства, провести качественные реакции на ионы
Fe и Fe+2
+3
Объект исследования:
гидроксид железа (II) (Fe(OH)2), гидроксид железа (III) (Fe(OH)3),сульфат железа (II) (FeSO4), хлорид железа (III) (FeCl3).
Цель исследования:
изучение способов получения гидроксидов железа, их химических свойств, проведение качественных реакций на ионы железа Fe+2 и Fe+3
Методы исследования:
научно-теоретические, экспериментальные.
Слайд 17 Инструкция
Лабораторный опыт
1.Получение гидроксида железа(II) и (III)
І вариант
ІІ вариант
Лабораторный опыт 1.
Получение гидроксида железа(II) и (III)
Действия:
а) К 1 мл раствора сульфата железа (II) добавьте по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка.
К раствору хлориду железа(III) прилейте по каплям раствор гидроксида натрия до появления явных признаков химической реакции. Отметьте цвет образовавшегося осадка.
Наблюдения:
Образуется осадок
зеленоватого цвета
Выпадает осадок
бурого цвета.
Слайд 18 Инструкция
Лабораторный опыт 2.
Изучение свойств гидроксидов железа (II) и (III)
І вариант
ІІ вариант
Полученный осадок разделить на три части:
а) в первую пробирку добавляем избыток щелочи;
б) во вторую - кислоту;
в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе.
Fe(OH)3
Fe(OH)2
Действия:
Наблюдения:
1.Изменений не наблюдается
2. Осадок растворяется
3. Грязно – зеленый осадок меняет окраску на бурую
1. Осадок растворяется
2. Осадок растворяется
3.Устойчив,
изменений не наблюдается
Слайд 19
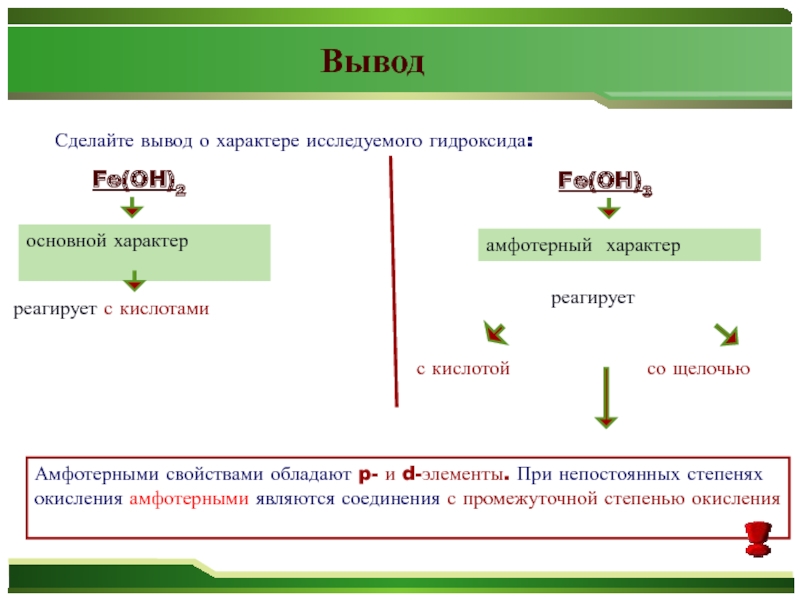
Вывод
Сделайте вывод о характере исследуемого гидроксида:
Fe(OH)2
основной характер
реагирует с кислотами
Fe(OH)3
амфотерный характер
реагирует
со щелочью
с кислотой
Амфотерными свойствами обладают p- и d-элементы. При непостоянных степенях окисления амфотерными являются соединения с промежуточной степенью окисления
Слайд 20 ГИДРОКСИД ЖЕЛЕЗА ІІ
Получение:
Химические свойства:
- взаимодействует с
кислотами
- окисляется кислородом воздуха до Fe(OH)3
Задание:
1.Составить ионное уравнение реакции получения гидроксида железа (ІІ)
2. Составить ионное уравнение реакции взаимодействия гидроксида железа (ІІ) с раствором соляной кислотой.
3. Составить уравнение реакции разложения гидроксида железа (ІІ) и окисления его пероксидом водорода
4. Составить уравнения реакций окисления Fe(OH)2 воздухом и расставить коффициенты методом электронного баланса
- разлагается при нагревании
- окисляется пероксидом водорода до Fe(OH)3
Взаимодействие хлорида железа (ІІ) с
гидроксидом натрия
Fe(OH)2
Слайд 21 Проверь себя
FeCl2 + 2KOH 2KCl + Fe(OH)2
Fe2++2Cl- +2K+
+2OH- 2K+ +2Cl- + Fe(OH)2Fe2++ 2OH- Fe(OH)2
Fe(OH)2 + 2HCl FeCl2 + 2H2O
Fe(OH)2 + 2H+ + 2Cl- Fe2+ +2Cl- +
Fe(OH)2 + 2H+ Fe2+ + 2H2O
Fe(OH)2 t˚C FeO + H2O
Fe(OH)2 + O2 + H2O Fe(OH)3
Fe+2 - ℮ Fe+3 восстановитель, окисление
О2 + 4℮ 2О -2 окислитель, восстановление
4
4
1
2 Fe(OH) + Н О 2 Fe(OH)
2
2
2
3
2H2O
4
4
2
Слайд 22Fe(OH)3
ГИДРОКСИД ЖЕЛЕЗА ІІІ
Получение:
Взаимодействие хлорида железа (ІІІ) с
гидроксидом натрия
Химические свойства:
- взаимодействует с кислотами
- разлагается при нагревании - реагирует с концентрированными растворами
щелочей с образованием Na[Fe(OH)4]
реагирует при сплавлении со щелочами или
карбонатами щелочных металлов с образованием
ферритов
Реагирует с сильными окислителями в щелочной среде
Задание
1.Составить ионные уравнения реакций получения гидроксида железа (ІІІ) и взаимодействия гидроксида железа (ІІІ) с раствором соляной кислотой.
2. Составить уравнение реакции взаимодействия Fe(OH)3 с раствором щелочи , в результате которой образуется гексагидроксоферрат натрия
3. Составить уравнение реакции разложения гидроксида железа (ІІІ)
4. Составьте ионное уравнение реакции взаимодействия гидроксида железа (ІІІ) со щелочью (условие – сплавление) с образованием феррита натрия и воды;
гидроксида железа (ІІІ) с карбонатом натрия с образованием феррита натрия оксида углерода (ІV) и воды.
5. Расставьте коэффициенты методом электронного баланса:
Fe(OH)3 + Br2 + KOH K2FeO4 + NaBr + H2O
Слайд 23 Проверь себя
FeCl3 + 3KOH
3KCl + Fe(OH)3
Fe3++3Cl- +3K+ +3OH-
3K+ +3Cl- + Fe(OH)3Fe3++ 3OH- Fe(OH)3
Fe(OH)3 + 3H+ + 3Cl- Fe3+ +3Cl- +
3H2O
Fe(OH)3 + 3HCl FeCl3 +
3H2O
Fe(OH)3 + 3H+ Fe3+ +
3H2O
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
2Fe(OH)3 t˚C Fe2O3 + 3H2O
Fe(OH)3 + NaOH NaFeO2 + 2H2O
Fe(OH)3 + Na+ + OH- Na++ FeO2- + 2H2O
Fe(OH)3 + OH- Fe O2- + 2H2O
(реакция протекает при 75°С
в токе N2)
Слайд 24 Проверь себя
2Fe(OH)3
+ Na2CO3 2NaFeO2 + CO2 + 3H2O
3Fe(OH)3
+ 2Na ++ CO32- 2Na+ + 2FeO2- +CO2 + 3H2O 3Fe(OH)3 + CO22- 2FeO2- +CO2 + 3H2O
Fe(OH)3 + Br2 + KOH K2FeO4 + KBr + H2O
3+
0
6+
1 -
Fe+3 - 3℮ Fe+6 восстановитель, окисление
Br2 0 + 2℮ 2Br -1 окислитель, восстановление
6
3
2
2
2
3
6
10
8
Слайд 25 Качественное определение
катионов железа +2
Красная кровяная
соль
Турнбулева синь
Турнбуллева синь служила красителем. Названа по имени
одного из основателей шотландской фирмы по производству красителей «Артур и Турнбуль».(турнбулева синь – гексацианоферрат (III) железа (II))
В химической практике часто возникает необходимость
обнаружения тех или иных ионов в различных растворах.
Для этого используют так называемые
качественные реакции.
На ионы Fe+2
3FeCI2 + 2K3[Fe(CN)6] Fe3[Fe(CN)6]2+ 6KCI
+2
+3
3Fe2+ + 6CI- + 6K+ + 2[Fe(CN)6]3- Fe3[Fe(CN)6]2 + 6K+ + 6CI-
3Fe2+ + 2[Fe(CN)6]3- Fe3+2[Fe+3(CN)6]2
Слайд 26 Качественное определение катионов
железа +3
жёлтая кровяная
соль
Берлинская лазурь
4Fe3+Cl3 +
3K4[Fe2+(CN)6] → 12KCl + Fe43+[Fe2+(CN)6] 3 ↓(берлинская лазурь - гексацианоферрат (II) железа (III))
Установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, так как комплексы, образующиеся в реакциях находятся между собой в равновесии:
FeIII[FeII(CN)6]↔ FeII[FeIII(CN)6]
Качественными реакциями на катионы железа (III) являются:
Реакция с гексацианоферрат (II) калия(«желтая кровяная соль»), в результате которой образуется синий осадок:
4Fe3+ +12Cl- +12K+ +3 [Fe(CN)6]4- → 12K+ +12Cl- + Fe4[Fe(CN)6]3
↓
4Fe3+ +3 [Fe(CN)6]4- → Fe4[Fe(CN)6]3
↓
На ионы Fe+3
Слайд 27 Качественное определение катионов железа
+3
Роданид калия
раствор кроваво - красного цвета
FeCl3 + 3KCNS
3KCl + Fe (CNS)3 Роданид железа(III)
На ионы Fe+3
Fe+3 + 3Сl- + 3K+ + 3SCN- 3K++ 3Сl- + Fe (SCN)3
Fe+3 + 3SCN- Fe(SCN)3
Fe (CNS)3
Реакция солей железа ІІІ с роданидом калия
Слайд 28 Соли железа
Ферраты –
сильные окислители.
K2Fe+6O4
Ферраты — соли, содержащие феррат-анион FeO42- (Fe(VI)). Соответствуют железной кислоте H2FeO4,
которая в свободном виде не существует. Как правило, окрашены в фиолетовый цвет.Раствор феррата натрия (слева) в сравнении с перманганатом калия (справо)
К2FeO4 + NH3 + H2O → Fe(OH)3 +N2 + KOH
К2FeO4 + HCl → FeCl3 + Cl2 + H2O+ KCl
Задание:
Расставить коэффициенты в уравнениях реакций методом электронного баланса
Слайд 29 Проверь себя
К2Fe+6O4 +
N-3H3 + H2O → Fe+3(OH)3 +N20 + KOH
2N-3 - 6℮ → N20 восстановитель, окисление
Fe+6 + 3℮ → Fe+3 окислитель, восстановление
6
2
1
2
2
4
2
2
К2Fe+6O4 + HCl- → Fe+3Cl3 + Cl20 + H2O+ KCl
Fe+6 + 3℮ → Fe+3 окислитель, восстановление
2Cl- - 2℮ → Cl20 восстановитель, окисление
6
2
3
3
2
4
2
16
8
Слайд 30 Соли железа ІІ
Соединения железа (II)
обладают восстановительными свойствами, они легко превращаются в соединения железа (III)
под действием окислителей:Задание:
Расставить коэффициенты методом электронного баланса
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
FeCl2 +Cl2 FeCl3
FeSO4 + HNO3 + H2SO4 Fe2(SO4)3 + NO + H2O
Слайд 31 Проверь себя
FeSO4 +
KMnO4 + H2SO4
Fe2(SO4)3 + MnSO4 + K2SO4 + H2O+3
+2
+2
+7
2Fe+2 - 2℮ 2 Fe+3 восстановитель, окисление
Mn+7 + 5℮ Mn+2 окислитель, восстановление
10
5
2
FeCl2 +Cl2 FeCl3
Fe+2 - ℮ Fe+3 восстановитель, окисление
Cl20 + 2℮ 2Cl- окислитель, восстановление
2
1
2
5
10
2
2
8
8
2
2
FeSO4 + HNO3 + H2SO4 Fe2(SO4)3 + NO + H2O
+2
0
+3
+2
+3
+5
+2
2Fe+2 - 2℮ 2 Fe+3 восстановитель, окисление
N+5 + 3℮ N+2 окислитель, восстановление
6
3
2
3
6
2
3
2
4
Слайд 32
Закрепление материала
Генетический ряд Fe+2
Fe+2
FeCl2 Fe(OH)2
FeOГенетический ряд Fe+3
Fe+3 FeCl3 Fe(OH)3 Fe2O3
Слайд 33
Проверь себя
Fe + 2HCl
FeCl2+ H2
FeCl2 + 2NaOH
Fe(OH)2 + 2NaClFe(OH)2 FeO + H2O
2Fe + 3Cl2 2FeCl3
FeCl3 + 3NaOH Fe(OH)3 + 3NaCl
2Fe(OH)3 t Fe2O3 + 3H2O

 26заряд ядра +262.Период IV=>число энергетических уровней" alt="Проверка домашнего заданияВизитная карточка железа1.Порядковый номер=>26заряд ядра +262.Период IV=>число энергетических уровней 43.ГруппаVIII подгруппаВ=>валентные электроны распределяются на последнем">
26заряд ядра +262.Период IV=>число энергетических уровней" alt="Проверка домашнего заданияВизитная карточка железа1.Порядковый номер=>26заряд ядра +262.Период IV=>число энергетических уровней 43.ГруппаVIII подгруппаВ=>валентные электроны распределяются на последнем">