Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Решение задач на расчет выхода продукта от теоретически возможного
Содержание
- 1. Решение задач на расчет выхода продукта от теоретически возможного
- 2. Вычисление массовой или объемной доли выхода продукции
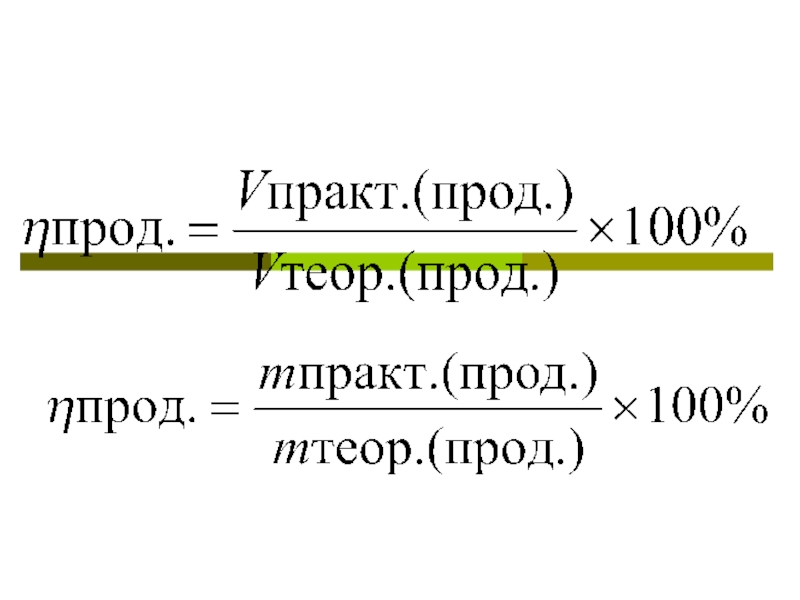
- 3. Формулы
- 4. Сколько л водорода выделится при действии избытка
- 5. Дано:m( )=2,7гНайти:Vпракт ( )-?л
- 6. Решение:1.Найдем n(Al):
- 7. 2.Запишем уравнение реакции и найдем
- 8. 3.Найдем теоретический выход по V.
- 9. 4.Найдем практический выход
- 10. Ответ:
- 11. Закрепление1.Выход железа при взаимодействии железной окалины с
- 12. 2.Выход водорода в реакции взаимодействия натрия с
- 13. Домашнее задание:Решить задачи после §1,упр.8; §8,упр.3; §11,упр.2.
- 14. Скачать презентанцию
Вычисление массовой или объемной доли выхода продукции реакции1.Количество продукта, рассчитанное по уравнению реакции, - это теоретический выход, он соответствует 100%2.Практический выход, то есть реально полученное количество вещества, меньше 100%, и обозначается
Слайды и текст этой презентации
Слайд 2Вычисление массовой или объемной доли выхода продукции реакции
1.Количество продукта, рассчитанное
по уравнению реакции, - это теоретический выход, он соответствует 100%
выход, то есть реально полученное количество вещества, меньше 100%, и обозначается (этта).Слайд 4Сколько л водорода выделится при действии избытка соляной кислоты на
2,7г алюминия, если выход водорода составляет 90% от теоретического?
Слайд 11Закрепление
1.Выход железа при взаимодействии железной окалины с алюминием составляет 85%.Сколько
г железа можно получит из 1кг железной окалины?
Слайд 12
2.Выход водорода в реакции взаимодействия натрия с водой составляет 95%.Сколько
литров водорода получится при растворении в воде 2,3г натрия?
Теги