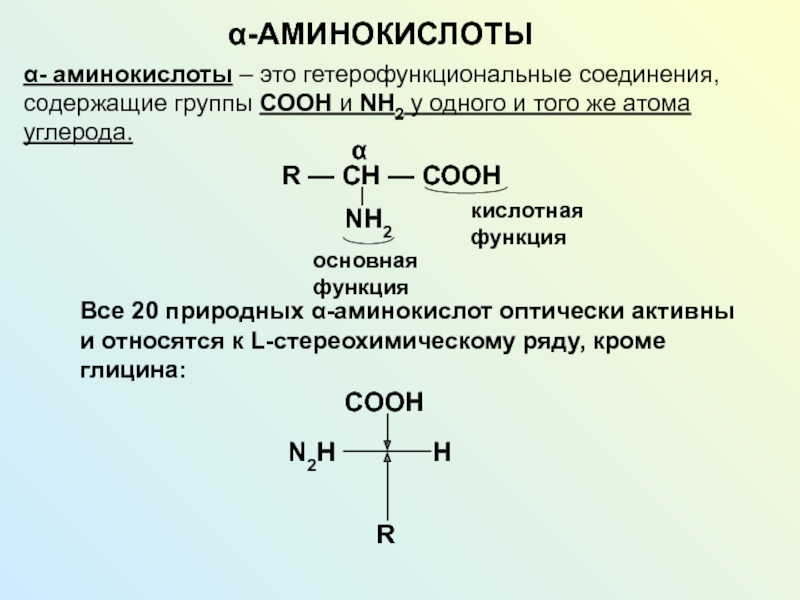
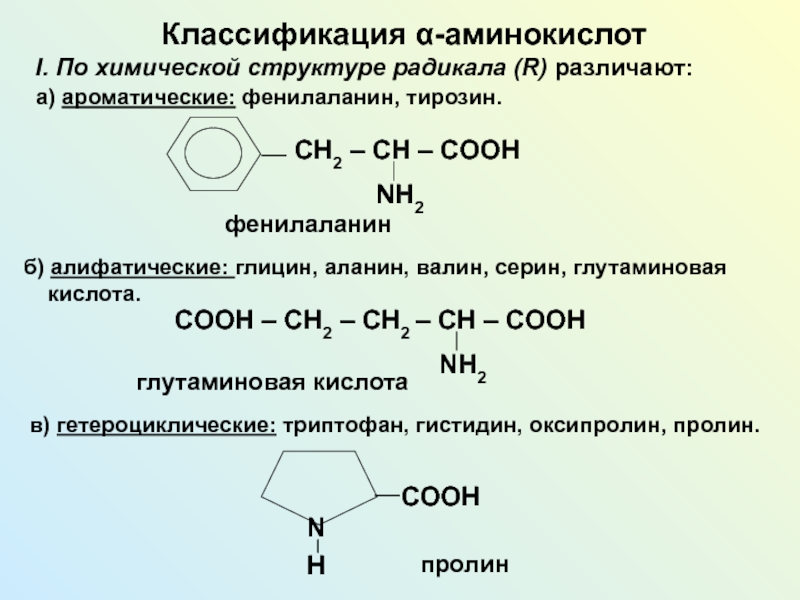
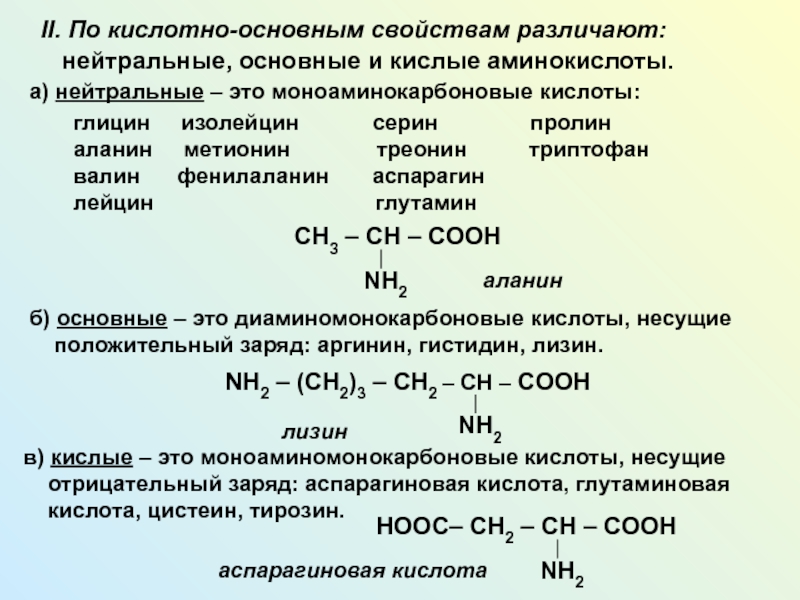
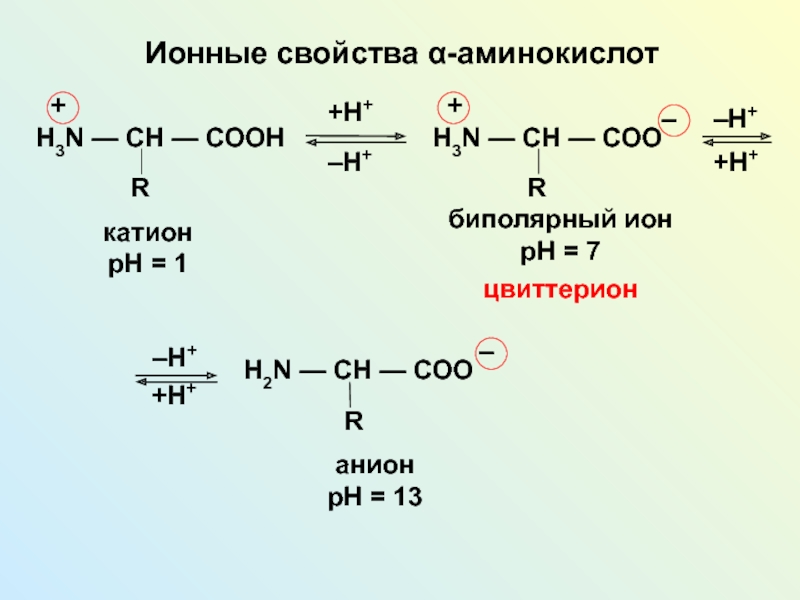
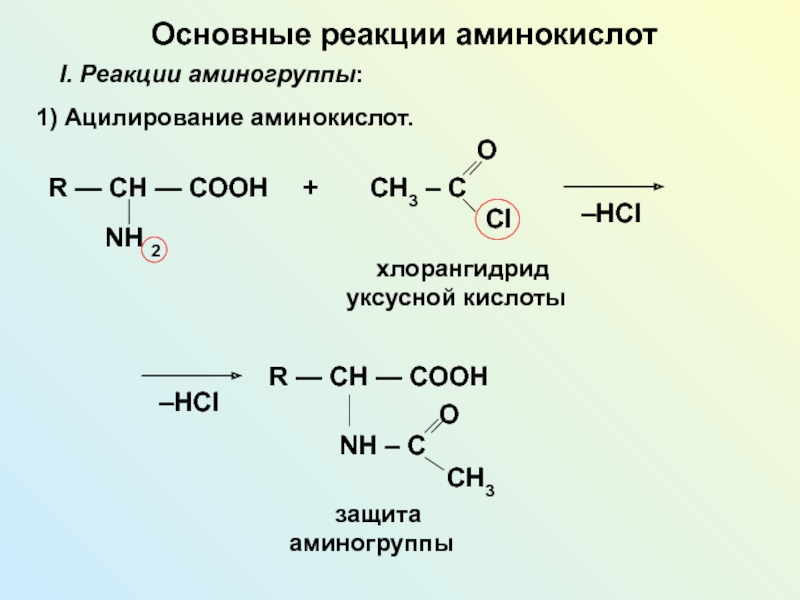
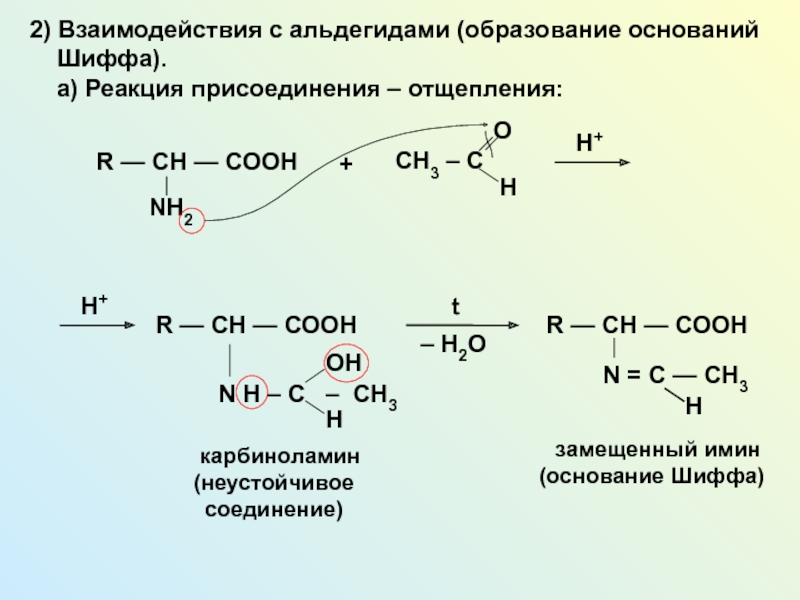
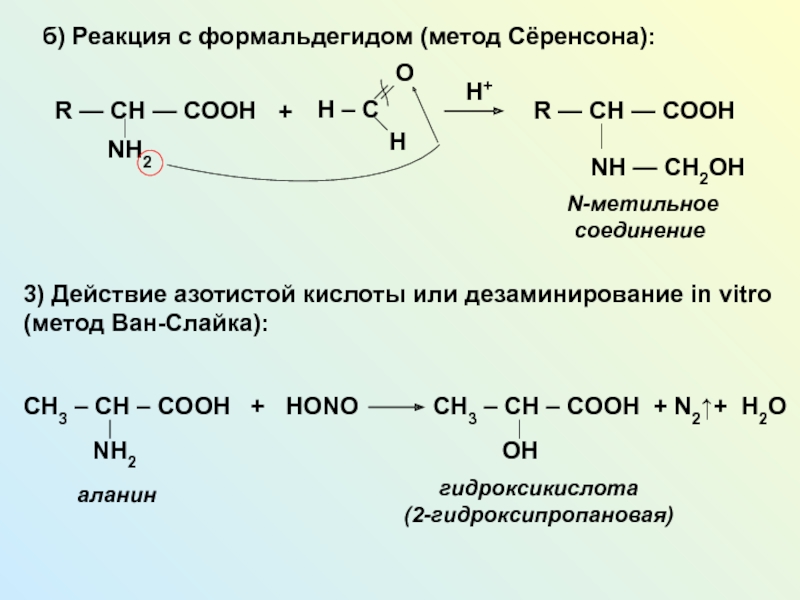
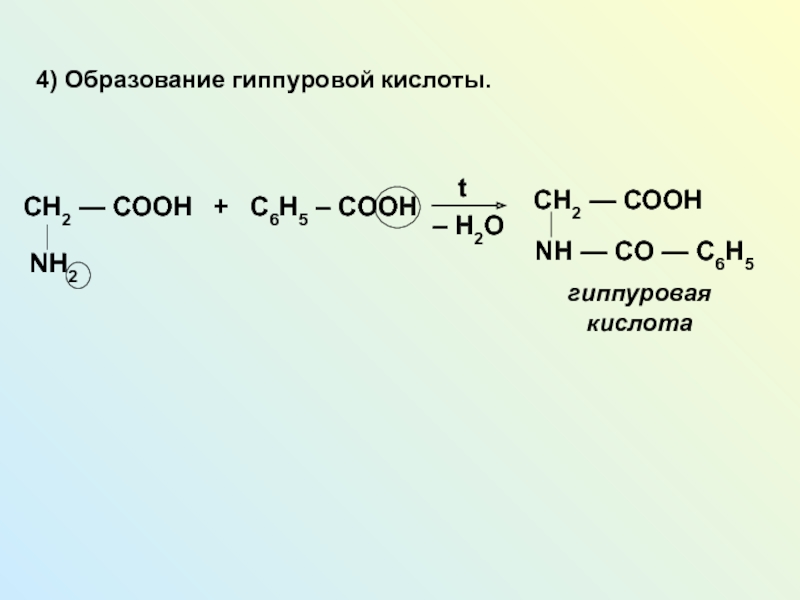
NH2 у одного и того же атома углерода.
R — CH
— СООHNH2
кислотная функция
основная функция
Все 20 природных -аминокислот оптически активны и относятся к L-стереохимическому ряду, кроме глицина:
CООH
N2H
H
R