Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Қ. Жұбанов атындағы Ақтөбе өңірлік мемлекеттік университеті Тақырыбы:
Содержание
- 1. Қ. Жұбанов атындағы Ақтөбе өңірлік мемлекеттік университеті Тақырыбы:
- 2. Слайд 2
- 3. Кіріспе Қазіргі таңда формальдегид өте үлкен
- 4. 1.1 Процестің теориялық негіздері Дегидрлеу
- 5. Дегидрлеу реакциясының классификациясы Дегидрлеу реакциялары сутек бөлінетін
- 6. Дегидрлеу процесінің реакцияларының механизмі Дегидрлеу және гидрлеу реакциялары
- 7. Дегидрлеу процесінің катализаторлары
- 8. Дегидрлену реакциясының тепе-теңдігі Барлық дегидрлеу процестерінің ең басты
- 9. 1.2 Өндіріс шикізатына сипаттамасыБіріншілік спирттерді (метанолдан) дегидрлеумен
- 10. Шикізат. Метанол-формуласы (метил спирті)-түссіз, жеңіл қозғалатын сұйықтық.
- 11. Метанол - токсикалық қасиеті бар, тыныс алу
- 12. Слайд 12
- 13. Формальдегидтің көп бөлігін 37%-тік сулы ерітіндісі күйінде
- 14. 1.3. Формальдегид алу өндірісінің технологиялары Өндірісте спирттерді
- 15. Соңғы кезде формальдегидті алу үшін 0,16 МПа
- 16. ҚОРЫТЫНДЫ Формальдегид-НСНО сусыз күйдегі тітіркендіргіш иісі бар
- 17. Слайд 17
- 18. Назар аударғандарыңызға рахмет!!!
- 19. Скачать презентанцию
Мазмұны Кіріспе 1. Негізгі бөлім 1.1 Процестің теориялық негіздері 1.2 Өндіріс
Слайды и текст этой презентации
Слайд 1Қ. Жұбанов атындағы Ақтөбе өңірлік мемлекеттік университеті
Тақырыбы: Формальдегид өндірісі
Дайындаған: Бапанова
Ж.
Слайд 2
Мазмұны
Кіріспе 1. Негізгі бөлім 1.1 Процестің теориялық негіздері 1.2 Өндіріс шикізатына және өніміне сипаттамасы 1.3 Формальдегид алу өндірісінің технологиялары 1.4 Қолайлы сызба нұсқасының сипаттамасы Қорытынды Қолданылған әдебиеттерСлайд 3Кіріспе Қазіргі таңда формальдегид өте үлкен масштабта өндіріледі. Негізінен, оны бірқатар
полимерлер өндірісі (-фенол, -карбамидті және -меламинформальдегидті полимерлер, полиформальдегид) және изопрен,
пентаэритрит, гексаметилентетрамин (уротропин) синтезі үшін және басқа да бағалы заттарды алу үшін қолданылады. Формальдегидті сонғы жылдары дегидрлеумен алады. Дегидрлеу процестерінің өндірістегі мәні өте зор. Олардың синтетикалық каучук және пластмасса (бутадиен-1,3 және изопрен, стирол) өндірістерінде мономер ретінде қолданылуы зор рөл атқарады.Слайд 41.1 Процестің теориялық негіздері Дегидрлеу деп - сутегі атомын органикалық
қосылыстардан тартып алумен байланысты химиялық процесті айтады. Дегидрлеудің неғұрлым типтік
реакцияларын сутегі атомын тартып алатын байланыс түріне қарай С-С, С-О, С-N дегидрлеу деп классификациялауға болады. Дегидрлеудің барлық процестерінің ішінде неғұрлым практикалық мәні бар келесілер болып табылады: 1) cпирттердің дегидрленуі мен тотығуы (формальдегид пен кетонды алу); 2) aлкил ароматты қосылыстардың дегидрленуі (стирол мен оның гамологтарын алу); 3)парафин мен олефиндердің дегидрленуі (бутадиен-1,3 және изопрен алу).Слайд 5Дегидрлеу реакциясының классификациясы
Дегидрлеу реакциялары сутек бөлінетін атомдар арасындағы байланыс
түрі бойынша жіктеледі.
Ароматты көмірсутектердің бүйір тізбектері стирол типті заттар түзіп
дегидрленуі мүмкін:С-О байланысы бойынша дегидрлеу біріншілік және екіншілік спирттерге айналады, олардан сәйкесінше альдегидтер мен кетондар түзіледі:
С-N байланысы бойынша дегидрлеудің мысалы, нитрил түзілумен жүретін біріншілік аминдерден сутектің бөлінуі болып табылады:
Барлық қарастырылған реакциялар кезінде тізбектегі атомдардың бастапқы орналасуы толық сақталады, бірақ өзгеруімен жүретін дегидрлеу процестері де бар.
Слайд 6Дегидрлеу процесінің реакцияларының механизмі
Дегидрлеу және гидрлеу реакциялары қайтымды болып келеді.
Осыған байланысты дегидрлеу және гидрлеу реакцияларының физикалық–химиялық заңдылықтарында ортақ ерекшеліктері
бар. Сондықтан да олардың термодинамикасын, кинетикасын, катализін және қолайлы жағдайларын таңдап алуда дегидрлеу және гидрлеу процестерін салыстыру қажеттілігі туады. Бұл процесс тотығудың гетерогенді–каталитикалық реакцияларына ұқсас, гамолитті айналу типіне жатады. Негізгі рөлді активті центрлерде (К) реагенттердің хемосорбциясы атқарады. Бұл жағдайда адсорбциялық молекулада катализатордың қатысуымен электронды ауысулар арқылы химиялық байланыстар әлсірейді немесе үзіледі.Түрлі әдістерде сутегінің металдармен сорбцияланып, физикалық адсорбциядан соң байланыстардың әлсіреп, молекуланың диссоциациялануы өтеді:
Слайд 7Дегидрлеу процесінің катализаторлары Жоғары температураларда өтетін термиялық
айналулардан басқа, барлық гидрлеу және дегидрлеу реакциялары–каталитикалық болып табылады. Дегидрлеу
және гидрлеу реакцияларының қайтымдылығы және түрлі катализаторлардың тіке және кері бағыттағы процесті жылдамдату қабілеттілігі-өтетін екі реакцияның бірдей заттармен катализденуімен сипатталады. Оларды негізгі үш топқа бөлуге болады: 1) Периодты жүйедегі VIII топтың металлдары (Fe, Co, Ni, Pd, Pt) және IБ топшаның (Cu, Ag) металлдары, сонымен қатар осы металлдардың қоспалары; 2) Металл оксидтері (МgO, ZnO, Cr2O3, Fe 2O3) 3)Оксид пен сульфид қоспаларынан тұратын (мыс, цинкхромоксидті CuO·Cr2O3 және Zn·Cr2O3, кобальтмолибденоксидті CоO·МоO3, никель және кобальтвольфрамоксидті NiO·WO3, CоO·WO3).Слайд 8 Дегидрлену реакциясының тепе-теңдігі
Барлық дегидрлеу процестерінің ең басты ерекшелігі олардың қайтымдылығы
болып табылады. Дегидрлеудің эндотермиялық реакцияларында жоғары температурада тепе-теңдік сол жағына
қарай ауысады.Тотығу-дегидрленудің ерекшеліктері-оның жүрісі кезінде сутегінің кейбір бөлігі сумен байланысады, ал бұл жайт дегидрлеу реакциясының тепе-теңдігіне әсер етпейді:
Сондықтан мұндай процестердің тепе-теңдігі тотығу және дегидрлену реакцияларының қатынасына байланысты. Басқа тең жағдайларда тепе-теңдік оңға қарай көп ауысады, бұл тотығу-дегидрленудің басты артықшылықтары болып табылады.
Слайд 91.2 Өндіріс шикізатына сипаттамасы
Біріншілік спирттерді (метанолдан) дегидрлеумен немесе тотықтырумен тек
қана формальдегид алынады:
Спирттер көптеген өндірістерде еріткіш ретінде қолданылады. Химиялық өнеркәсіпте
оларды сан алуан синтездер үшін бастапқы зат ретінде пайдаланады. Әсіресе, арзан және тиімді болғандықтан, метанол кең қолданылады. Қазіргі кезде метанолды бастапқы шикізат ретінде пайдаланып, көптеген жаңа технологиялық процестер жасалуда.
Слайд 10
Шикізат. Метанол-формуласы (метил спирті)-түссіз, жеңіл қозғалатын сұйықтық. Қайнау температурасы -
64,65ºС, кристалдану температурасы - 97,4ºС, қысымы - 0,792 т/м3. Метанолдың критикалық
температурасы - 239,6ºС-қа тең.Метанол сумен, спирттермен, бензолмен, ацетонмен және басқа да органикалық еріткіштермен жақсы әрекеттеседі. Соның ішінде кейбіреулермен азеотропты қоспаны түзуі мүмкін. Алифатикалық қатардағы көмірсутектерде ерімейді. Суы бар еріткіштерде 93,3 моль метанолы бар мөлшерін түзе алады. Ацетилен, этилен, метан сияқты әртүрлі газдарды жақсы ерітеді. Қатты күйінде екі түрлі кристаллды формаларда болуы мүмкін. Бұл кезде өзара формалар бірінен-екіншісіне-115,75ºС температурада өтеді, яғни төмен 6,0 көлемінде және жоғары көлемінде құрғақ метанол ауамен жарылғыш қоспаларды түзуі мүмкін.
Слайд 11 Метанол - токсикалық қасиеті бар, тыныс алу жолдары арқылы улануға
шалдықтыруы мүмкін.Сонымен қатар ішке қолдану арқылы нерв жүйесіне үлкен әсерін
тигізуі мүмкін. Метанолдың ШРК-5 мг/м3 құрайды.Жалпы алғанда спирттер көмірсутектердің гидроксилді туындылары болып табылады.
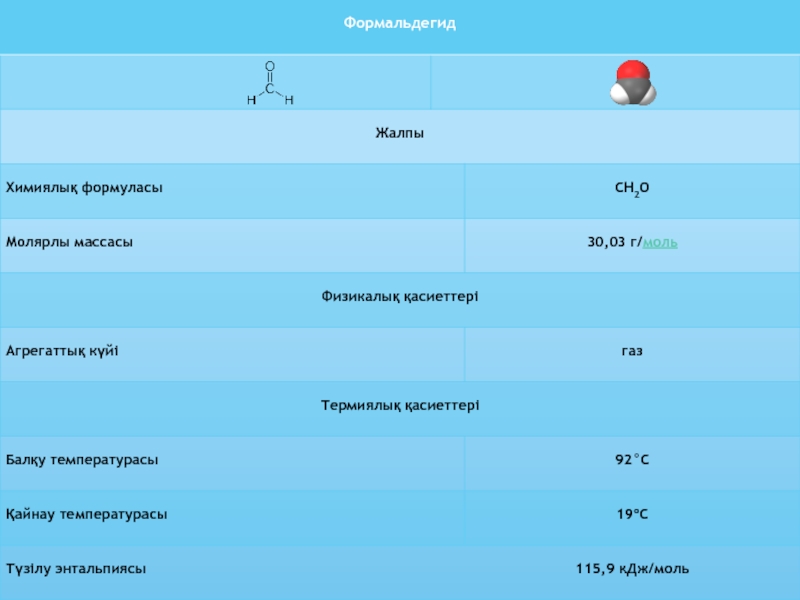
Өнім. Формальдегид-НСНО сусыз күйдегі тітіркендіргіш иісі бар түссіз газ (0,1 МПА кезінде конденсациялану температурасы–190С). Сақтау кезінде ол жеңіл полимерленеді және қатты полимер күйінде параформальдегид (параформ) түрінде шығарылады. Ол өте жеңіл деполимерленеді. Параформ қайталанатын оксиметиленді түйіндері бар (олардың саны 8-100) сызықтық полимер болып табылады:
Слайд 13 Формальдегидтің көп бөлігін 37%-тік сулы ерітіндісі күйінде шығарады. Оны басқаша
формалин деп те атайды. Оның құрамында формальдегид гидрат және төмен
молекулалы полимер түрінде (полиоксиметиленгликоль) болады. Терең полимерленуден қорғау мақсатында және формалинге тұнбаның түспеуі үшін оған стабилизатор ретінде 7-12% (масс.) метанолды қосады.Көптеген химиялық өндірістердің өрт қауіптілігінің негізгі анықтаушы факторы-қолданылатын газ тәрізді (бу тәрізді) заттардың лап ету температурасы мен жарылу шегі болып табылады. Яғни, барлық өндірістер өрт қауіптілігінің дәрежесі бойынша негізгі 5 класқа жіктеледі: А, Б, В, Г және Д.
Формальдегидтің жоғарғы жарылу шегі-7,0% (көл), ал төменгі жарылу шегі-73% (көл) құрайды. Осыған байланысты формальдегид өндірісі А класына жатады. Өйткені, су немесе оттегінің ауамен әрекеттесуінің нәтижесінде формальдегид (сұйықтық буының лап ету температурасы-28°С және одан төмен, ауамен қоспасындағы төменгі жарылу шегі-10% (көл) және одан да төмен болатын) тез жанып, жарылыс қаупін тудыруы мүмкін.
Слайд 141.3. Формальдегид алу өндірісінің технологиялары
Өндірісте спирттерді дегидрлеу мен тотықтыру
жолымен бұрын Лебедев әдісі бойынша көптеген альдегидтер мен кетондар, сонымен
қатар бутадиен-1,3 алды, ал қазіргі кезде бұл процесс тек екіншілік спирттерді кетондарға және метанолды формальдегидке дегидрлеу мен тотықтыру үшін ғана пайдаланды.Өндірісте формальдегидті келесідей әдістермен алады:
метанның формальдегидке термиялық тотығуы;
метанның формальдегидке каталитикалық тотығуы арқылы;
Бұрын қолданған әдістен басқа формальдегидтің негізгі массасын метанолдан екі әдіспен:
метанолдың формальдегидке тотығуы;
метанолдың формальдегидке тотығып дегидрленуі арқылы алады.
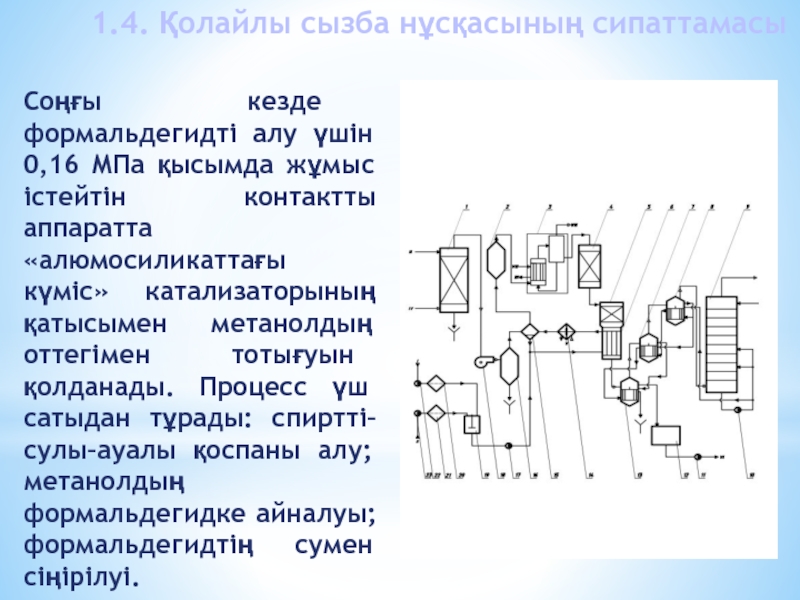
Слайд 15Соңғы кезде формальдегидті алу үшін 0,16 МПа қысымда жұмыс істейтін
контактты аппаратта «алюмосиликаттағы күміс» катализаторының қатысымен метанолдың оттегімен тотығуын қолданады.
Процесс үш сатыдан тұрады: спиртті–сулы–ауалы қоспаны алу; метанолдың формальдегидке айналуы; формальдегидтің сумен сіңірілуі. 1.4. Қолайлы сызба нұсқасының сипаттамасы
Слайд 16ҚОРЫТЫНДЫ Формальдегид-НСНО сусыз күйдегі тітіркендіргіш иісі бар түссіз газ. Сақтау кезінде
ол жеңіл полимерленеді және қатты полимер күйінде параформальдегид (параформ) түрінде
шығарылады. Ол өте жеңіл деполимерленеді. Формальдегидтің көп бөлігін 37%-тік сулы ерітіндісі күйінде шығарады. Формальдегидтің жоғарғы жарылу шегі-7,0% (көл), ал төменгі жарылу шегі-73% (көл) құрайды. Осыған байланысты формальдегид өндірісі А класына жатады. Өйткені, су немесе оттегінің ауамен әрекеттесуінің нәтижесінде формальдегид (сұйықтық буының лап ету температурасы-28°С және одан төмен, ауамен қоспасындағы төменгі жарылу шегі-10% (көл) және одан да төмен болатын) тез жанып, жарылыс қаупін тудыруы мүмкін.Слайд 17
1. Юкельсон И.И. «Технология основного органического синтеза» М.: Химия, 1968 – 848 с.
2. Лебедев Н.Н. «Химия и технология основного органического и нефтехимического синтеза» изд. 2-е, пер. М., «Химия», 1985 г.
3. Огродников С.К. Формальдегид.-Л: Химия,1984.-280 с.
5. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. «Общая химическая технология». Учебник для технических ВУЗов. – М.: «Высшая школа», 1990 г.
6. «Общая химическая технология». Учебник для химико-технологических специальностей вузов. Под ред. проф. И.П.Мухленова. – М.: Высш. шк., 1984 г.
7. Капкин В.Д., Савинецкая Г.А., Чапурин В.И. «Технология органического синтез» М: «Химия», 1987 г.