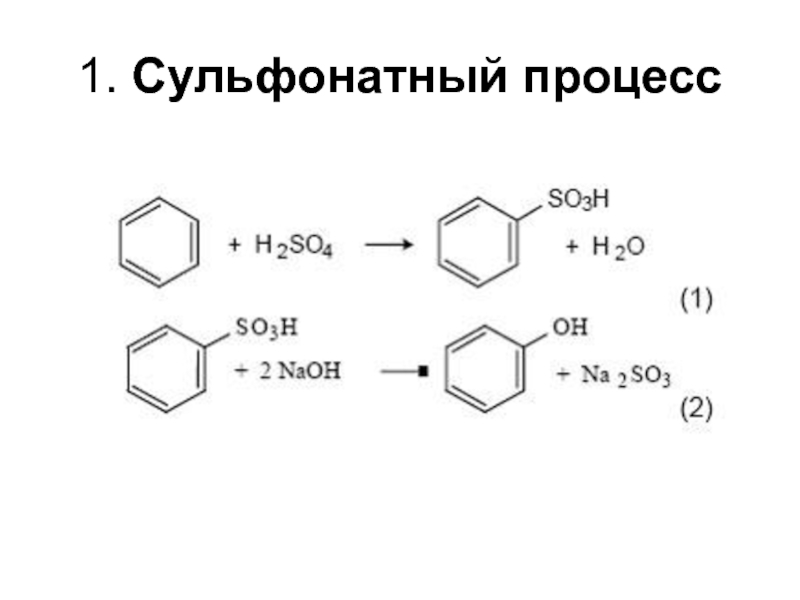
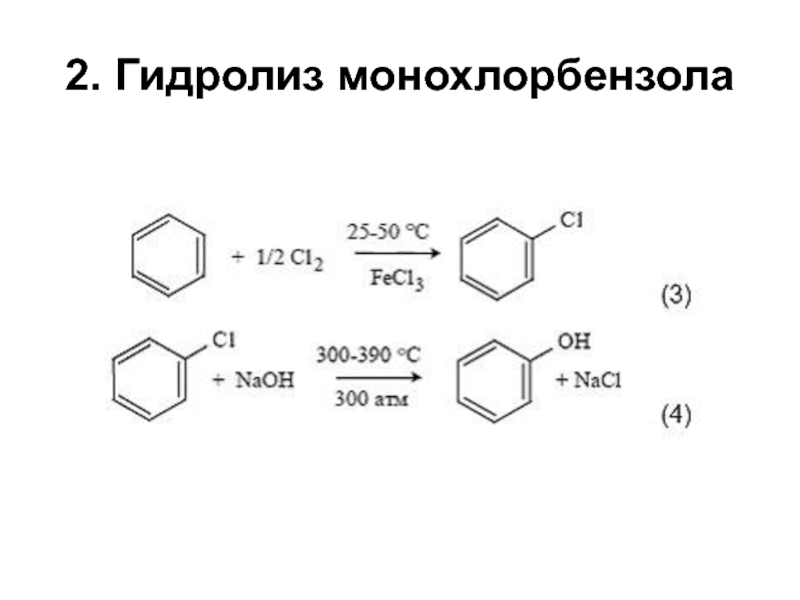
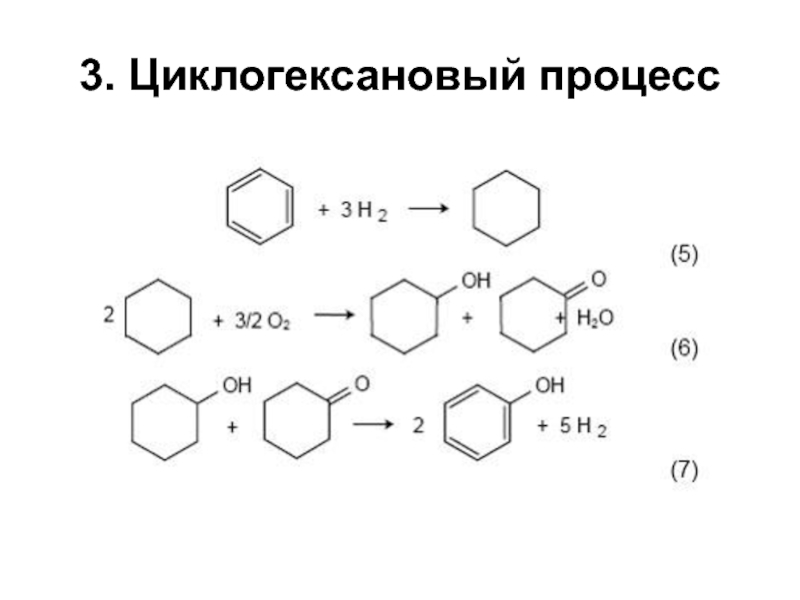
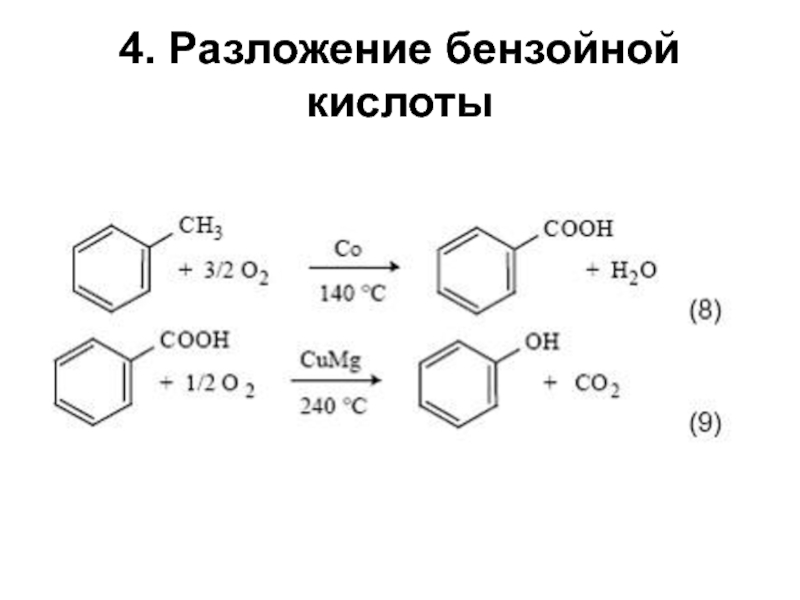
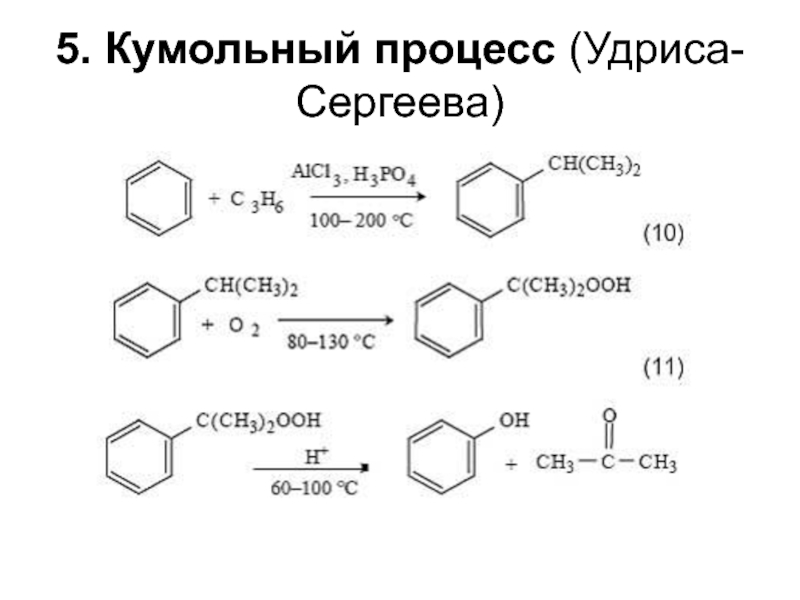
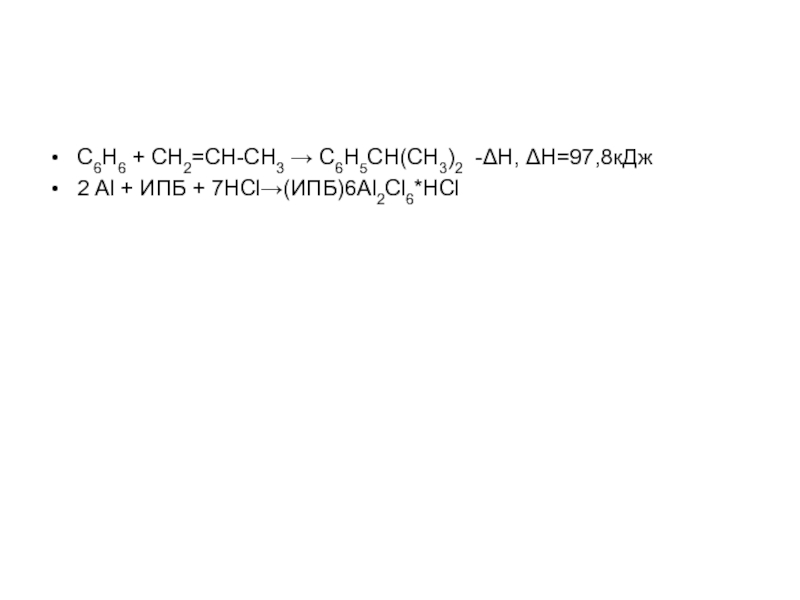
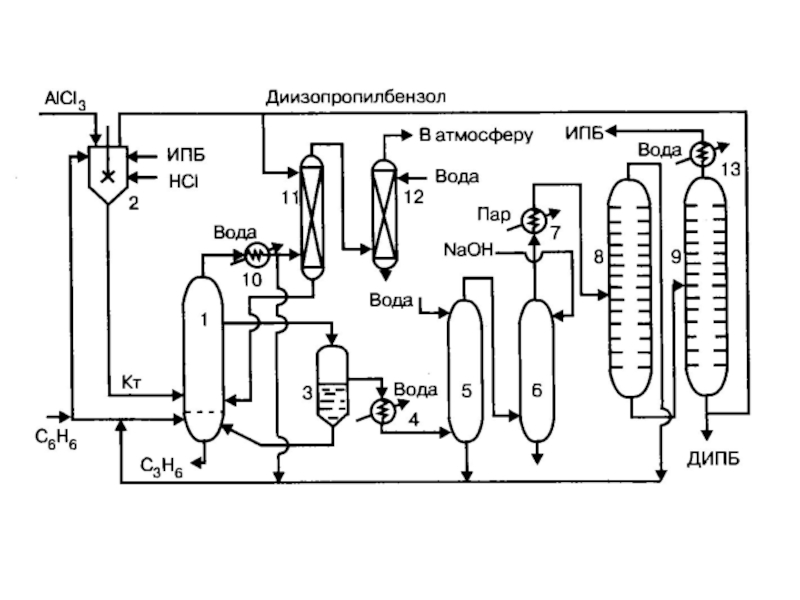
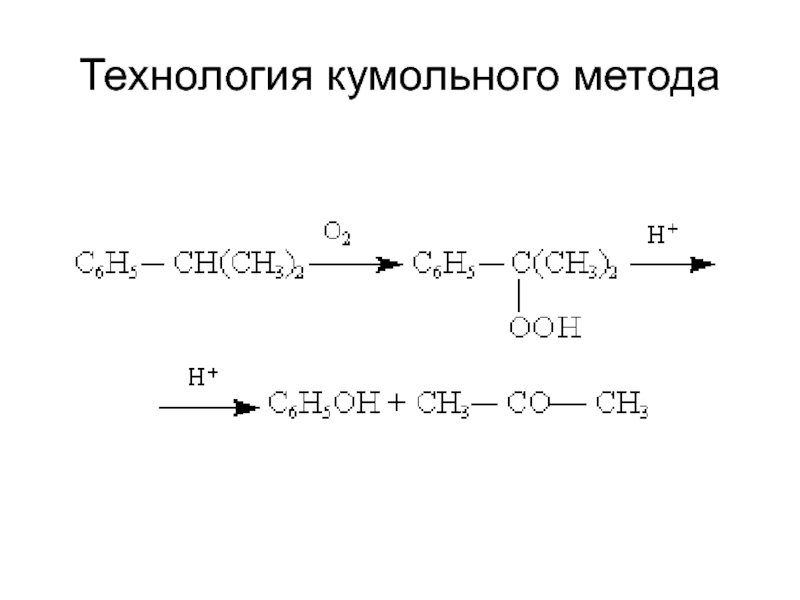
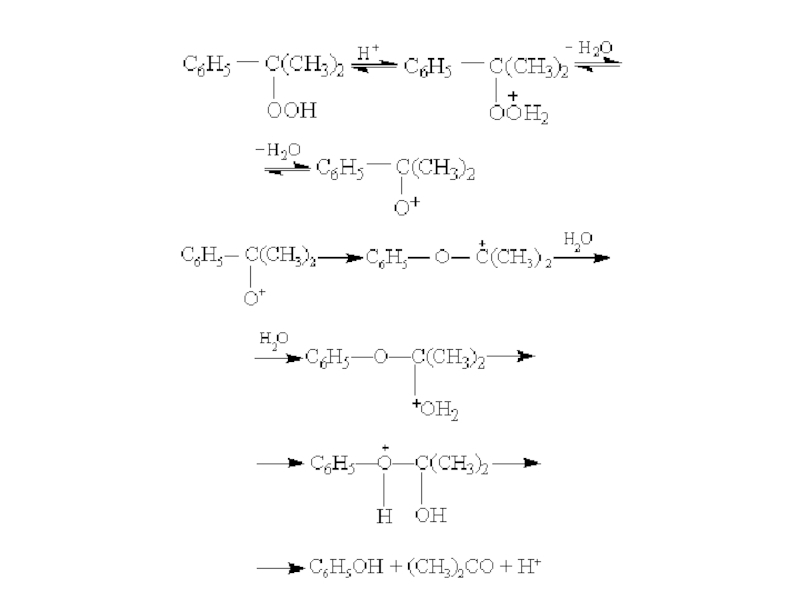
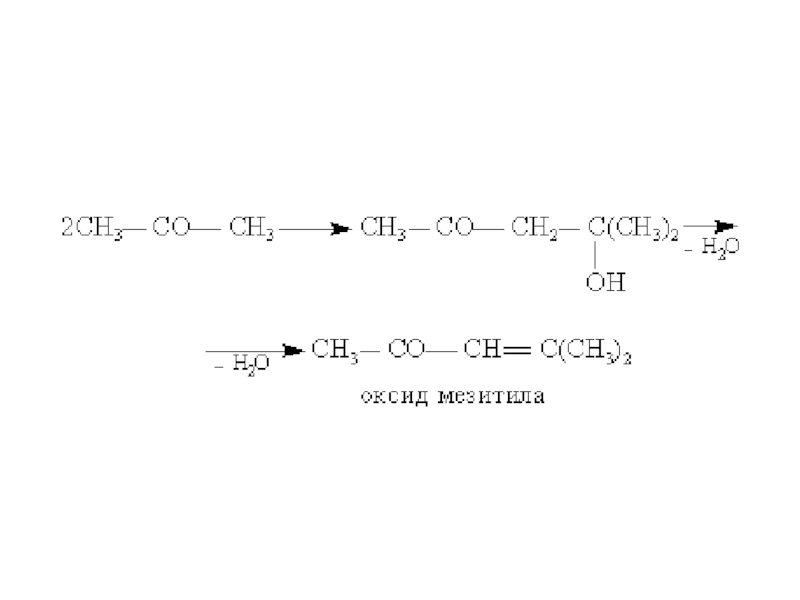
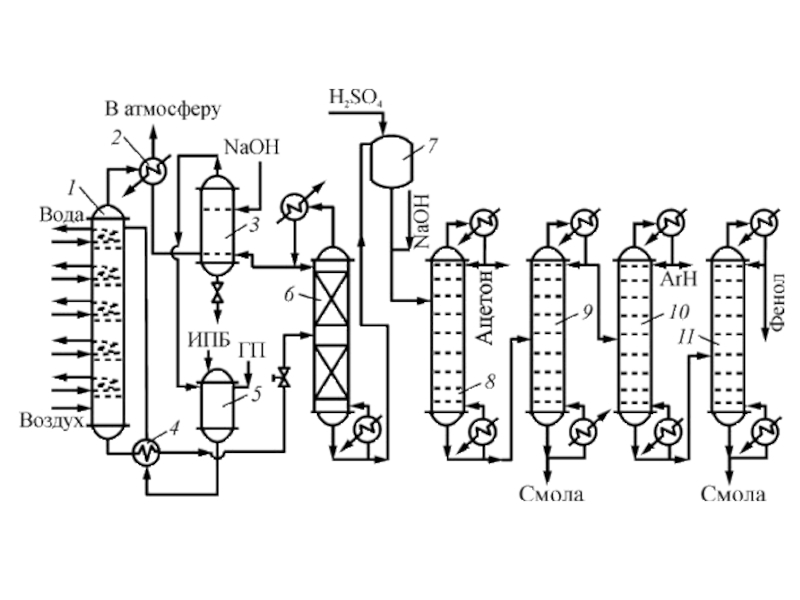
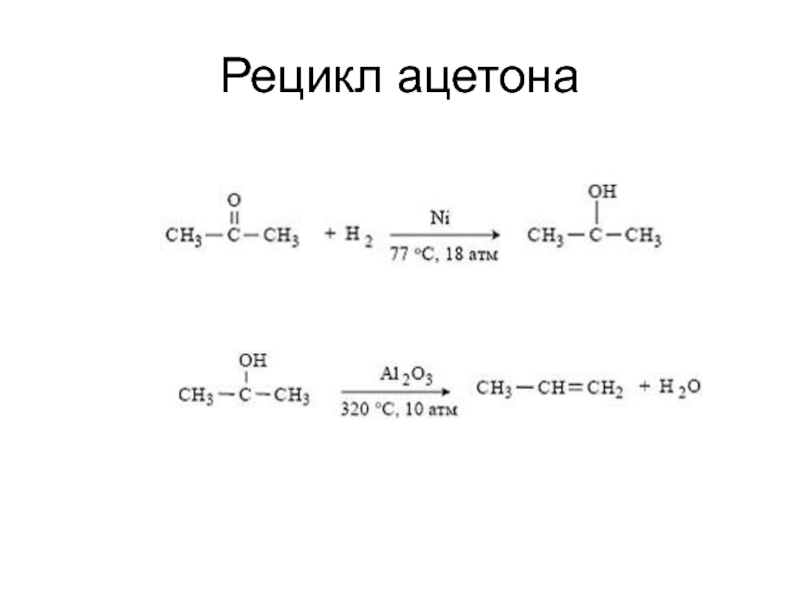
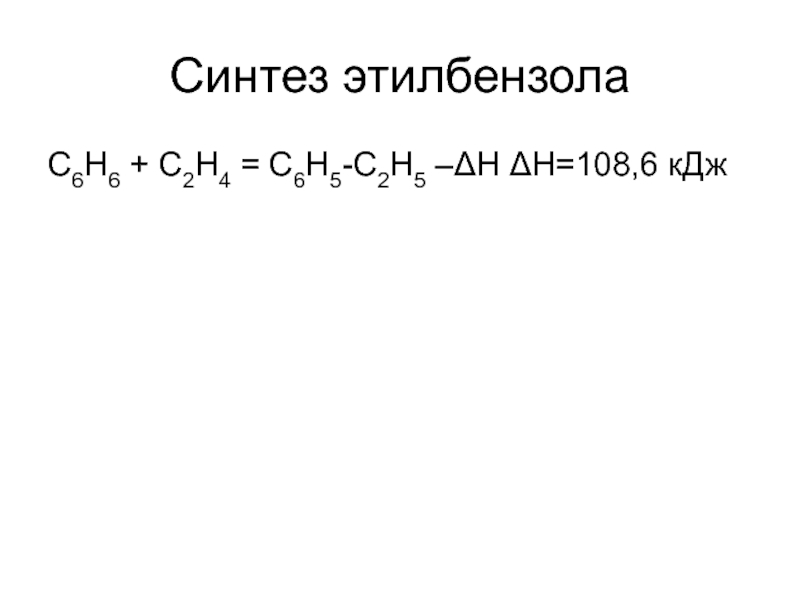
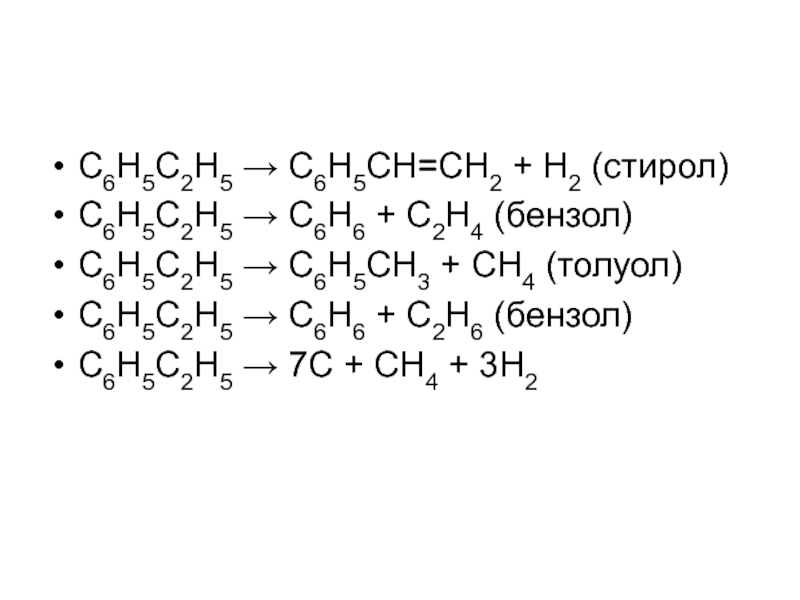
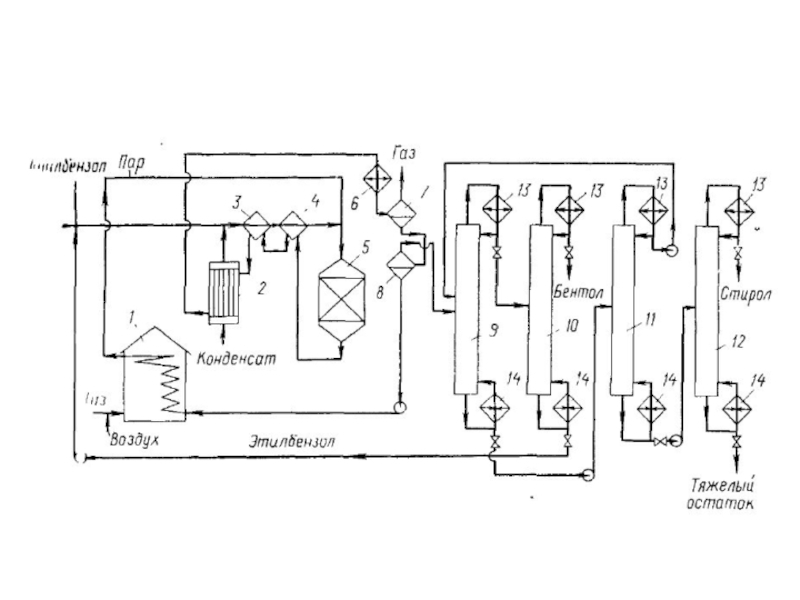
структуру:
44 % фенола расходуется на производство бисфенола А;
30 % фенола расходуется
на производство фенолформальдегидных смол; 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
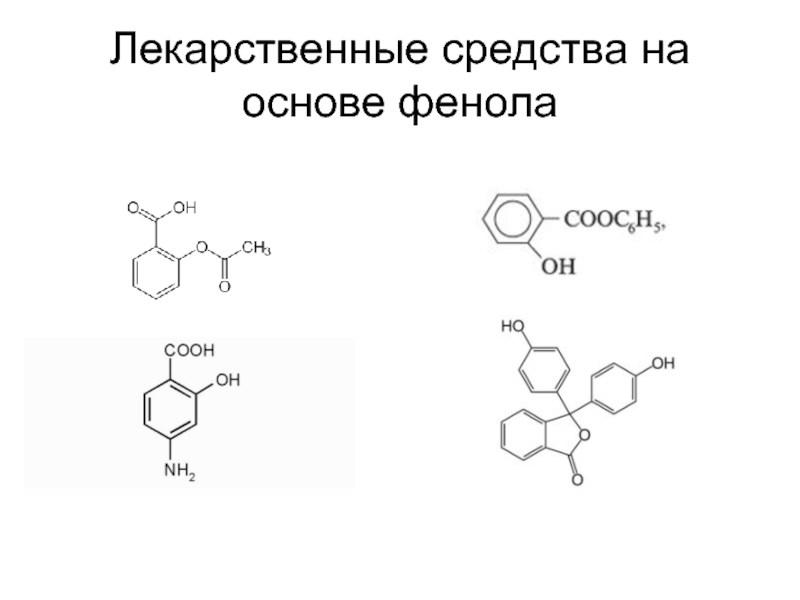
14 % расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов, антисептикови пестицидов.