Слайд 2 Биосинтез белка это центральный процесс живой клетки:
именно через него « мертвые « молекулы нуклеиновых кислот обретают
жизнь, химия превращается в биологию.
Спирин А.С.
Процесс создания химической структуры белка ( синтез полипептидной цепи), а также физическое сворачивание в функционально активную глобулу осуществляется рибосомой. Каждая рибосома полностью прочитывает одну молекулу мРНК соответственно ее программы, синтезирует одну молекулу белка, после чего может быть запрограммирована другой молекулой мРНК и произвести совсем другой белок. Количество рибосом в клетке сильно варьирует - от тысяч до десятков тысяч на клетку, в зависимости от типа клетки.
Слайд 3Общая схема биосинтеза белков в клетке (ДНК—РНК—белок ).
Слайд 4 Т Р А Н С К Р И П
Ц И Я: Отдельные участки молекулы ДНК, называемые генами,являются матрицами
для синтеза на них однотяжевых цепей РНК. Синтезированные цепи РНК, точно воспроизводят
дезоксирибонуклеотидную последовательность цепи ДНК в своей рибонуклеотидной последовательности.
П Р О Ц Е С С И Н Г И Т Р А Н С П О Р Т: в течение синтеза и после него, молекула РНК, особенно в эукариотических клетках, может подвергаться дополнительным изменениям ( вырезанию кусков,добавлению концевых групп, модификации нуклеотидов). Образующийся «мессенджер» (мРНК) поступает далее к рибосомам (у эукариот из ядра в цитоплазму) в качестве программы, определяющей аминокислотную последовательность в синтезируемом белке.
Слайд 5 АКТИВИРОВАНИЕ И АКЦЕПТИРОВАНИЕ
АМИНОКИСЛОТ
Протеиногенные аминокислоты являются исходным материалом из которого синтезируется белок, однако в свободном виде они (аминокислот) не могут использоваться рибосомой. Каждая аминокислота сначала активируется с помощью АТФ.
1. Аминокислота + АТФ =
Аминоацил-аденилат + Пирофосфат
2. Аминоацил -аденилат + тРНК=
Аминоацил—тРНК + АМФ
Аминоацил—тРНК поступает на рибосому в ка-
честве субстрата для биосинтеза белка.
Слайд 6 Т Р А Н С Л Я Ц И
Я : Рибосомы являются молекулярными машинами, транслирующими генетическую
информацию с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности синтезируемой полипептидной цепи белка. Каждая рибосома последовательно сканирует цепь мРНК, и соответственно выбирает из среды те аминоацил—тРНК, которые комплементарны триплетным комбинациям нуклеотидов, находящимся в данный момент на рибосоме. Движение рибосомы вдоль цепи мРНК задает строгий временной порядок вхождения в рибосому разных аминоацил-тРНК в
соответствии с порядком расположения кодирующих нуклеотидных комбинаций вдоль мРНК. Каждый аминокислотный остаток, выбранный аминоацил—тРНК, ковалентно присоединяется рибосомой к растущей полипептидной цепи, а деацилированная тРНК освобождается из рибосомы. В такой последовательности строится полипептидная цепь.
Слайд 7 Формирование функционального белка : По мере синтеза полипептидной цепи
она частично высовывается из рибосомы и начинает сворачиваться в глобулу
( котрансляционный фолдинг ). По завершению синтеза, по прочтении всей мРНК, полипептидная цепь освобождается из рибосомы и окончательно сворачивается ( посттрансляционный фолдинг ). Синтезируемый белок может транспортироваться через клеточные мембраны. Сворачивание белка и его транспорт сопровождается различными ковалентными модификациями с помощью ферментов.
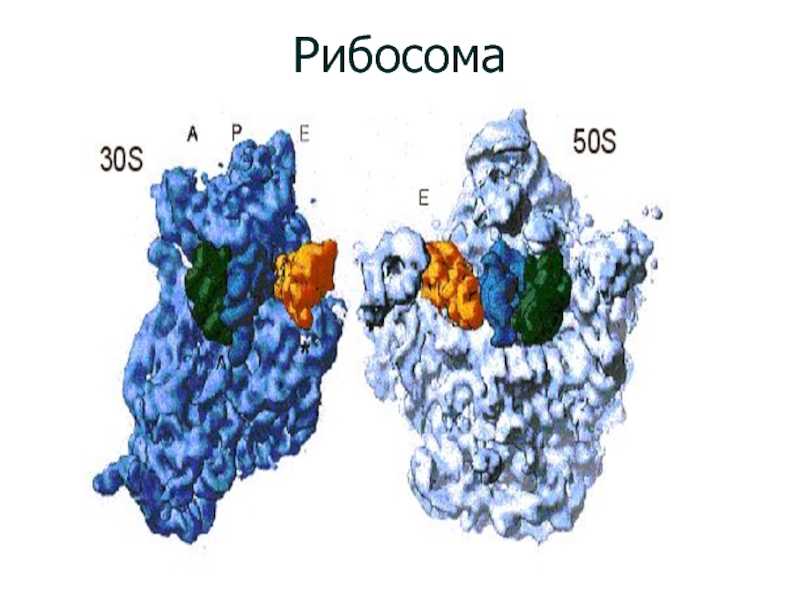
Слайд 9 Рибосома это компактная частица, специфической формы, лишенная внутренней
и внешней симметрии, с диаметром около 30 нм. Бактериальные
рибосомы имеют коэффициент седиментации 70S , а более крупные рибосомы эукариотических организмов ( животные, растения, и грибы ) представлены 80S частицами. Их диссоциация на субчастицы 70S 50S + 30S ;
80S 60S +40S обратима.
Обе субчастицы несут разную функциональную нагрузку в биосинтезе белка, и их лабильная ассоциация нужна
для обеспечения взаимной подвижности этих блоков в процессе работы
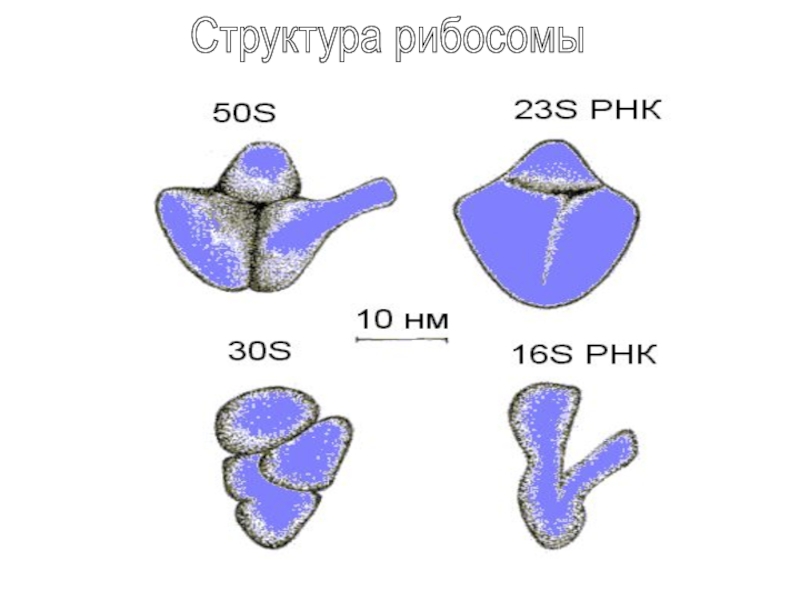
Слайд 10 Методом рассеяния нейтронов установлено, что каждая рибосомная субчастица содержит
одну молекулу высокополимерной рибосомной РНК, составляющая от половины до
двух третей всей массы субчастицы. При формировании частиц ( большой и малой ) цепи соответствующих рибосомных РНК сами сворачиваются, что определяет конечную морфологию рибосомной субчастицы. Высокополимерная рибосомная РНК это каркас для размещения рибосомных белков, которые больше локализуются на периферии. Рибосома лишь « прикрыта « белками, которые организованы в трехмерные кластеры, где часть белков лежит под другими.
Главная каталитическая функция рибосомы— пептидилтрансферазная активность, которую обеспечивает ее большая субчастица. Ферментативный катализ протекает в структурном кармане рибосомы.
Слайд 12 Рибосому разделяет борозда, которая сильно расширяется в одном
месте, обнажая « глаз» рибосомы. Эта особенность отражает реальный
факт существования полости между рибосомными субчастицами. Именно в этой полости размещаются основные субстраты рибосомы—молекулы пептидил-тРНК и аминоацил-тРНК, участвующие в образовании полипептидной цепи. Это –тРНК—связывающий центр рибосомы.
Малая субъединица рибосомы имеет « головку» и « тело»., образуемые глубокой бороздой. Последняя выполняет функцию « шеи « -- место, в котором размещается участок связывания мРНК и через которое цепь протягивается от одного конца к другому. У большой рибосомной субцастицы в « шее « размещается главный каталитический центр рибосомы—пептидил-трансферазный центр.
Слайд 13
Обе « шеи» находятся напротив друг друга и между ними
располагается «глаз».
Важной характерной чертой рибосомы является подвижный
палочкообразнвй выступ большой субъединицы, справа от «головки».
Генетические функции малой рибосомной субчастицы:
Именно малая субъединица рибосомы, и только она, связывается с мРНК, т.е. служит первичным приемником генетической информации для белок-синтезирующего аппарата. Удержание мРНК на рибосоме есть функция малой субчастицы, в то время как большая в этом не участвует.
Слайд 15 Центр Р рибосомы занимает пептидил-тРНК, и
рибосома может связывать молекулу аминоацил-тРНК, соответствующую кодону, установленному в данный
момент в А-участке.. ( шаг I ).
В результате удерживаемая рибосомой пептидил-тРНК и вновь связанная аминоацил-тРНК, оказываются в рибосоме в состоянии – бок—о -- бок ( состояние II ). Рибосома катализирует р-цию транспептидации между двумя субстратами рибосомы—пептидил-тРНК и аминоацил –тРНК: пептидильный остаток переносится от « своей» тРНК на аминогруппу аминоацил-тРНК, удлиняясь на одну аминокислоту с С-конца. ( шаг II). В Р-участке осталась деацилированная тРНК, а в А- участке помещается остаток тРНК, удлиненной пептидил-тРНК ( состояние III ). Деацилированная тРНК выталкивается из Р-участка, а пептидил-тРНК перемещается, вместе со связанным с ней кодоном мРНК, из А- участка в Р- участок ( шаг III).
Слайд 16В итоге А-участок освобождается, и в нем устанавливается следующий кодон
мРНК. Цикл завершен.
Факторы элонгации FЕ-1 и ЕF-2.
Таким образом, большая субъединица рибосомы выступает как фермент, ответственный за образование пептидных связей. Это главная энзиматическая функция рибосомы. В рибосоме есть четкое разделение труда: малая субъчастица выполняет генетические функции,
являясь ответственной за прием и декодирование генетической информации. Большая частица участвует в энзиматических реакциях в процессе трансляции.
М А Ц И О Н Н А Я
П О Д В И Ж Н О С Т Ь Р И Б О С О М
Цикл Элонгации в рибосоме рассматривается с точки зрения модели смыкания- размыкания (1),
а фактор элонгации ЕF- 1 с ГТФ открывает рибосому. (2) После расщепления ГТФ, фактор элонгации ЕF-1 покидает рибосому, а аминоацильный конец-тРНК взаимодействует с пептидил- трансферазным центром большой субчастицы, и способствует смыканию субчастиц и запиранию рибосомы. (3)
Слайд 18Реакция транспептидации происходит в « закрытой « рибосоме между группами
двух субстратов- пептидил—тРНК и аминоацил—тРНК. (4).Размыкание пре-транслокационной рибосомы
промотируется фактором элонгации ЕF-2 с ГТФ. Это приводит к выходу деацилированной тРНК и смещению остатка тРНК молекулы пептидил-тРНК вместе с мРНК. (5) Гидролиз ГТФ и уход фактора элонгации ЕF-2 снова дает возможность рибосоме сомкнуться. В ходе элонгационного цикла рибосома осциллирует между сомкнутым и разомкнутым состояниями.
Слайд 20 Антибиотики- вещества, синтезируемые микроорганизмами и подавляющие размножение бактерий, других
микробов, а также вирусов и клеток. Большинство антибиотиков продуцируются микроорганизмами
из рода актиномицетов ( Streptomyces sp. ) и определенными грибами. Однако существуют и синтетические антимикробные вещества, такие как сульфаниламиды и ингибиторы гираз.
Слайд 21 Интеркаляторы такие как рифамицин, рубомицин и актиномицин
D встраиваются в двойную спираль ДНК, таким образом препятствуя репликации
и транскрипции. Интеркаляторы токсичны и для эукариот, поэтому их применение в качестве цитостатиков ограниченно. Синтетические ингибиторы ДНК-топоизомераз, так называемые –Ингибиторы гираз воздействуют на репликацию, и тем самым подавляет репродукцию бактерий. К ингибиторам трансляции относится большая группа антибиотиков, воздействующих на рибосому ( Аминогликозиды, Тетрациклины, Эритромицин, Пуромицин, Хлорамфеникол). Тетрациклины- антибиотики широкого спектра действия. Аминогликозиды, воздействуют на все фазы трансляции.
Слайд 22Эритромицин нарушает нормальную функцию большой рибосомной субцастицы. Хлорамфеникол-является одним из
немногих природных нитросоединений, ингибирующих пептидилтрансферазу.Пуромицин имитирует аминоацил-тРНК, вызывая преждевременную терминацию
элонгации.
Бета- лактамные антибиотики (наиболее известные пенициллины и цефалоспорины) ингибируют синтез клеточных стенок бактерий.