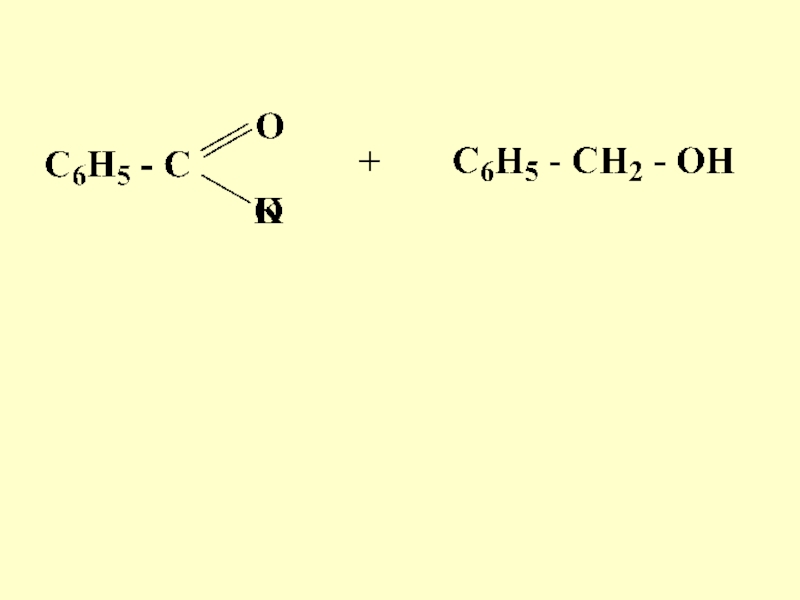Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
lektsia_8.ppt
Содержание
- 1. lektsia_8.ppt
- 2. План8.1. Общая характеристика оксосоединений (карбонильных соединений)8.2. Реакции
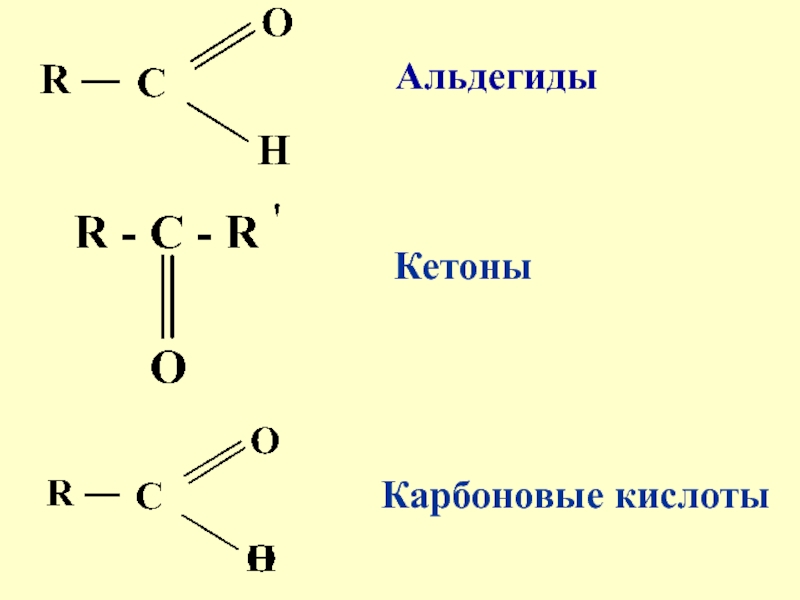
- 3. 8.1. Общая характеристика оксосоединенийК карбонильным соединениям относят соединения, содержащие карбонильную группу: альдегиды, кетоны, карбоновые кислоты
- 4. АльдегидыКетоныКарбоновые кислоты
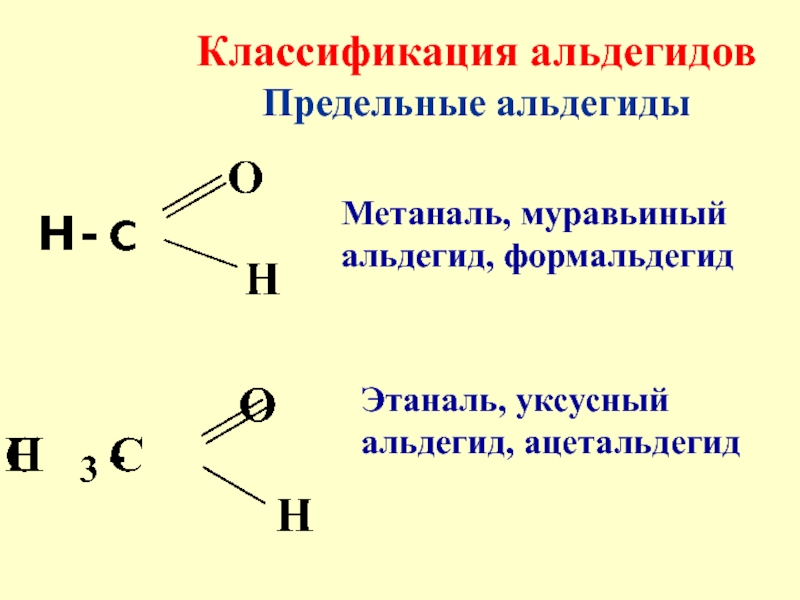
- 5. Классификация альдегидов Предельные альдегидыМетаналь, муравьиный альдегид, формальдегидЭтаналь, уксусный альдегид, ацетальдегид
- 6. Пропаналь, пропионовый альдегидБутаналь, масляный альдегидПентаналь, валериановый альдегид
- 7. Непредельные альдегидыПропеналь, акролеинБутен-2-аль, кротоновый альдегид
- 8. Ароматические альдегидыБензойный альдегидn-толуиловый альдегид
- 9. Фенилуксусный альдегидn-толилуксусный альдегид
- 10. Алифатические кетоныПропанон, диметилкетон, ацетонБутанон, метилэтилкетон
- 11. Смешанные жирноароматические и ароматические кетоныСмешанные жирноароматические и ароматические кетоныДифенилкетонМетилфенил кетон, ацетофенон
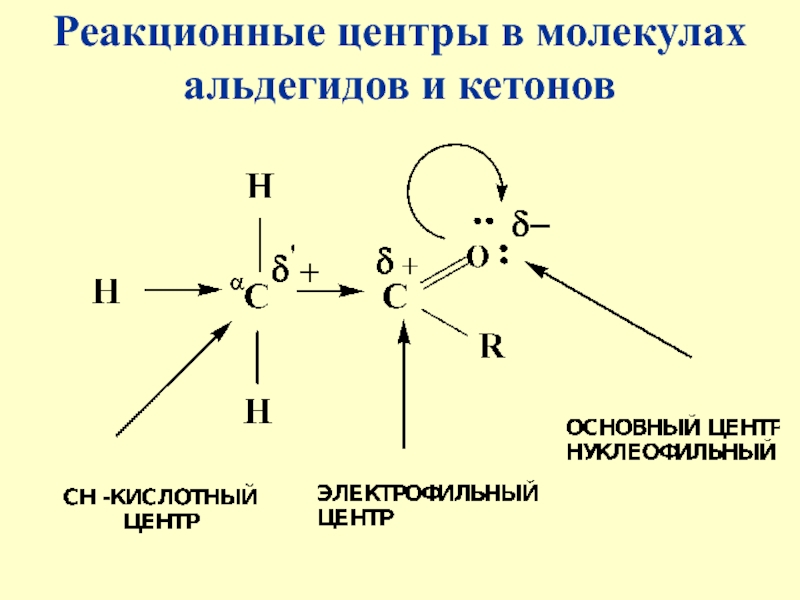
- 12. Реакционные центры в молекулах альдегидов и кетонов
- 13. Атом углерода карбонильной группы является электрофильным центром и представляет собой удобный центр для атаки нуклеофилом
- 14. Легкость нуклеофильной атаки зависит:от величины эффективного положительного
- 15. Уменьшение эффективности положительного зарядаУменьшение склонности к реакциям АN
- 16. Увеличение пространственной затрудненностиЛегче вступают в реакции АN альдегиды, а из них – формальдегид.
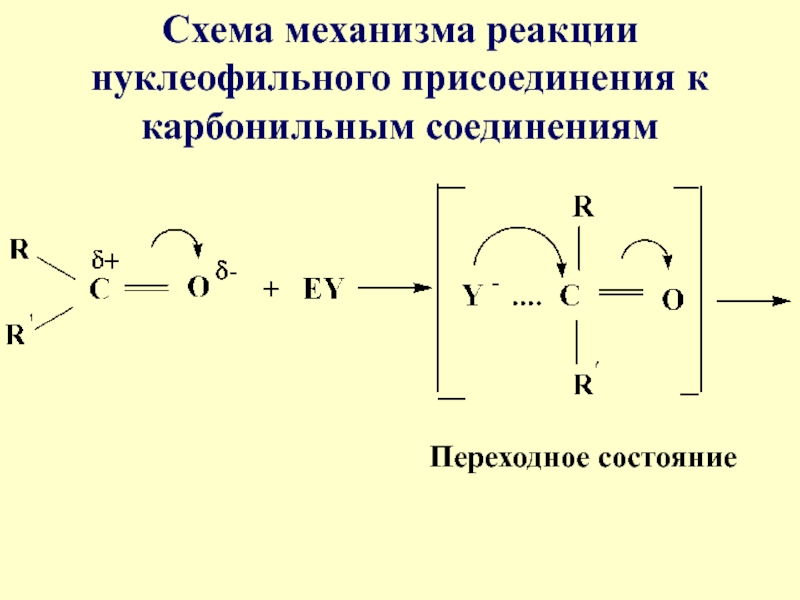
- 17. Схема механизма реакции нуклеофильного присоединения к карбонильным соединениямПереходное состояние
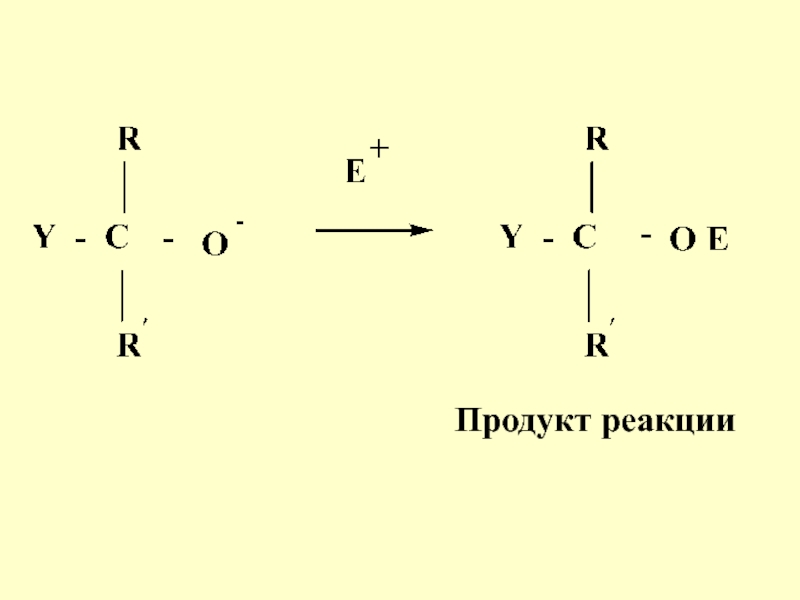
- 18. Продукт реакции
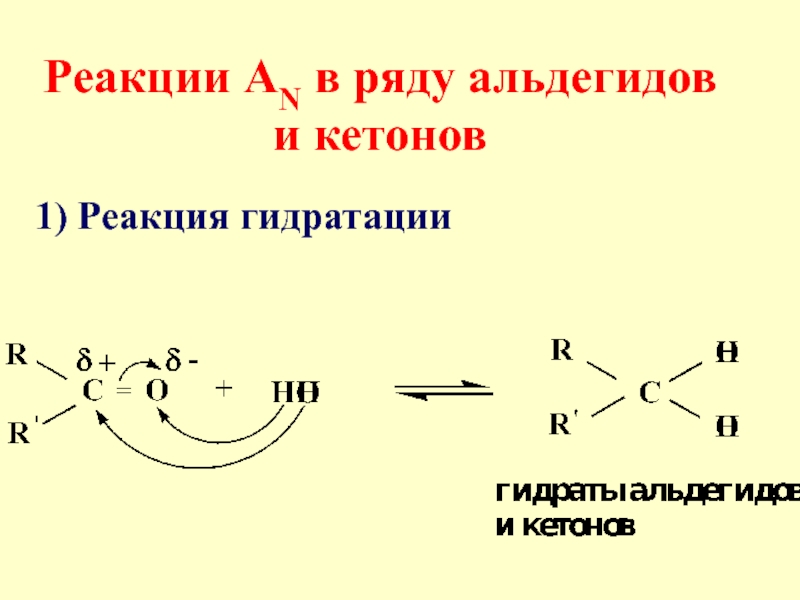
- 19. Реакции АN в ряду альдегидов и кетонов 1) Реакция гидратации
- 20. Гидраты альдегидов и кетонов в свободном виде
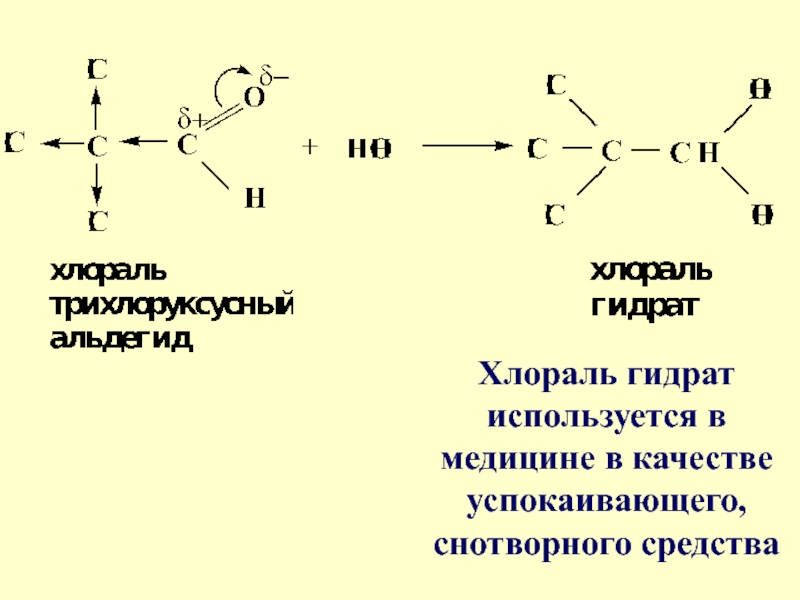
- 21. Хлораль гидрат используется в медицине в качестве успокаивающего, снотворного средства
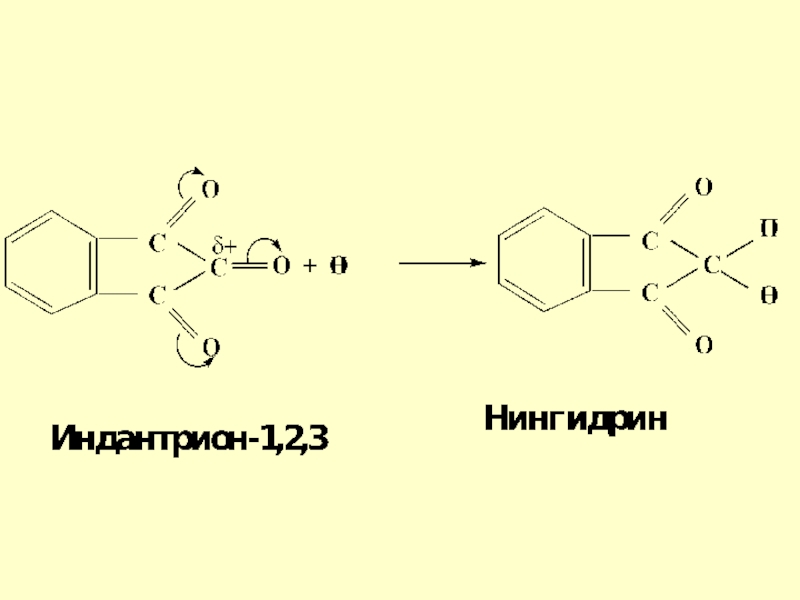
- 22. Возможно образование стабильного гидрата – нингидрина, который
- 23. Слайд 23
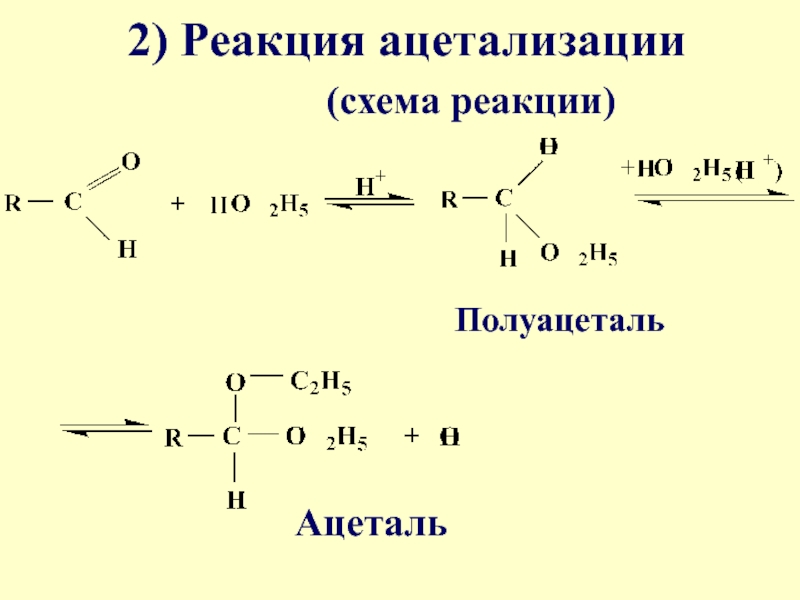
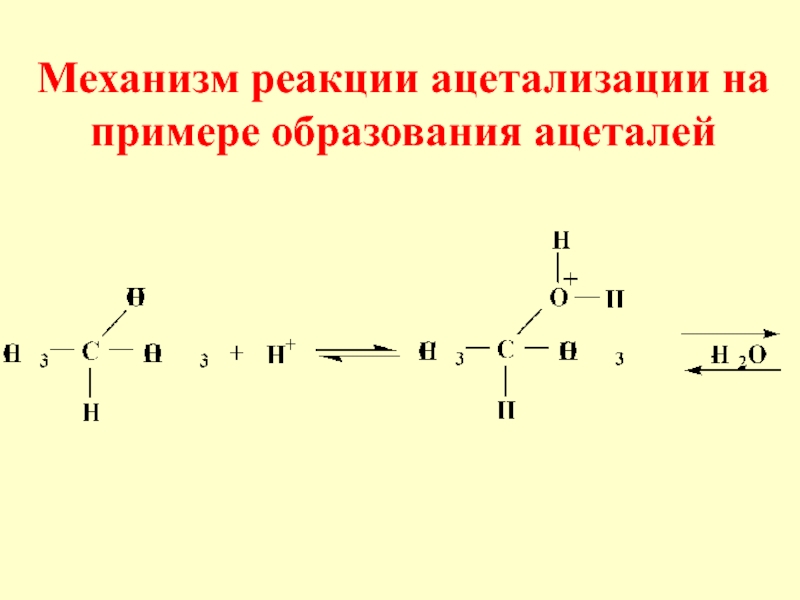
- 24. 2) Реакция ацетализации (схема реакции)ПолуацетальАцеталь
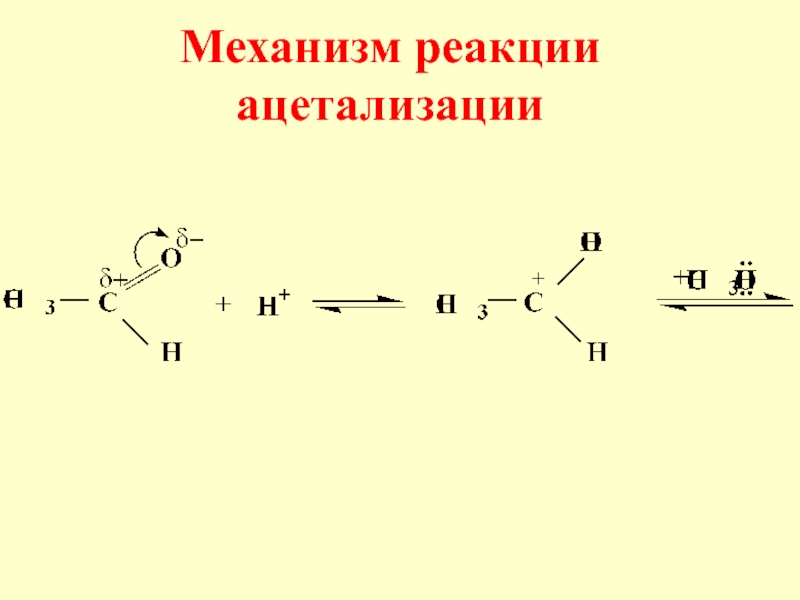
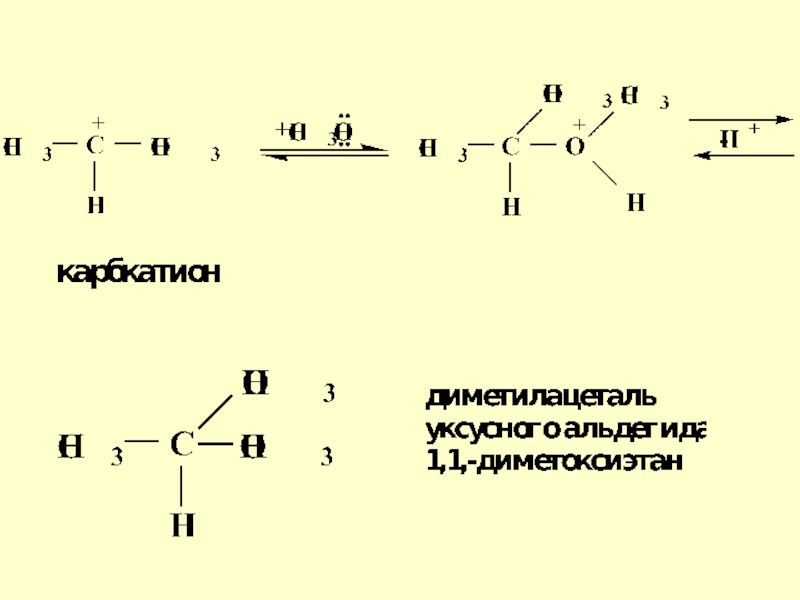
- 25. Механизм реакции ацетализации
- 26. Слайд 26
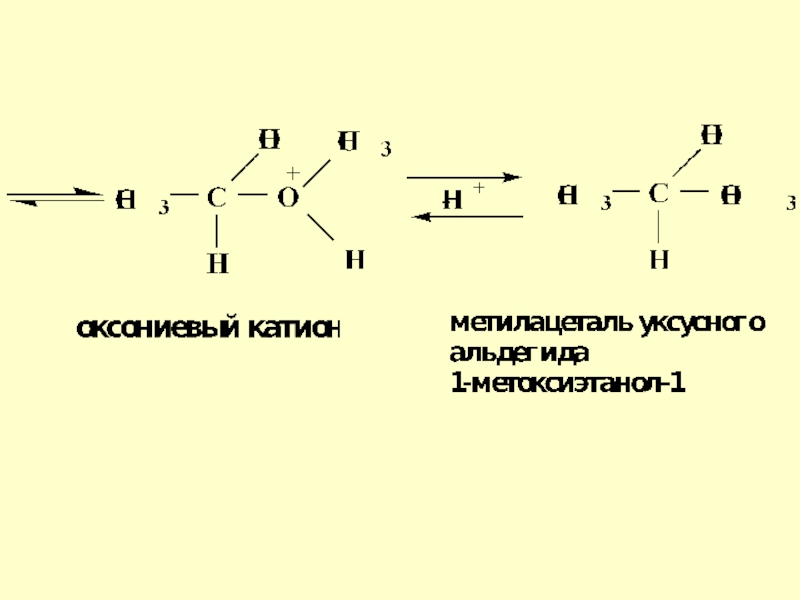
- 27. Механизм реакции ацетализации на примере образования ацеталей
- 28. Слайд 28
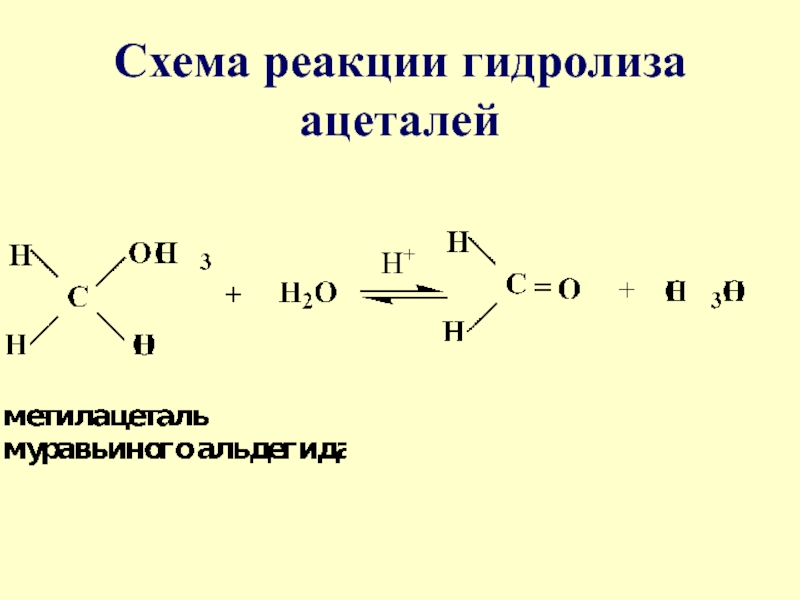
- 29. Схема реакции гидролиза ацеталейН+
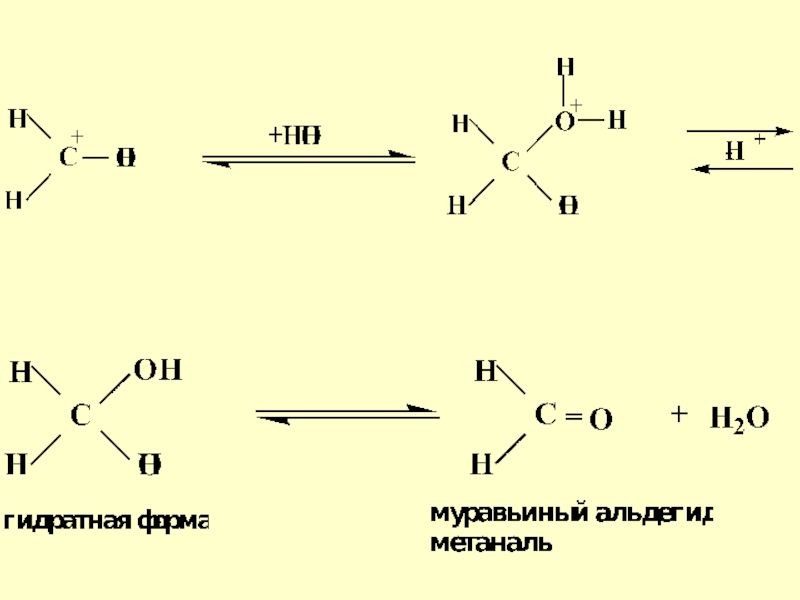
- 30. Механизм реакции гидролиза
- 31. Слайд 31
- 32. Если альдегидная и спиртовая группы находятся в
- 33. Образование циклического полуацеталяЭта реакция имеет большое значение в химии углеводов
- 34. 3) Присоединение тиолов
- 35. 4) Реакции присоединения-отщепления протекают в две стадии
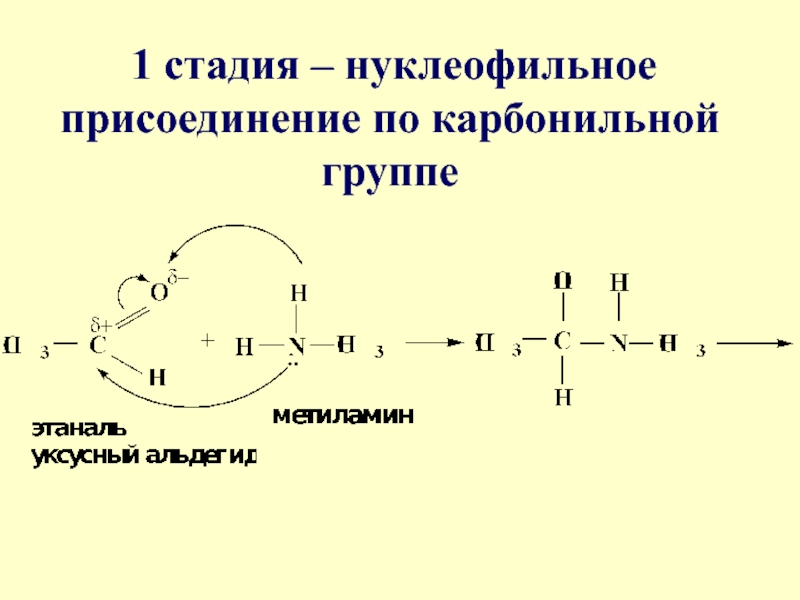
- 36. 1 стадия – нуклеофильное присоединение по карбонильной группе
- 37. 2 стадия – отщепление воды
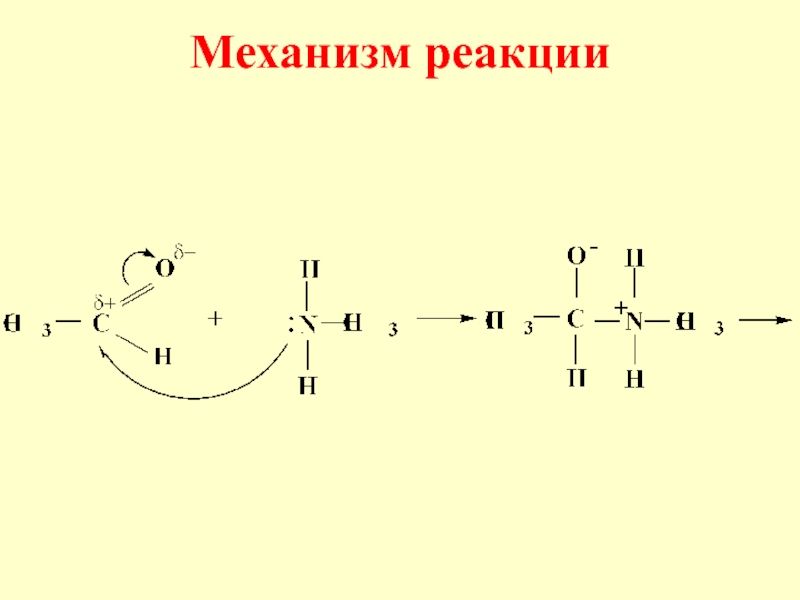
- 38. Механизм реакции
- 39. Слайд 39
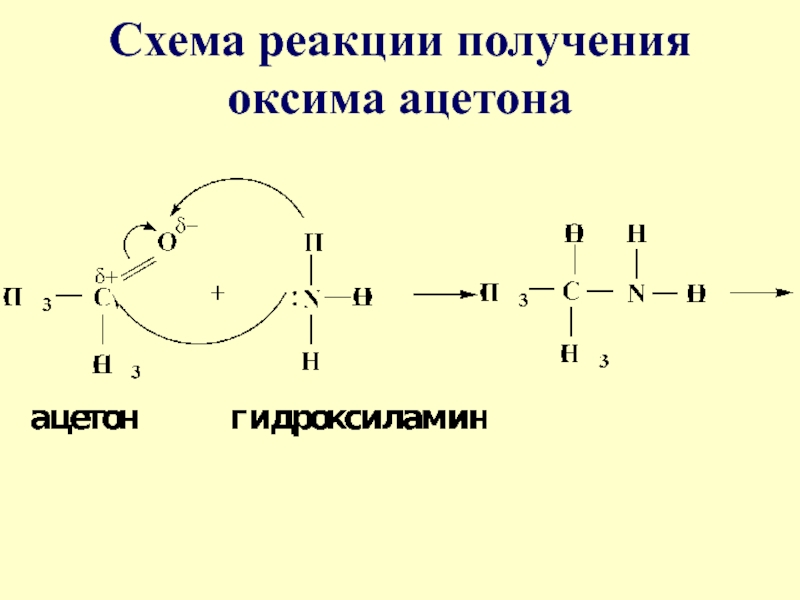
- 40. Аналогично взаимодействуют и производные аминов – гидроксиламин,
- 41. Схема реакции получения оксима ацетона
- 42. Слайд 42
- 43. Схема реакции с фенилгидразином
- 44. Большое значение в биологическом плане имеет реакция
- 45. Имины являются промежуточными продуктами в некоторых ферментативных реакциях, при синтезе аминов из альдегидов и кетонов
- 46. Схема реакции взаимодействия карбонильных соединений с аммиаком in vivo
- 47. Взаимодействие аммиака с альдегидами может осложняться возможной
- 48. Слайд 48
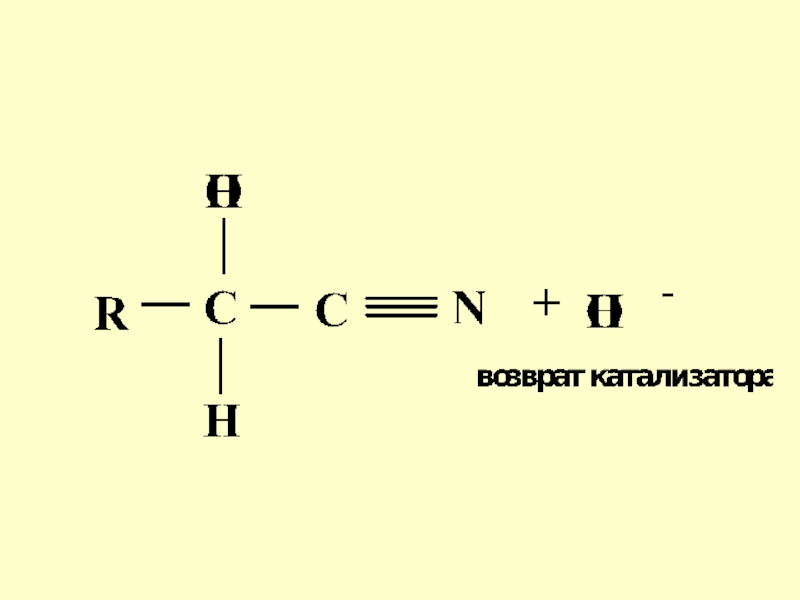
- 49. 5) Реакция присоединения синильной кислоты (НСN)
- 50. Механизм реакции
- 51. Слайд 51
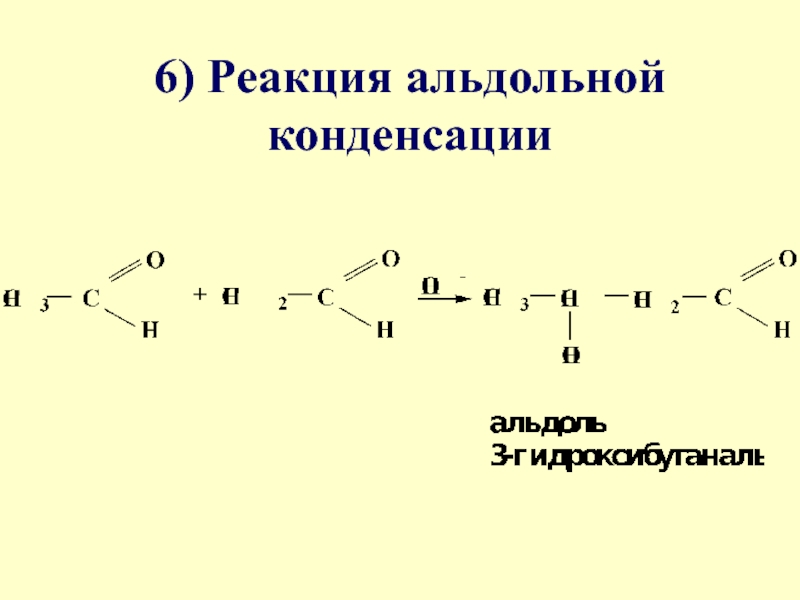
- 52. 6) Реакция альдольной конденсации
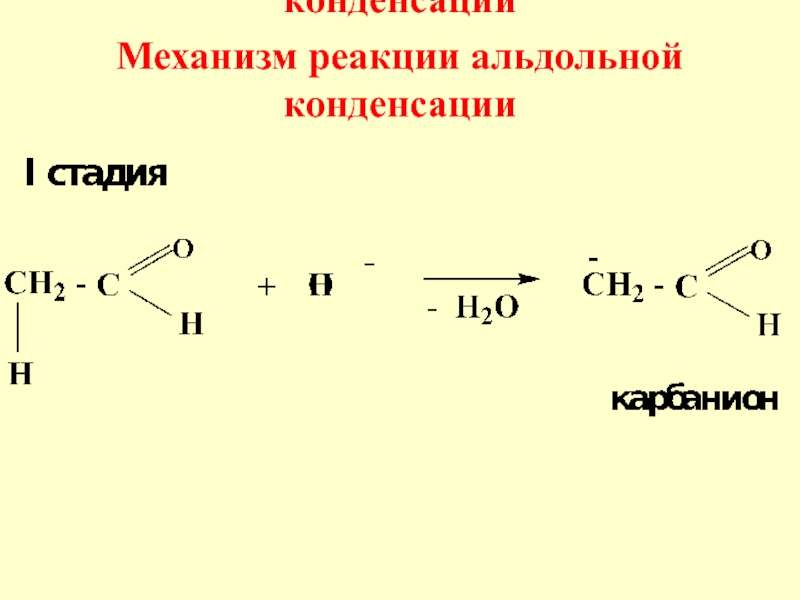
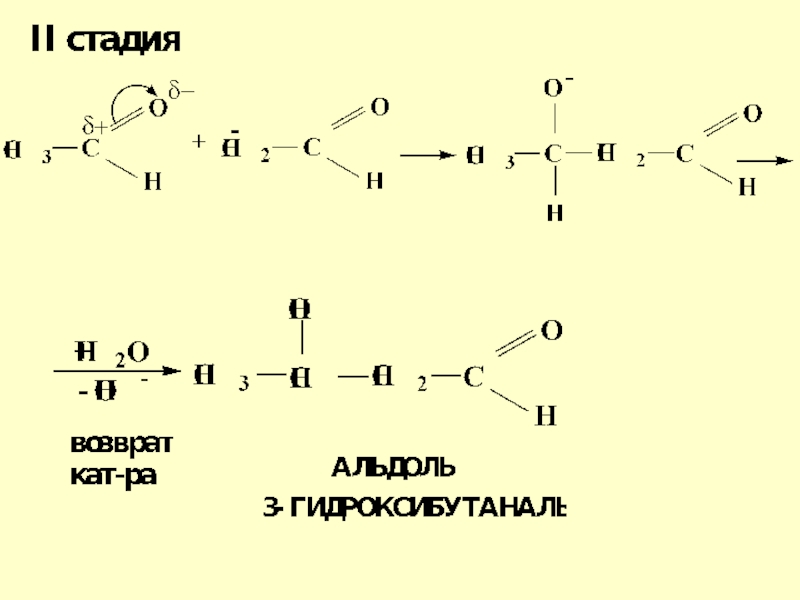
- 53. Механизм реакции альдольной конденсацииМеханизм реакции альдольной конденсации
- 54. Слайд 54
- 55. Реакция альдольной конденсации часто сопровождается дальнейшим отщеплением
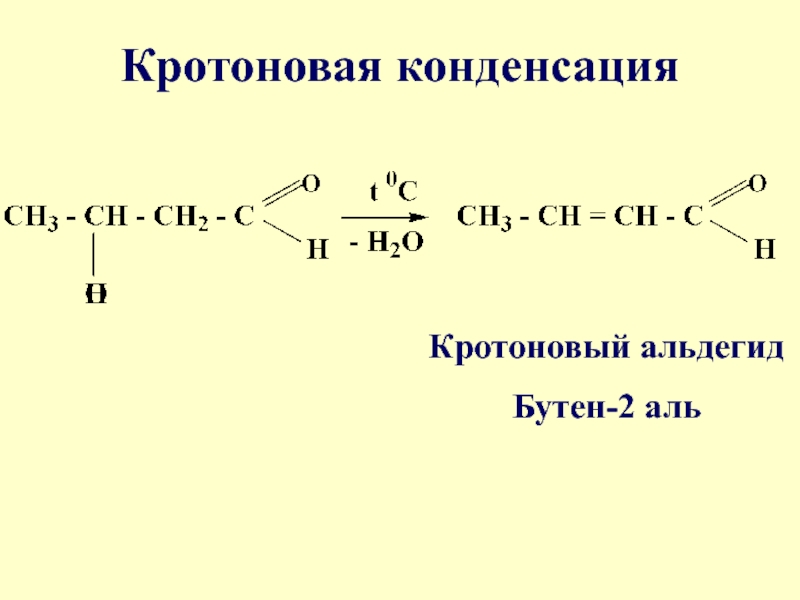
- 56. Кротоновая конденсацияКротоновый альдегидБутен-2 аль
- 57. Реакция альдольной конденсации возможна только для тех
- 58. В реакцию альдольной конденсации могут вступать также две молекулы различных альдегидов, кетонов
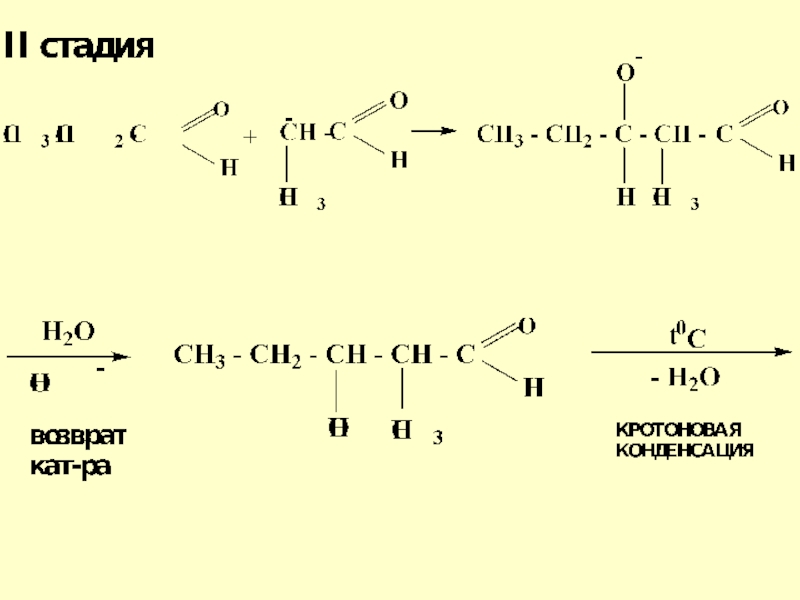
- 59. Реакция альдольной конденсации пропионового альдегида3-гидрокси-2-метилпентаналь
- 60. Механизм реакции альдольной конденсации
- 61. Слайд 61
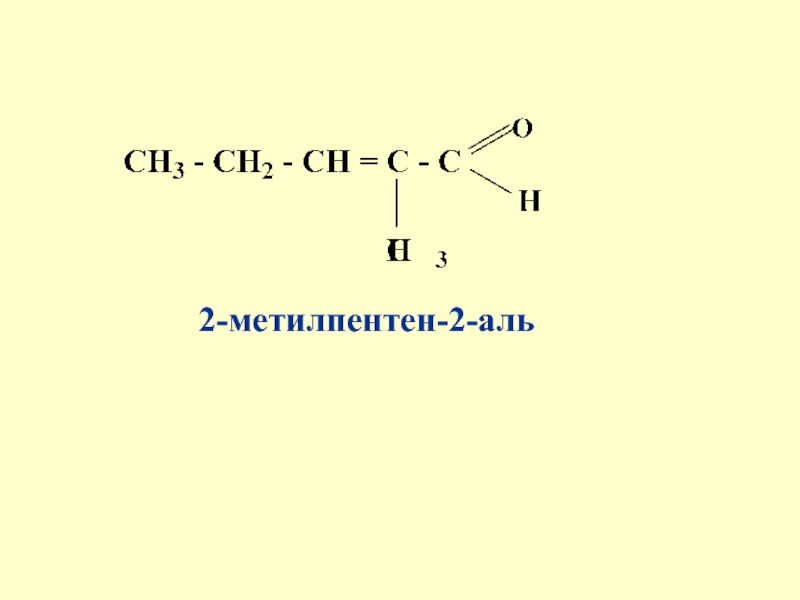
- 62. 2-метилпентен-2-аль
- 63. Реакция альдольной конденсации, а также обратная ей
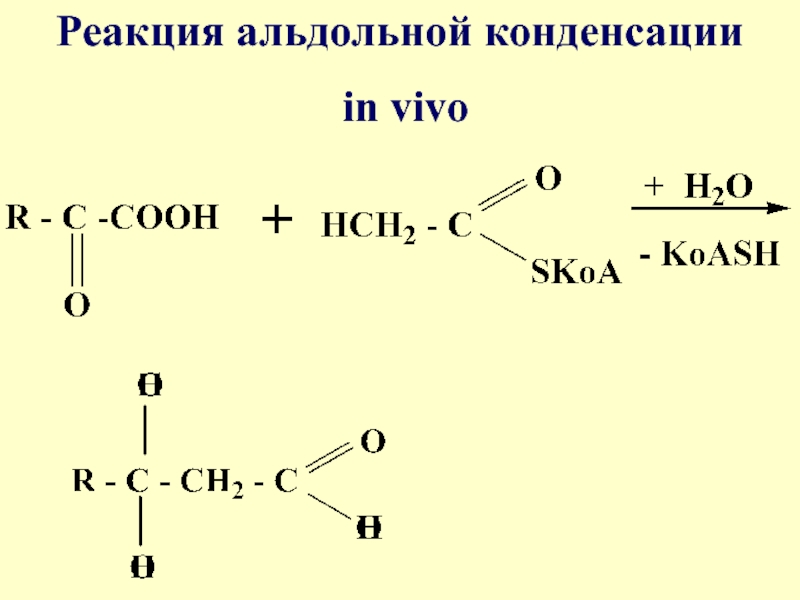
- 64. Реакция альдольной конденсации in vivo
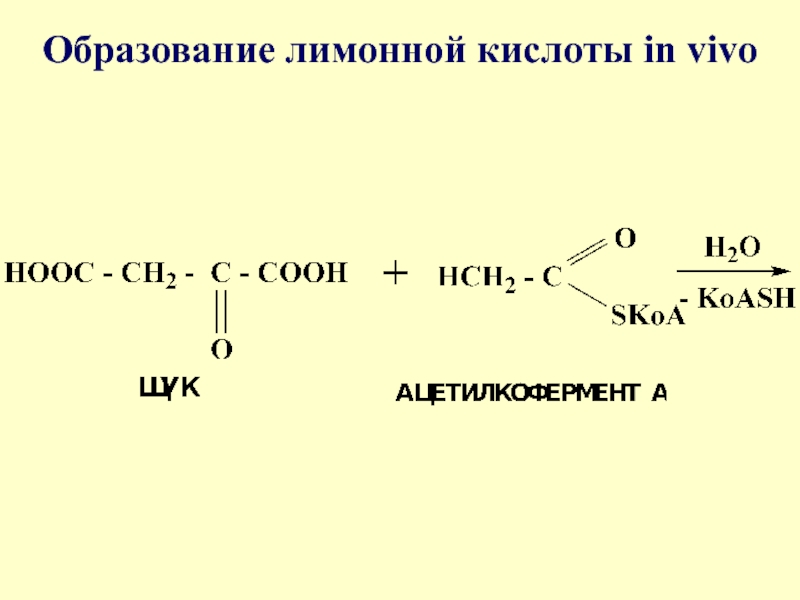
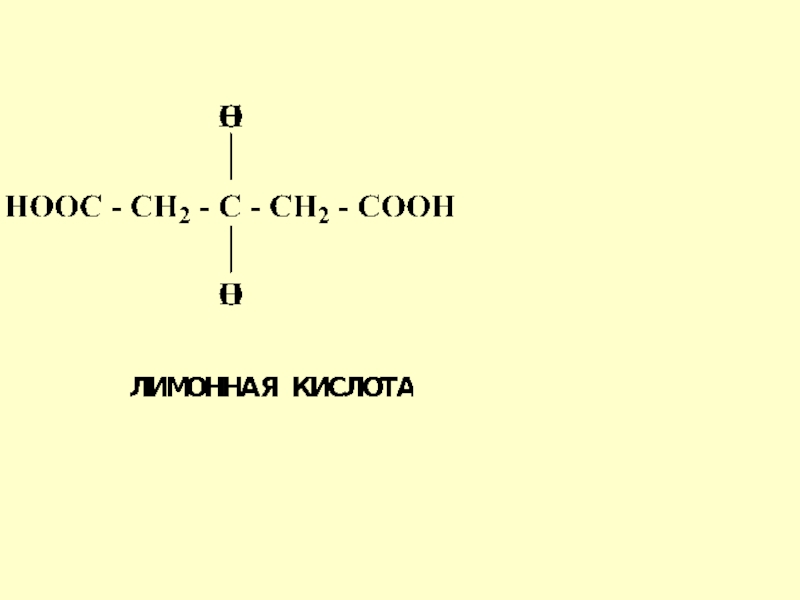
- 65. Образование лимонной кислоты in vivo
- 66. Слайд 66
- 67. Альдольная конденсация протекает в клетках растений в
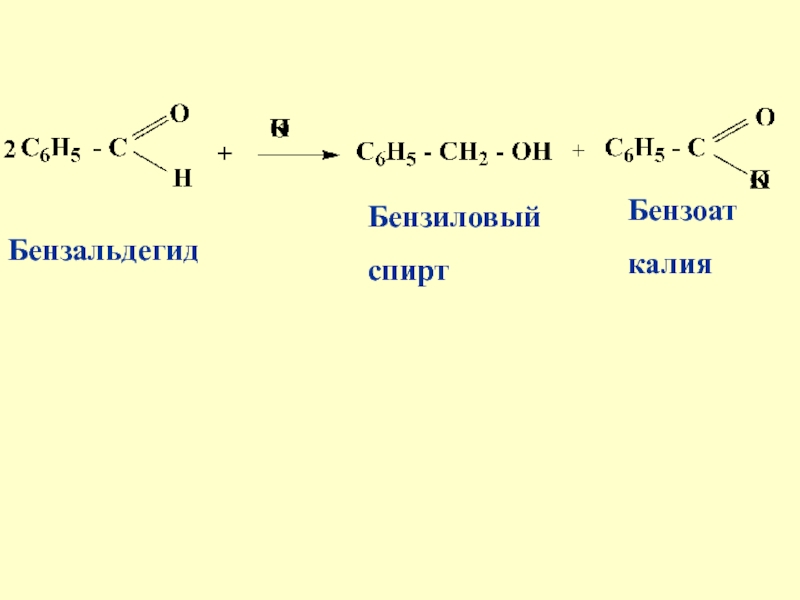
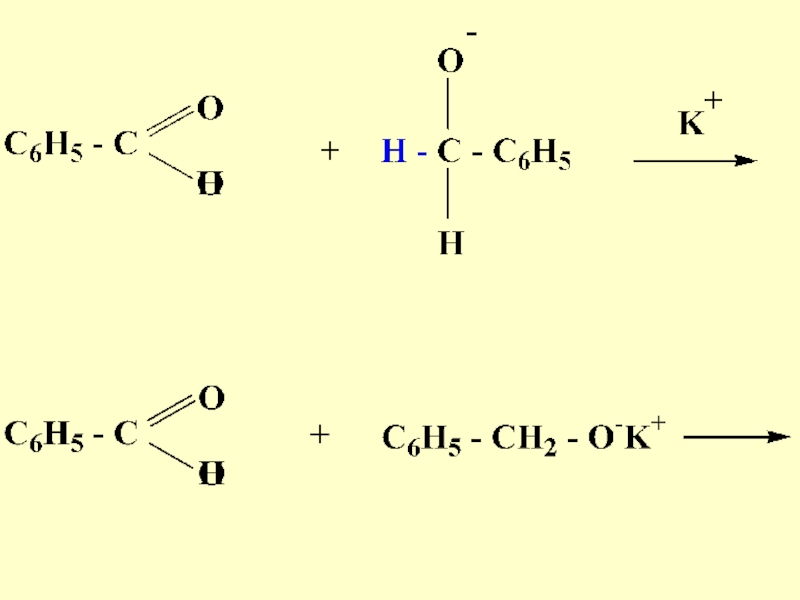
- 68. 7) Реакция
- 69. БензальдегидБензиловыйспиртБензоаткалия
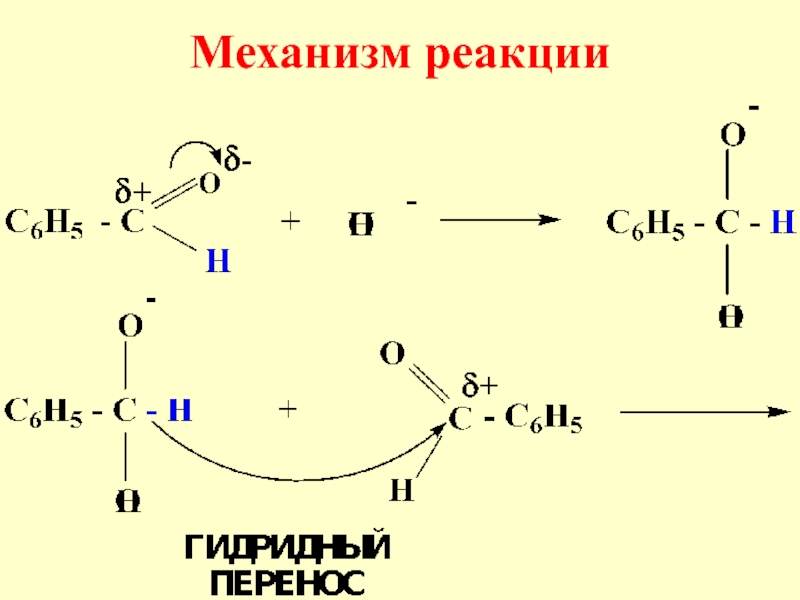
- 70. Механизм реакции
- 71. Слайд 71
- 72. Слайд 72
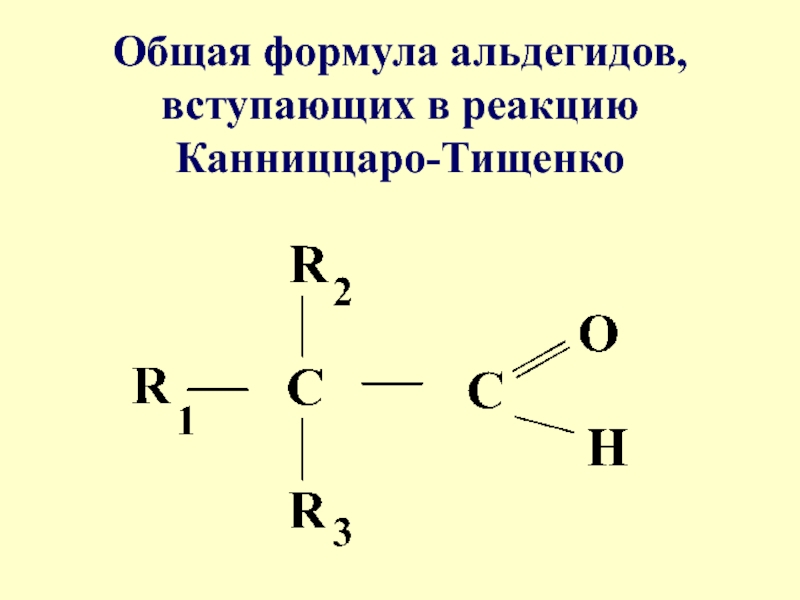
- 73. В реакцию Канниццаро-Тищенко вступают альдегиды, не имеющие
- 74. Общая формула альдегидов, вступающих в реакцию Канниццаро-Тищенко
- 75. Спасибо за внимание
- 76. Скачать презентанцию
План8.1. Общая характеристика оксосоединений (карбонильных соединений)8.2. Реакции нуклеофильного присоединения в ряду альдегидов и кетонов8.3. Реакции окисления и восстановления органических соединений
Слайды и текст этой презентации
Слайд 1Лекция 8
Реакции нуклеофильного присоединения у sp2- гибридного атома
углерода биологически важных карбонильных соединений
Слайд 2План
8.1. Общая характеристика оксосоединений (карбонильных соединений)
8.2. Реакции нуклеофильного присоединения в
ряду альдегидов и кетонов
8.3. Реакции окисления и восстановления органических соединений
Слайд 38.1. Общая характеристика оксосоединений
К карбонильным соединениям относят соединения, содержащие карбонильную
группу:
альдегиды, кетоны, карбоновые кислоты
Слайд 5
Классификация альдегидов
Предельные альдегиды
Метаналь, муравьиный альдегид, формальдегид
Этаналь, уксусный альдегид,
ацетальдегид
Слайд 11Смешанные жирноароматические и ароматические кетоны
Смешанные жирноароматические и ароматические кетоны
Дифенилкетон
Метилфенил кетон,
ацетофенон
Слайд 13Атом углерода карбонильной группы является электрофильным центром и представляет собой
удобный центр для атаки нуклеофилом
Слайд 14Легкость нуклеофильной атаки зависит:
от величины эффективного положительного заряда на карбонильном
атоме углерода
от пространственной доступности атома углерода в карбонильной группе
от кислотно-основных свойств средыСлайд 16Увеличение пространственной затрудненности
Легче вступают в реакции АN альдегиды, а из
них – формальдегид.
Слайд 17Схема механизма реакции нуклеофильного присоединения к карбонильным соединениям
Переходное состояние
Слайд 20Гидраты альдегидов и кетонов в свободном виде выделить, как правило,
не удается, т.к. равновесие этой реакции сдвинуто влево. Однако трихлоруксусный
альдегид можно прогидратироватьСлайд 22Возможно образование стабильного гидрата – нингидрина, который используется для обнаружения
аминокислот, пептидов, белков в медико-биологических исследованиях
Слайд 32Если альдегидная и спиртовая группы находятся в одной молекуле, то
за счет внутримолекулярной реакции может образоваться циклический полуацеталь
Слайд 40Аналогично взаимодействуют и производные аминов – гидроксиламин, гидразин, фенилгидразины и
т.д. Одной из качественных реакций на ацетон является образование оксима
ацетонаСлайд 44Большое значение в биологическом плане имеет реакция карбонильных соединений (альдегидов
и кетонов) с аммиаком, при этом образуются имины (основания Шиффа),
неустойчивые, легкогидролизующиеся соединенияСлайд 45Имины являются промежуточными продуктами в некоторых ферментативных реакциях, при синтезе
аминов из альдегидов и кетонов
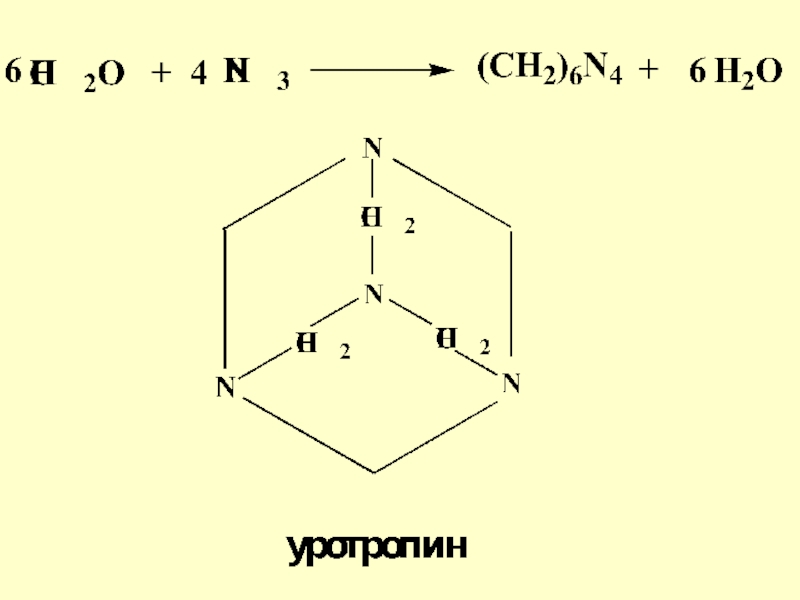
Слайд 47Взаимодействие аммиака с альдегидами может осложняться возможной циклизацией. Так, из
формальдегида А.М. Бутлеров впервые получил медицинский препарат – гексаметилентетраамин (уротропин),
широко применяется в качестве антисептического средстваСлайд 55Реакция альдольной конденсации часто сопровождается дальнейшим отщеплением молекулы воды с
образованием α,β-ненасыщенных карбонильных соединений (устойчивые сопряженные системы). Эта конденсация получила
названиекротоновой конденсации