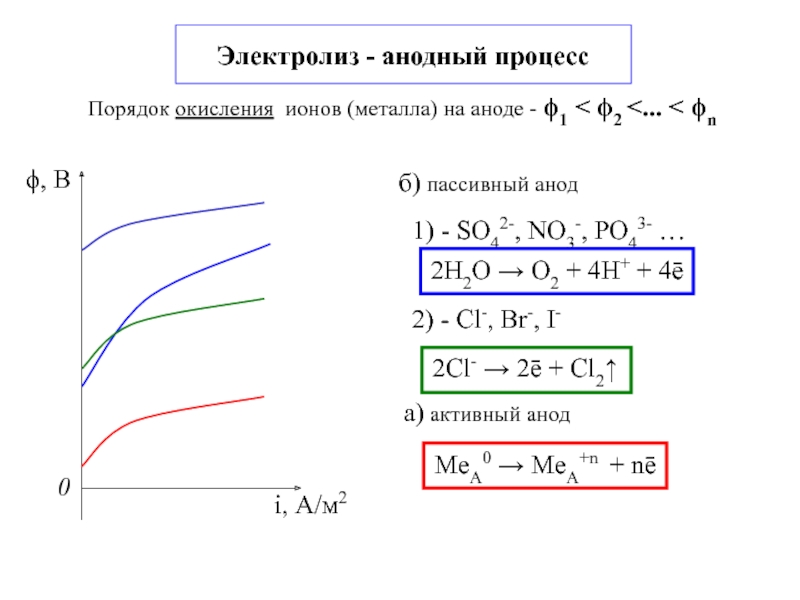
электроды(электронн.проводим.)
окисление - анод
восстановление - катод
2- электролиты(ионная проводим.)
3 - внешняя цепь
5
- внутренняя цепь4 – проводник электрического тока
или внешний источник тока
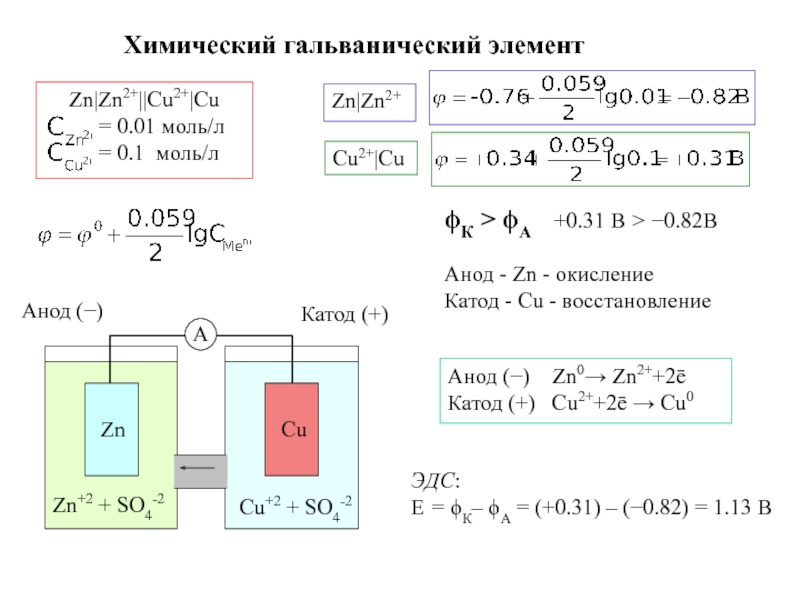
Zn|ZnSO4||CuSO4|Cu
Zn|Zn+2||Cu+2|Cu
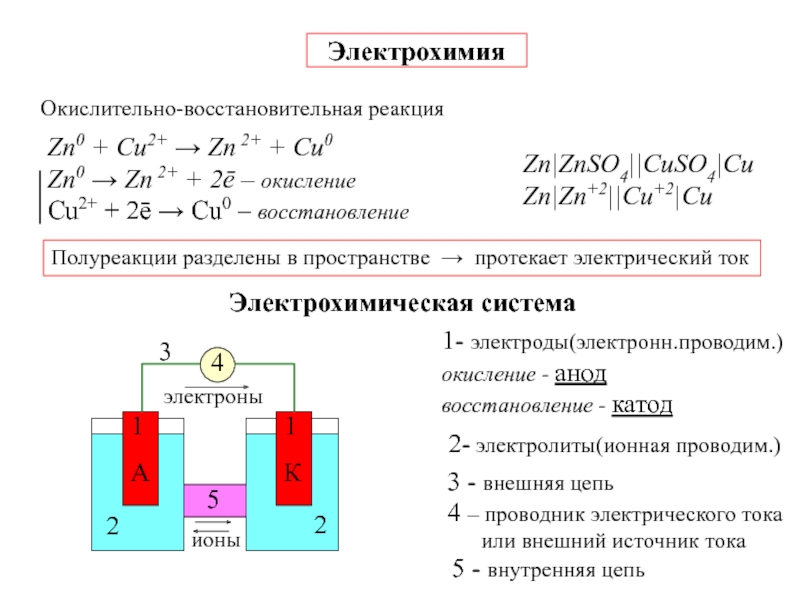

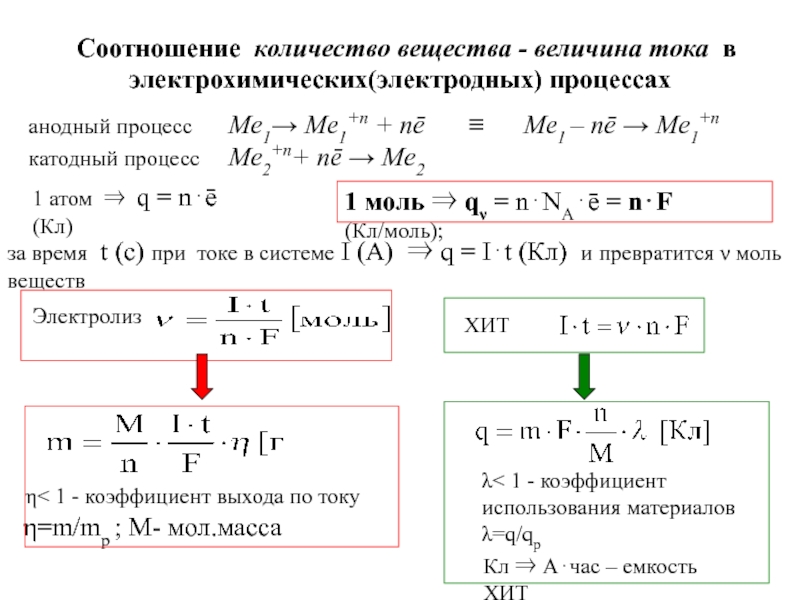
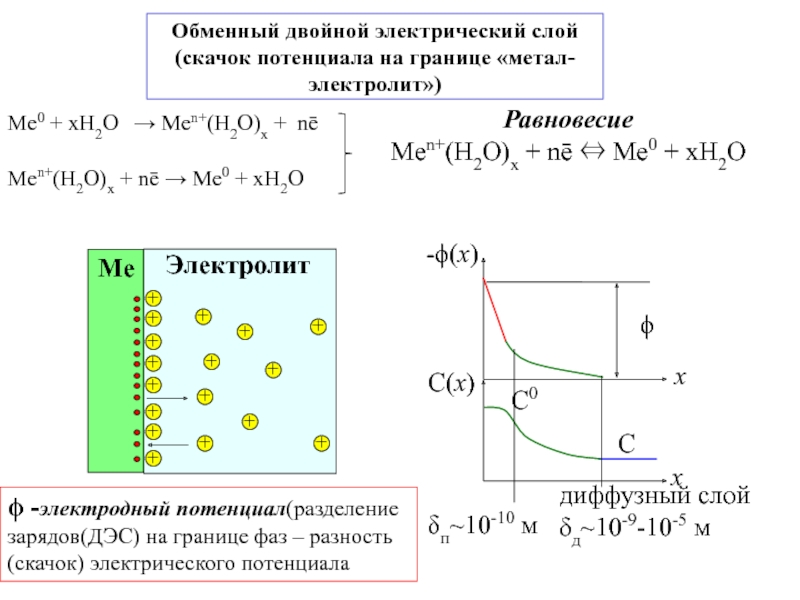
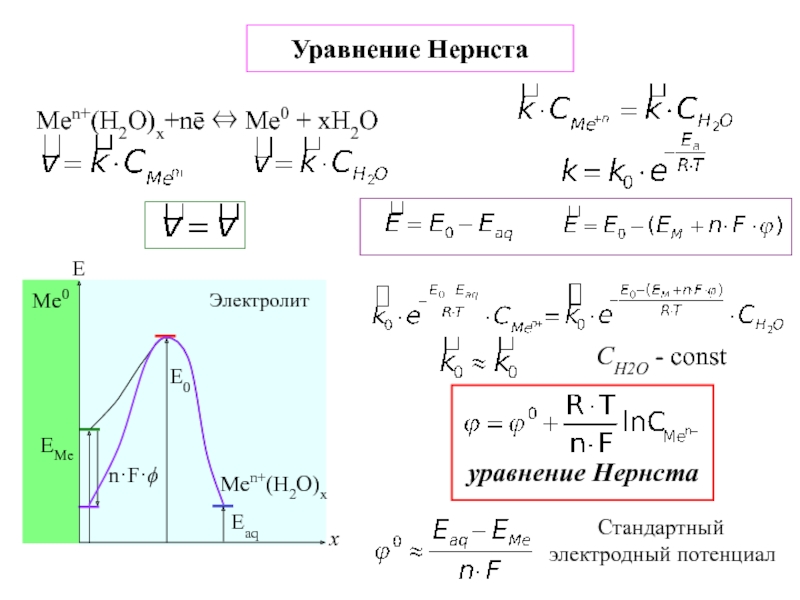
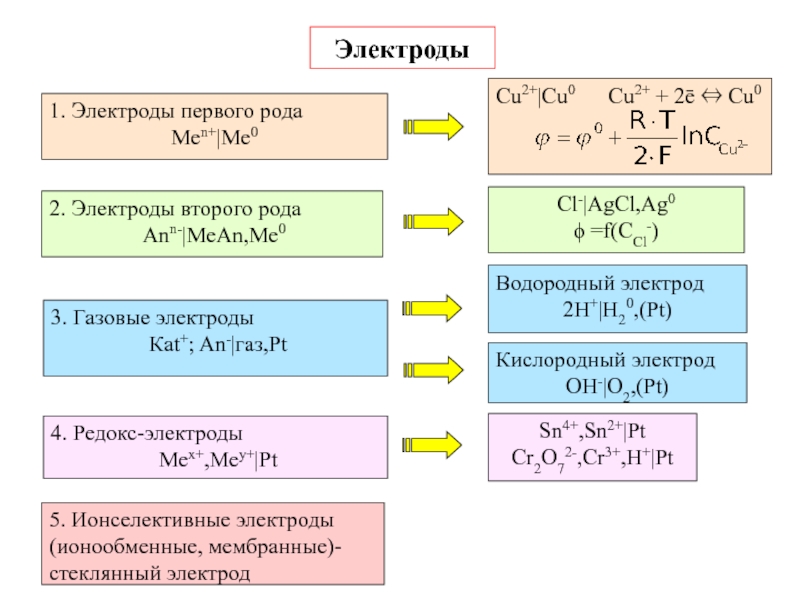
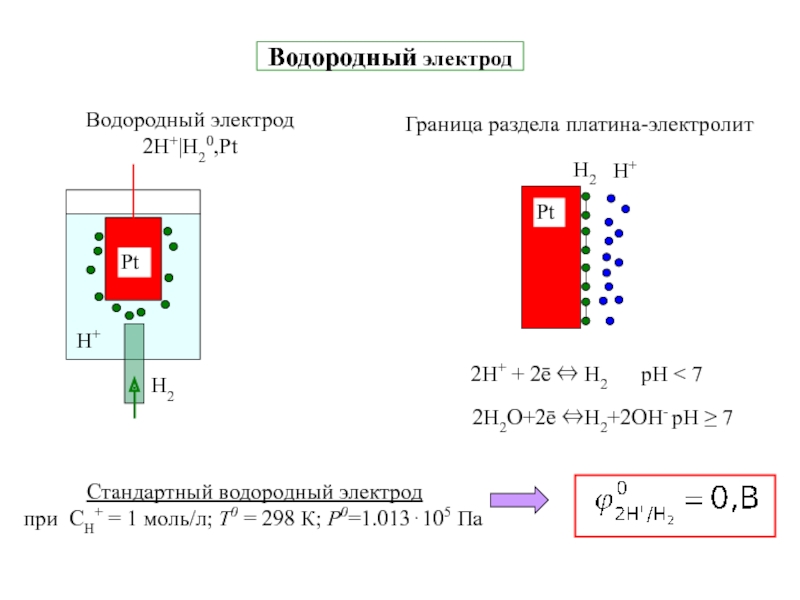

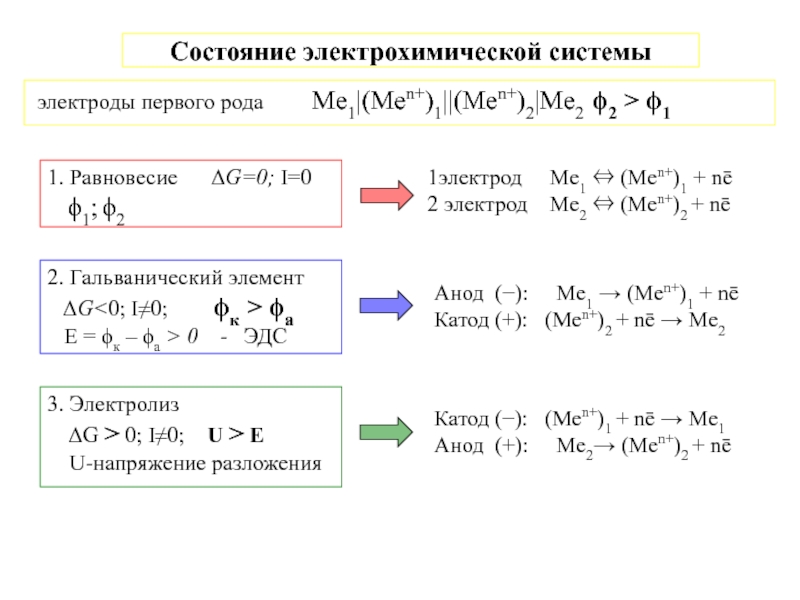

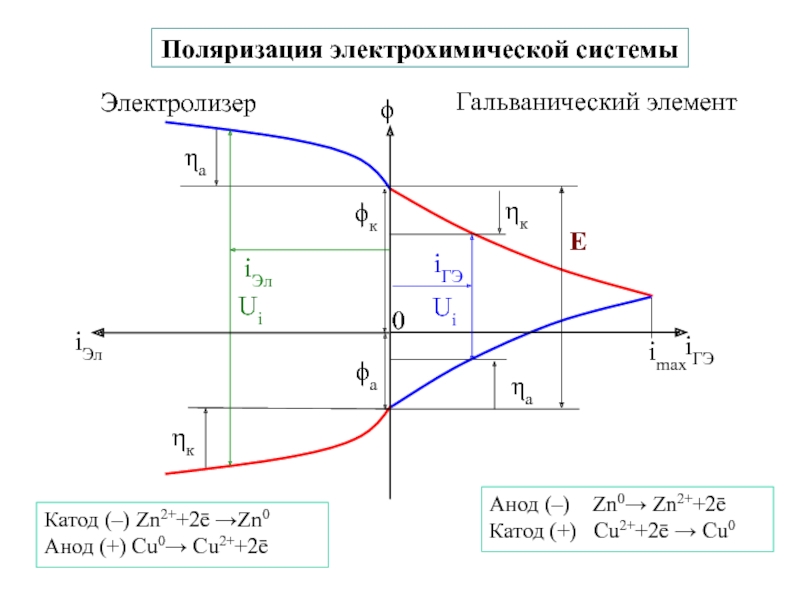
![7-ЭЛЕКТРОХИМИЯ.ppt Поляризация электродов – [η] (сближение потенциалов катода и анода) при работе Поляризация электродов – [η] (сближение потенциалов катода и анода) при работе ГЭ= ϕI − ϕ явл.[f(i)]Поляризация-разность потенциалов](/img/thumbs/b02ddbab7a46aa461e62e927599e2812-800x.jpg)