Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 3 Состав природных и сточных вод.ppt
Содержание
- 1. 1 3 Состав природных и сточных вод.ppt
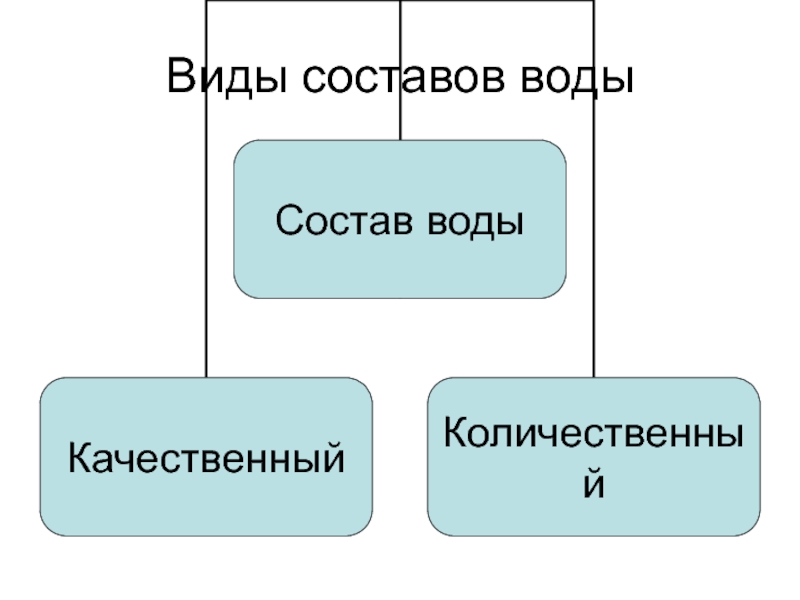
- 2. Виды составов воды
- 3. Качественный составПоказывает какие вещества находятся в сточной воде без количественной оценки их содержания
- 4. Количественный составУказывает какие вещества содержатся в сточной воде и в каких количествах (концентрациях)
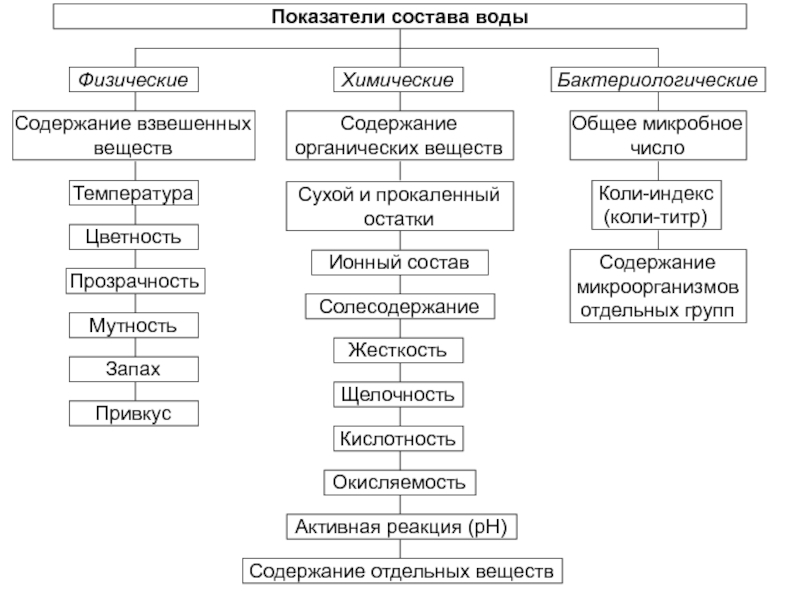
- 5. Показатели состава водыФизическиеБактериологическиеСодержание взвешенных веществТемператураЦветностьПрозрачностьМутностьЗапахПривкусСодержание отдельных веществОбщее микробное числоКоли-индекс (коли-титр)Содержание микроорганизмов отдельных групп
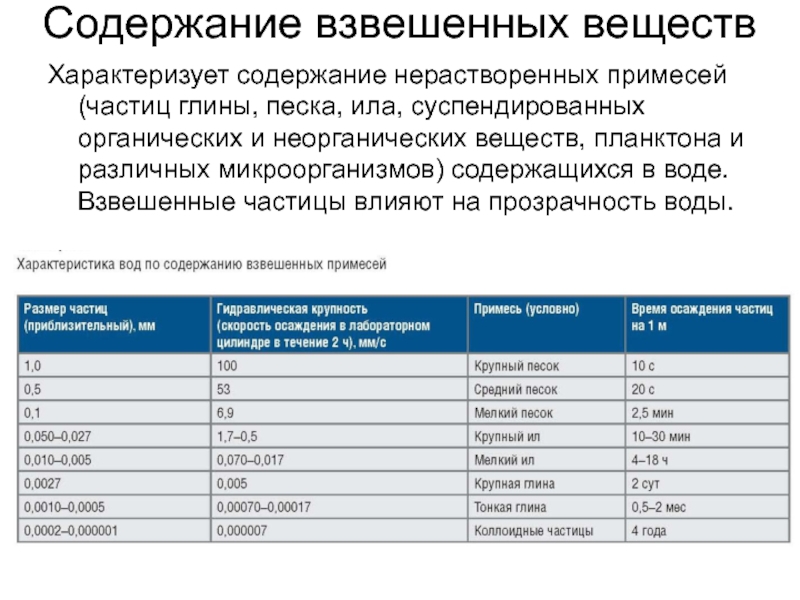
- 6. Содержание взвешенных веществХарактеризует содержание нерастворенных примесей (частиц
- 7. МутностьМутность воды вызвана присутствием тонкодисперсных примесей, обусловленных
- 8. ПрозрачностьСтепень прозрачности часто используют для измерения содержания
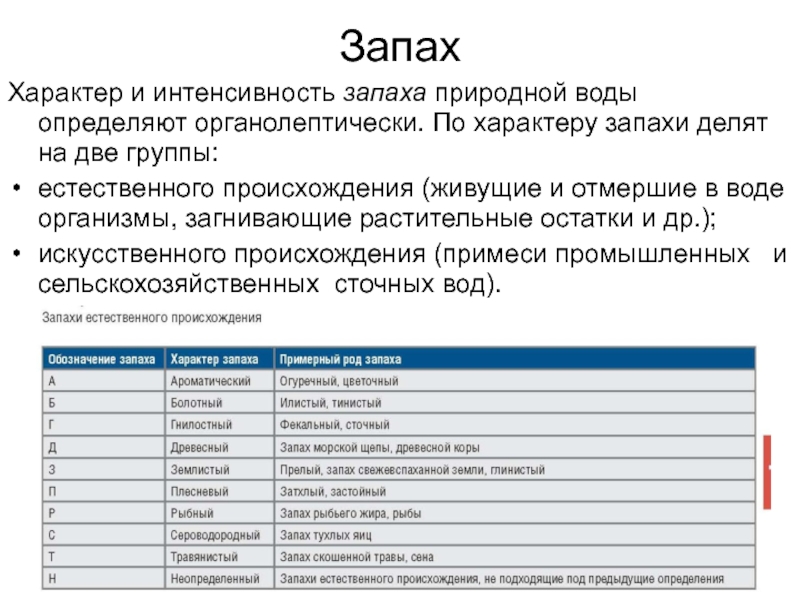
- 9. ЗапахХарактер и интенсивность запаха природной воды определяют
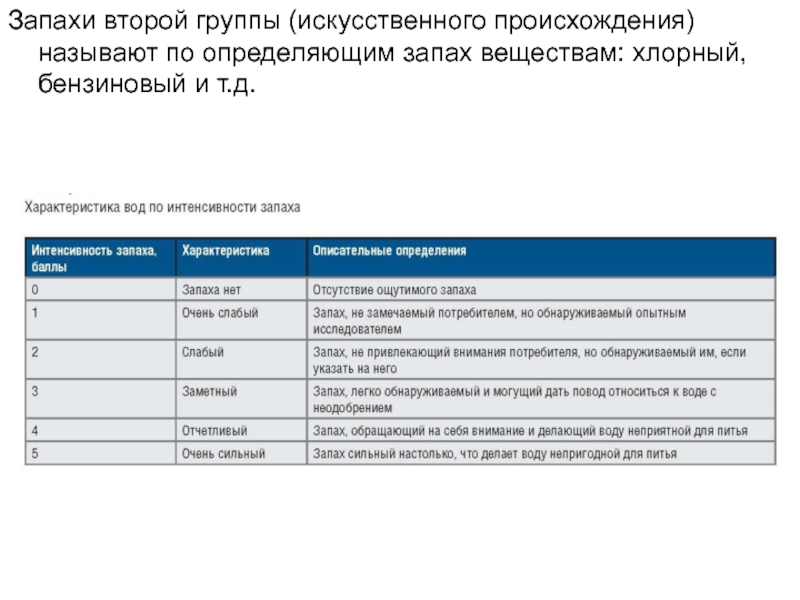
- 10. Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
- 11. ПривкусРазличают четыре вида вкусов: соленый, горький, сладкий,
- 12. Слайд 12
- 13. ЦветностьПоказатель качества воды, характеризующий интенсивность окраски воды
- 14. Содержание органических веществСпектр органических примесей очень широк:группа
- 15. Содержание органических веществ в воде оценивается по
- 16. Окислители могут действовать и на неорганические примеси,
- 17. Окисляемость перманганатная измеряется мгО/л, если учитывается масса
- 18. Слайд 18
- 19. ХПК - количество кислорода (или окислителя в
- 20. БПК - количество кислорода в мг/л, требуемое
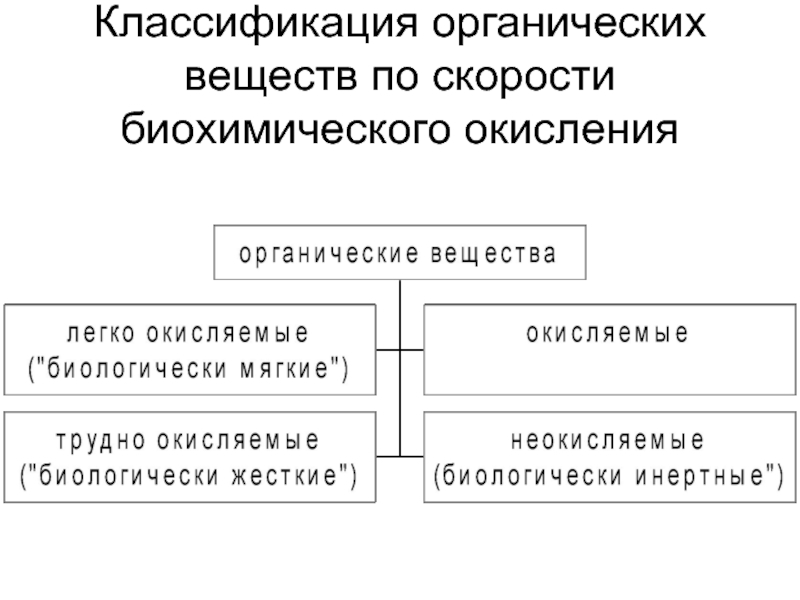
- 21. Классификация органических веществ по скорости биохимического окисления
- 22. Зависимость БПК от продолжительности экспозиции
- 23. Слайд 23
- 24. Общий органический углеродСодержание общего органического углерода (ООУ,
- 25. Сухой и прокаленный остатокСухой остаток характеризует количество
- 26. суммарное содержание всех найденных при химическом анализе
- 27. Слайд 27
- 28. Электропроводимость - это численное выражение способности водного
- 29. ЖесткостьЖесткость воды обусловливается наличием в воде ионов
- 30. По стандарту ИСО 6107-1-8:1996, включающему более 500
- 31. Слайд 31
- 32. Растворенный кислородПоступление кислорода в водоем происходит путем
- 33. Скачать презентанцию
Виды составов воды
Слайды и текст этой презентации
Слайд 3Качественный состав
Показывает какие вещества находятся в сточной воде без количественной
оценки их содержания
Слайд 4Количественный состав
Указывает какие вещества содержатся в сточной воде и в
каких количествах (концентрациях)
Слайд 5Показатели состава воды
Физические
Бактериологические
Содержание взвешенных веществ
Температура
Цветность
Прозрачность
Мутность
Запах
Привкус
Содержание отдельных веществ
Общее микробное число
Коли-индекс (коли-титр)
Содержание
микроорганизмов отдельных групп
Слайд 6Содержание взвешенных веществ
Характеризует содержание нерастворенных примесей (частиц глины, песка, ила,
суспендированных органических и неорганических веществ, планктона и различных микроорганизмов) содержащихся
в воде. Взвешенные частицы влияют на прозрачность воды.Слайд 7Мутность
Мутность воды вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными
неорганическими и органическими веществами различного происхождения. Качественное определение проводят описательно:
мутность не заметна (отсутствует), слабая опалесценция, опалесценция, слабомутная, мутная и сильная муть.В России мутность чаще всего измеряют в нефелометрических единицах мутности НЕФ (NTU) для небольших значений в пределах 0-40 НЕФ (NTU), например для питьевой воды. В условиях большой мутности обычно применяется измерение единиц мутности по формазину (ЕМФ). Пределы измерений - 40-400 ЕМФ.
Индикатор по НЕФ (NTU) - рассеивание излучения, по ЕМФ - ослабление потока излучения.
Слайд 8Прозрачность
Степень прозрачности часто используют для измерения содержания определённых видов примесей
и эффективности очистки. Прозрачность выражается толщиной слоя воды (см), через
который ещё возможно чтение стандартного шрифта (прозрачность по Снеллену) или различение креста.Слайд 9Запах
Характер и интенсивность запаха природной воды определяют органолептически. По характеру
запахи делят на две группы:
естественного происхождения (живущие и отмершие в
воде организмы, загнивающие растительные остатки и др.);искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Слайд 10Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам:
хлорный, бензиновый и т.д.
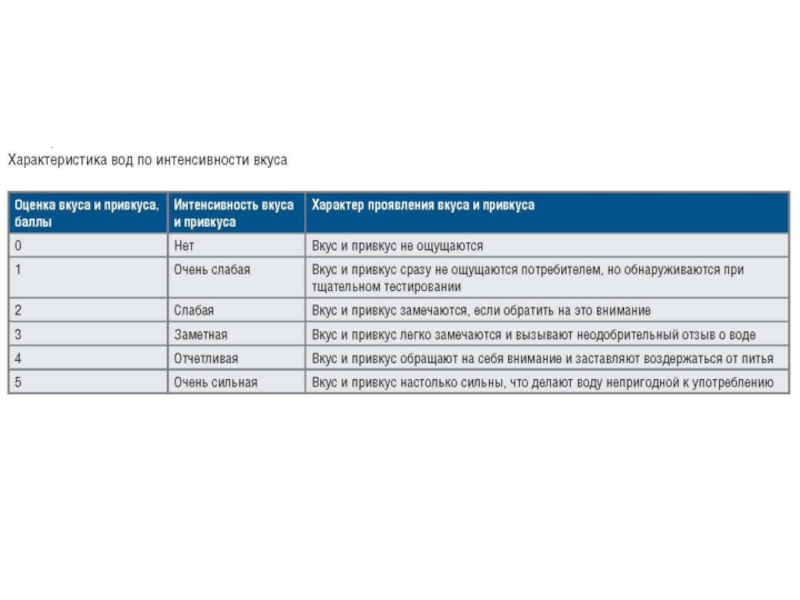
Слайд 11Привкус
Различают четыре вида вкусов: соленый, горький, сладкий, кислый.
Качественную характеристику оттенков
вкусовых ощущений - привкуса - выражают описательно: хлорный, рыбный, горьковатый
и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький - сульфатом магния, кислый - избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCI - 165; CaCl2 - 470; MgCI2 - 135; MnCI2 - 1,8; FeCI2 - 0,35; MgSO4 - 250; CaSO4 - 70; MnSO4 - 15,7; FeSO4 - 1,6; NaHCO3 - 450.По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
катионы: NH4+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
анионы: ОН- > NO3- > CI- > HCO3- > SO42- .
Слайд 13Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием
окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем
сравнения окраски испытуемой воды с эталонами.Цветность природных вод обусловлена главным образом присутствием гумусовых веществ и соединений трехвалентного железа, колеблется от единиц до тысяч градусов
Слайд 14Содержание органических веществ
Спектр органических примесей очень широк:
группа растворенных примесей:
гуминовые кислоты
и их соли - гуматы натрия, калия, аммония;
некоторые примеси промышленного
происхождения;часть аминокислот и белков;
группа нерастворенных примесей:
фульвокислоты (соли) и гуминовые кислоты и их соли - гуматы кальция, магния, железа;
жиры различного происхождения;
частицы различного происхождения, в том числе микроорганизмы.
Слайд 15Содержание органических веществ в воде оценивается по методикам определения окисляемости
воды, содержания органического углерода, биохимической потребности в кислороде, а также
поглощения в ультрафиолетовой области.Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая (методики определения двух последних применяются редко). Окисляемость выражается в миллиграммах кислорода, эквивалентного количеству реагента, пошедшего на окисление органических веществ, содержащихся в 1 л воды.
Слайд 16Окислители могут действовать и на неорганические примеси, например, на ионы
Fe2+, S2-, NO-2 , но соотношение между этими ионами и
органическими примесями в поверхностных водах существенно сдвинуто в сторону органических примесей, то есть «органики» в решающей степени больше.В подземных водах (артезианских) это соотношение - обратное, то есть органических примесей гораздо меньше, чем указанных ионов. Практически их совсем нет. К тому же неорганические примеси могут определяться непосредственно индивидуально.
Если содержание указанных восстановителей суммарно меньше 0,1 ммоль/л, то ими можно пренебречь, в иных случаях нужно вносить соответствующие поправки.
Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость (перманганатный индекс); в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
Слайд 17Окисляемость перманганатная измеряется мгО/л, если учитывается масса иона кислорода в
составе перманганата калия, пошедшего на окисление «органики», или мг КМnО4/л,
если оценивается количество перманганата калия, пошедшего на окисление «органики»Окисляемость бихроматная, мгО/л, - показатель, дающий более правильное представление о содержании в воде органических веществ, так как при определении ХПК окисляется около 90% органических примесей, а при определении перманганатной окисляемости - 30-50%.
Слайд 19ХПК - количество кислорода (или окислителя в пересчете на кислород)
в мг/л, необходимое для полного окисления содержащихся в пробе сточных
вод органических веществ, при котором углерод, водород, сера, фосфор и другие элементы (кроме азота), если они присутствуют в органическом веществе, окисляются соответственно до СО2, Н2О, Р2О5, SО3, а азот превращается в аммонийную соль.В англоязычной литературе ХПК обозначают термином COD (Chemical Oxygen Demand), в немецкой литературе - CSB (Chemischer Sauerstoffbedarf).
При анализе ХПК наиболее надежные результаты получаются при ХПК = 300-600 мгО/л. При этом анализе окисляются ионы Br -, J-, NO2-, некоторые соединения серы и др.
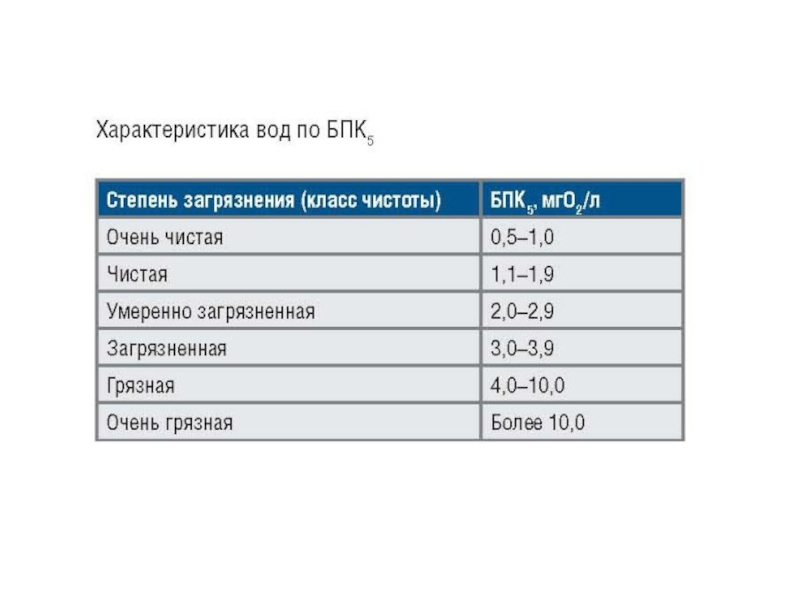
Слайд 20БПК - количество кислорода в мг/л, требуемое для окисления находящихся
в 1 л воды органических веществ в аэробных условиях в
результате происходящих в воде биологических процессовПри определении БПК5 (температура воды 20°С, рН=6-8, обеспечен достаточный доступ кислорода к пробе воды) окисляется примерно 70% легкоокисляющихся органических веществ, за 10-20 сут - соответственно 90 и 99% (как правило, но не всегда). Поэтому, когда определяют БПКполн, имеют в виду, что процесс окисления длится 15-20, в редких случаях - до 35 сут.
Слайд 24Общий органический углерод
Содержание общего органического углерода (ООУ, по зарубежным источникам
- TOCTotal Organic Carbon) - достаточно надежный показатель содержания в
воде органических веществ, в среднем численно равный 50% массы органических веществ. В природных поверхностных водах значения органического углерода могут колебаться от 1 до 20 и даже до нескольких сотен мг/л (в болотистых водах).Слайд 25Сухой и прокаленный остаток
Сухой остаток характеризует количество нелетучих растворенных веществ.
Определяется взвешиваем остатка, образовавшегося после упаривания пробы воды при температуре
1050С.Прокаленный остаток показывает содержание в воде растворенных неорганических веществ. Определяется путем прокаливания сухого остатка при температуре не ниже 6000С.
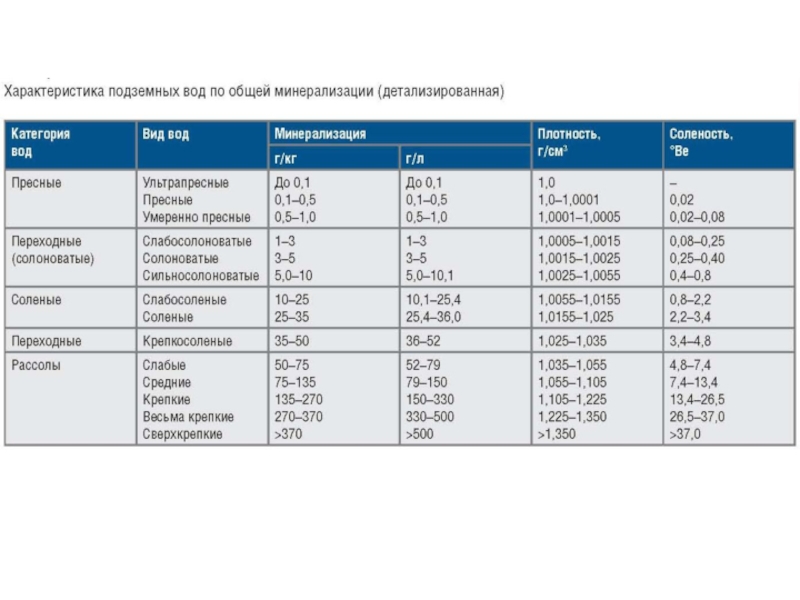
Слайд 26суммарное содержание всех найденных при химическом анализе воды минеральных веществ.
Минерализация природных вод, определяющая их удельную электропроводность.
Минерализация
Слайд 28Электропроводимость - это численное выражение способности водного раствора проводить электрический
ток. Электрическая проводимость воды зависит в основном от концентрации растворенных
минеральных солей и температуры. Минеральную часть воды составляют ионы Na+, K+, Ca2+, Mg2+, Cl-, SO42-, HCО3-. Этими ионами и обусловливается электропроводимость природных вод. Присутствие других ионов, например Fe3+, Fe2+, Mn2+, Al3+, NO3-, HPO42-, H2PO4-, не сильно влияет на электропроводимость, если эти ионы не содержатся в воде в значительных количествах (например, ниже выпусков производственных или хозяйственно-бытовых сточных вод). По значениям электропроводимости можно приближенно судить о минерализации воды.Слайд 29Жесткость
Жесткость воды обусловливается наличием в воде ионов кальция (Са2+), магния
(Mg2+), стронция (Sr2+), бария (Ва2+), железа (Fe3+), марганца (Mn2+). Но
общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов - и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния - общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. Однако при значении жесткости воды более 9 ммоль/л нужно учитывать содержание в воде стронция и других щелочноземельных металлов.Слайд 30По стандарту ИСО 6107-1-8:1996, включающему более 500 терминов, жесткость определяется
как способность воды образовывать пену с мылом.
В России жесткость воды
выражают в ммоль/л.В жесткой воде обычное натриевое мыло превращается (в присутствии ионов кальция) в нерастворимое «кальциевое мыло», образующее бесполезные хлопья. И, пока таким способом не устранится вся кальциевая жесткость воды, образование пены не начнется. На 1 ммоль/л жесткости воды для такого умягчения воды теоретически затрачивается 305 мг мыла, практически - до 530.
Но, конечно, основные неприятности - от накипеобразования.
Международные своды нормативов качества воды не нормируют жесткость воды - только отдельно содержание в воде ионов кальция и магния: нормы качества питьевой воды Всемирной организации здравоохранения (ВОЗ), такие же нормы Европейского Союза (ЕС), стандарты ИСО, а также Национальные нормы питьевой воды США.