Слайд 1Лекция 6
Обмен углеводов
часть 3
к.б.н., доцент И.В. Андреева
Слайд 2План лекции 6:
Гипер- и гипогликемия: причины возникновения, механизмы компенсации.
Метаболические и
клинические последствия острых и клинических гипер- и гипогликемий.
Инсулин. Особенности строения,
этапы метаболизма, механизм действия.
Сахарный диабет 1-го и 2-го типов: причины возникновения. Метаболические нарушения, клинические проявления, биохимическая диагностика, профилактика.
Биохимические причины и механизмы развития острых осложнений сахарного диабета.
Биохимические механизмы развития хронических осложнений сахарного диабета: нейропатии, микро- и макроангиопатии и связанные сними метаболические и клинические проявления заболевания, профилактика.
Слайд 3Гипер- и гипогликемия:
причины возникновения, механизмы компенсации
Концентрация глюкозы в артериальной
крови в течение
суток поддерживается на постоянном уровне:
80-100 мг/дл
или 3,3- 5,5 (6,0) мМоль/л
После приёма углеводной пищи уровень глюкозы в крови
возрастает в течение 0,5-1 часа до
120-140 мг/дл или 7 – 8 мМоль/л
алиментарная гиперглюкоземия,
затем (приблизительно через 2 часа) возвращается к
нормальному уровню.
Понижение концентрации глюкозы в крови
осуществляется гормоном ИНСУЛИНом
Слайд 4Рис. Динамика изменений концентрации глюкозы в течение суток:
А-Б-В – период пищеварения (абсорбтивный период);
В-Г – постабсобтивный период.
Стрелка (↑) указывает время приёма пищи; пунктирная линия –
значение концентрации глюкозы, соответствующее физиологической
норме 80-100 мг/дл.
Слайд 5Снижение концентрации глюкозы в крови ниже
80мг/дл или 3,3 мМоль/л
называется
гипоглюкоземией.
И это более опасное состояние чем гиперглюкоземия.
абсобтивный период и постабсорбтивний
период
Инсулин и
контринсулярные гормоны: глюкагон, адреналин
инсулин-глюкагоновый индекс
Слайд 6Заболевания вызывающие повышение
концентрации глюкозы в крови
Гипреглюкоземия - повышение сахара
в крови,
появление глюкозы в моче (глюкозурия) – наблюдаются
при различных
заболеваниях: сахарном диабете,
гипофизарных заболеваниях, опухолях коркового
вещества надпочечников, гиперфункции щитовидной
железы. Гиперглюкоземия может возникать при
органических поражениях ЦНС, расстройствах мозгового
кровообращения, болезнях печени воспалительного
или дегенеративного характера.
Слайд 7 Заболевания вызывающие понижение
концентрации глюкозы в крови
Гипогликемия – понижение содержания
сахара в крови –
нередко связана с поражением эндокринных желез,
а
именно гипофукции щитовидной железы (гипотериоз),
паращитовидных желез, гиперфункции поджелудочной
железы и повышенной продукции инсулина.
А также при голодании и большой физической нагрузке.
Слайд 8Постоянное поступление глюкозы необходимо в качестве
основного источника энергии для нервной
ткани и
эритроцитам. При понижении концентрации глюкозы в
крови ниже
определенного критического уровня
нарушается функционирование мозга. При тяжелой
гипогликемии может возникнуть коматозное состояние и
наступить летальный исход.
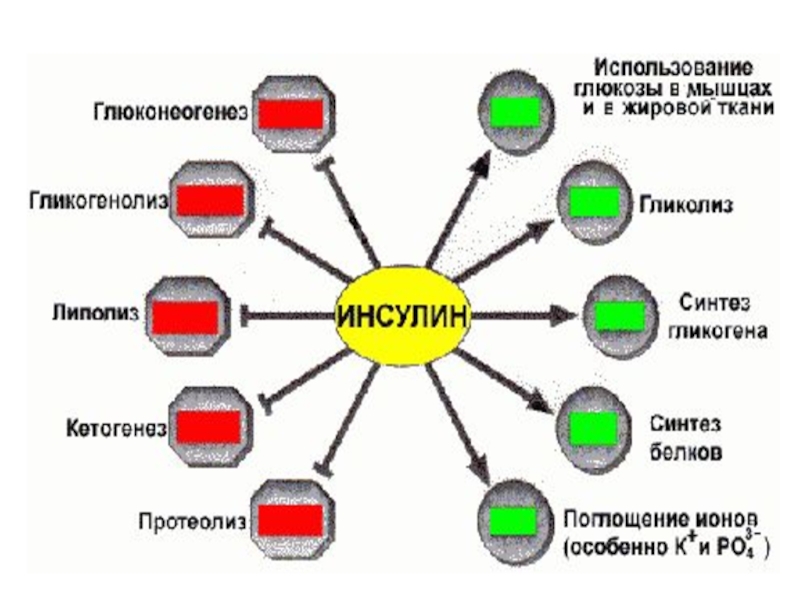
В регуляции метаболизма глюкозы, связанной с режимом
питания, участвуют гормоны ИНСУЛИН и ГЛЮКАГОН.
Инсулин снижает уровень глюкозы в крови до
оптимальной концентрации, а
глюкагон повышает концентрацию глюкозы при снижении
её концентрации ниже 3,3 мМ/л.
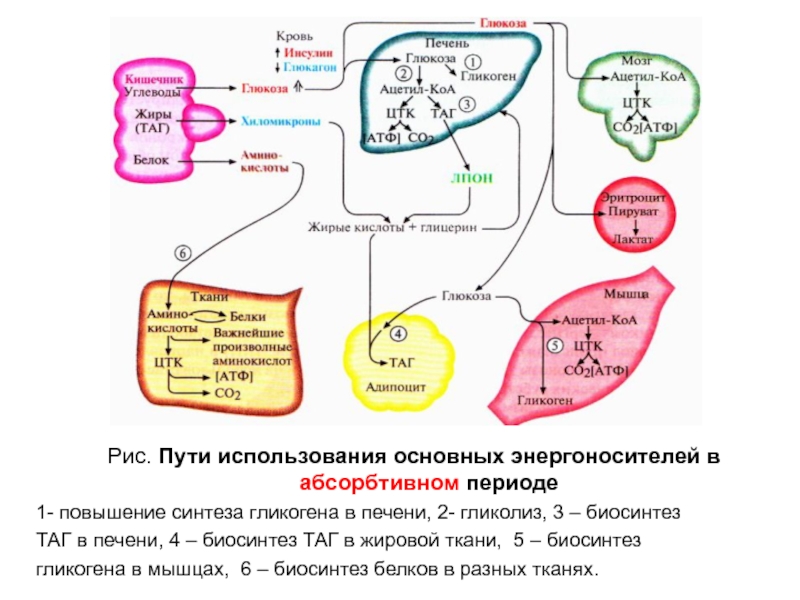
Слайд 10Рис. Пути использования основных энергоносителей в абсорбтивном периоде
1- повышение синтеза
гликогена в печени, 2- гликолиз, 3 – биосинтез
ТАГ в
печени, 4 – биосинтез ТАГ в жировой ткани, 5 – биосинтез
гликогена в мышцах, 6 – биосинтез белков в разных тканях.
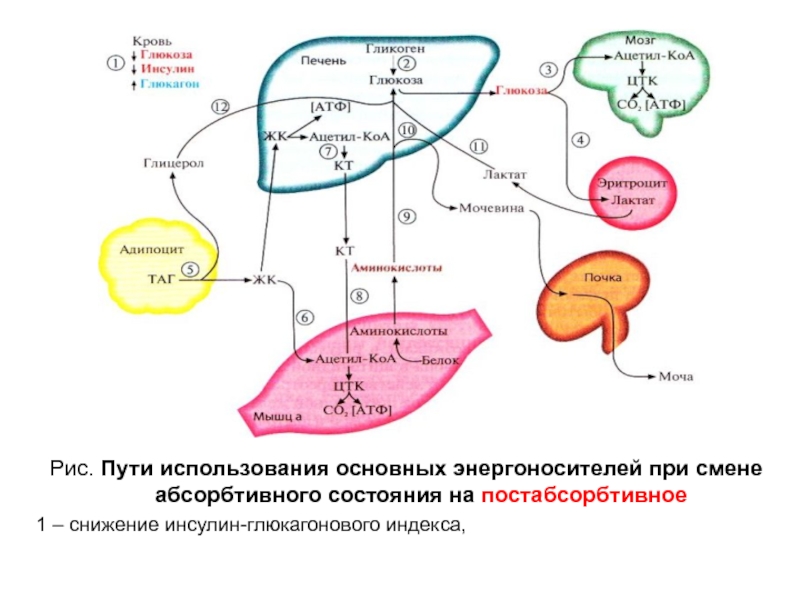
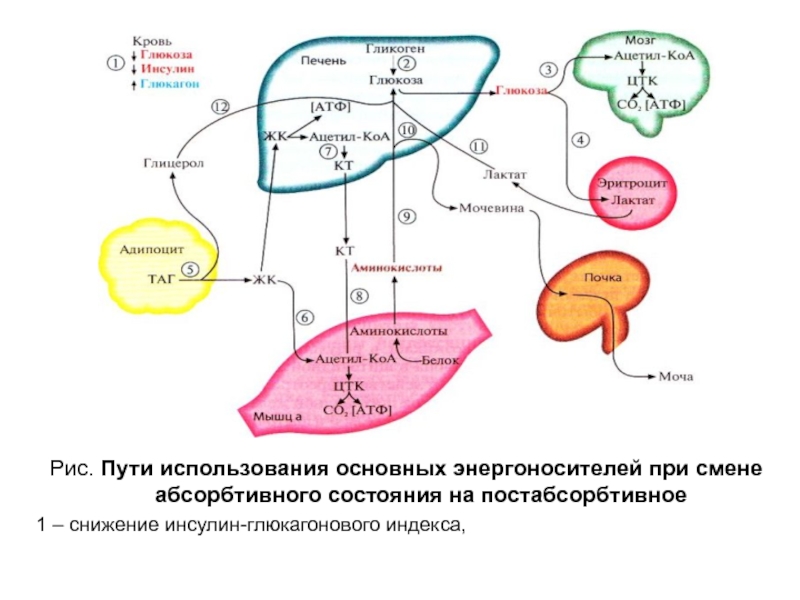
Слайд 11Рис. Пути использования основных энергоносителей при смене абсорбтивного состояния на
постабсорбтивное
1 – снижение инсулин-глюкагонового индекса,
Слайд 12Рис.
Изменение метаболизма
основных
энергоносителей при
голодании
1- снижение инсулин-глюкагонового индекса,
2- мобилизация гликогена,
3,4- транспорт Глк в мозг и эритроциты;
5- мобилизация ТАГ;
6- транспорт ЖК в мышцы;
7- синтез кетоновых тел;
8- транспорт ЖК в печени;
9- транспорт АК в печень;
10- глюконеогенез из АК;
11- транспорт лактата в печень.
Пунктиром обозначены
процессы, скорость которых
снижается.
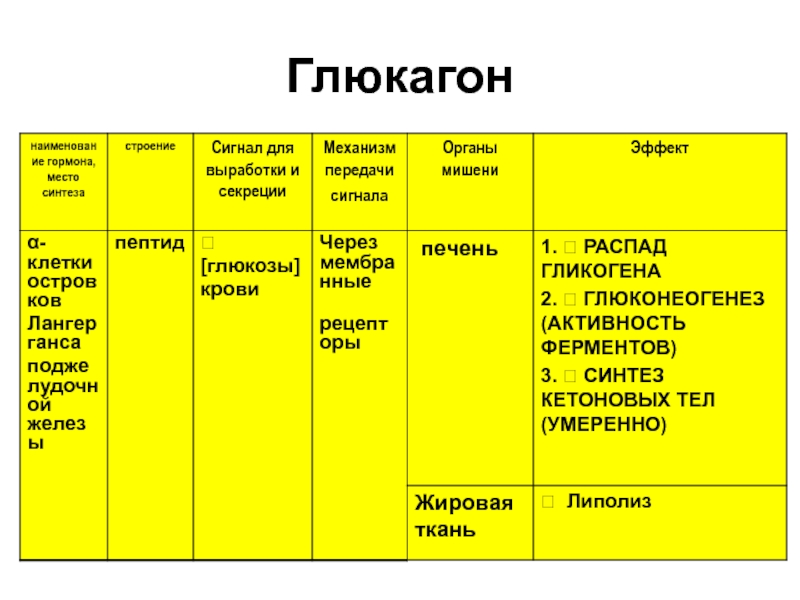
Слайд 13природа гормонов инсулина и глюкагона;
механизм регуляции концентрации глюкозы гормонами.
В зависимости
от физиологического состояния
концентрация глюкозы в крови регулируется активацией
или ингибированием
метаболизма гликогена в печени, и
глюконеогенезом (печень, почки),
Как осуществляется регуляция концентрации глюкозы в крови
гормонами
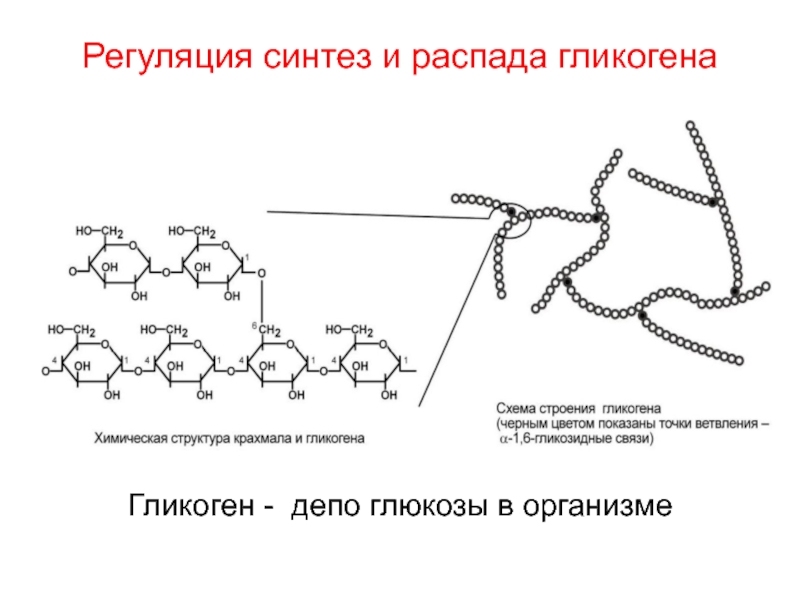
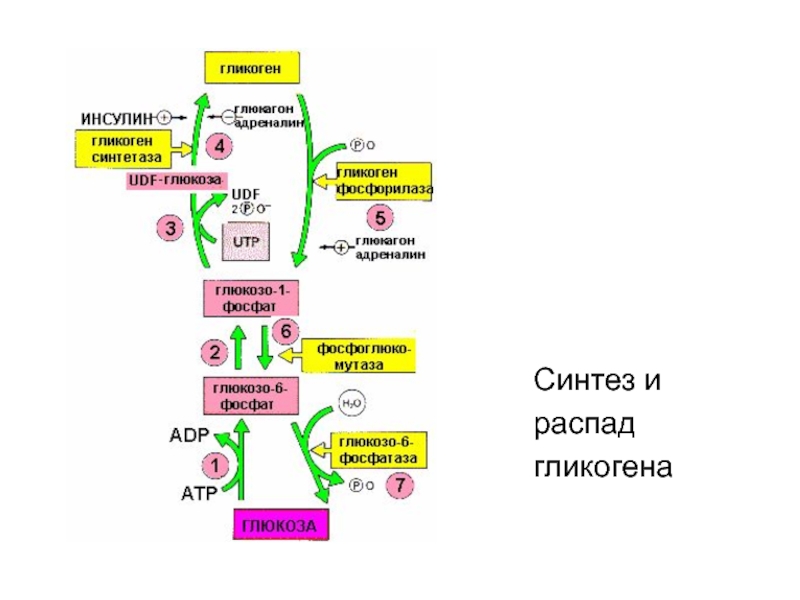
Слайд 14Регуляция синтез и распада гликогена
Гликоген - депо глюкозы в организме
Слайд 15Метаболизм гликогена в печени, мышцах и др.клетках
регулируется несколькими гормонами,
одни из которых
активируют синтез, а другие - распад гликогена.
При
этом в одной клетке не могут идти одновременно
синтез и распад гликогена – это противоположные
процессы с совершенно разными задачами. Синтез и
распад исключают друг друга или, по другому они
реципрокны.
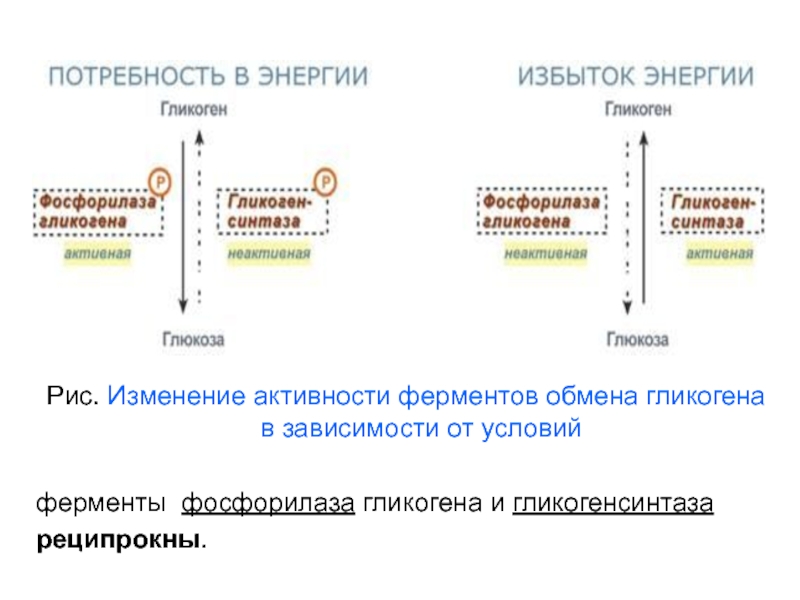
Активность ключевых ферментов метаболизма
гликогена осуществляют гликогенфосфорилазы и
гликогенсинтетазы. Активность этих ферментов
изменяется в зависимости от наличия в составе
ферментов фосфорной кислоты – они активны либо в
фосфорилированной либо в дефосфорилированной форме.
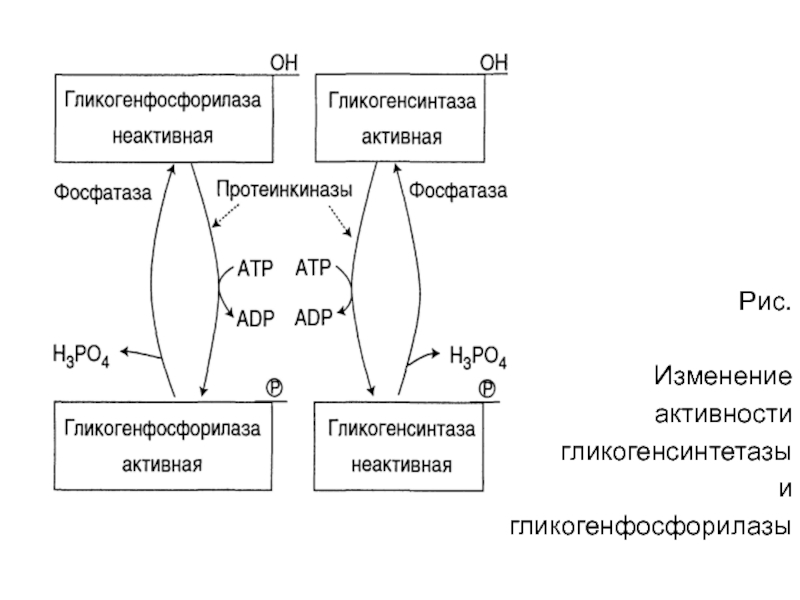
Слайд 16Присоединение фосфатов к ферменту производят
протеинкиназы, источником фосфора является АТФ:
фосфорилаза гликогена активируется (+) после присоединения фосфатной группы,
синтаза гликогена
после присоединения фосфата инактивируется (-).
Скорость фосфорилирования указанных ферментов
повышается после воздействия на клетку адреналина,
глюкагона и некоторых других гормонов. В результате
адреналин и глюкагон вызывают гликогенолиз,
активируя фосфорилазу гликогена фосфорилированием
(опосредованно через присоединение остатка Н3РО4).
Слайд 17Например:
во время мышечной работы
адреналин вызывает фосфорилирование
внутримышечных ферментов обмена
гликогена. В
результате фосфорилаза гликогена активируется, а
синтаза – инактивируется.
В мышце происходит распад
гликогена и образуется глюкоза для обеспечения
энергией сокращение (работу) мышц.
при голодании в ответ на снижение концентрации
глюкозы в крови из поджелудочной железы секретируется
глюкагон. Он воздействует на гепатоциты и вызывает
фосфорилирование ферментов обмена (катаболизма)
гликогена, что приводит к гликогенолизу и повышению
глюкозы в крови.
Слайд 18Способы активации синтазы гликогена
Гликогенсинтаза при присоединении фосфата прекращает
работу, т.е. она
активна в дефосфорилированном виде.
Удаление фосфата от ферментов осуществляют
протеинфосфотазы.
Активатором протеинфосфотаз
выступает инсулин – в
результате этот гормон повышает синтез гликогена.
Вместе с этим инсулин и глюкокортикоиды ускоряют
синтез гликогена, увеличивая количество молекул
гликогенсинтетазы.
Слайд 19Рис. Изменение активности ферментов обмена гликогена в зависимости от условий
ферменты фосфорилаза гликогена и гликогенсинтаза
реципрокны.
Слайд 20Инсулин
Вырабатывается Бета клетками островков Лангерганса
панкреатической (поджелудочной) железой.
Состоит из 51 остатка
АК
мол Масса = 6 кДа
Проинсулин – инсулин
рецепторы
Инсулинзависимые ткани
(ГЛЮТ 4)
Инсулиннезависимые ткани
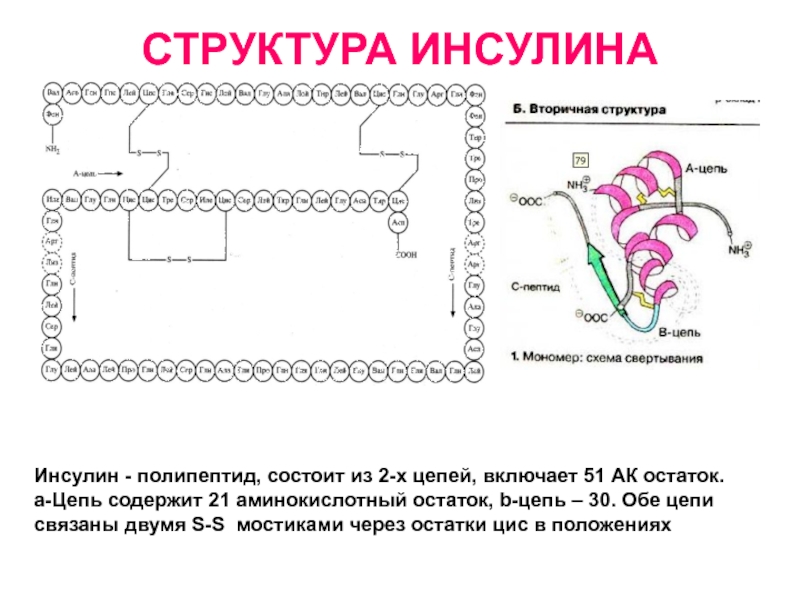
Слайд 21СТРУКТУРА ИНСУЛИНА
Инсулин - полипептид, состоит из 2-х цепей, включает 51
АК остаток.
a-Цепь содержит 21 аминокислотный остаток, b-цепь – 30.
Обе цепи связаны двумя S-S мостиками через остатки цис в положениях
Слайд 25Изменение гормонального статуса и метаболизма при сахарном диабете
Сахарный диабет (СД)
возникает вследствие
относительного или абсолютного дефицита инсулина.
В соответствии с
классификацией ВОЗ различают две
основные формы заболевания:
Диабет I типа – инсулинзависимый (ИЗСД) и
Диабет II типа - инсулиннезависимый (ИЗСД)
Слайд 26ИЗСД - СД I типа
Является следствием разрушения бета-клеток островков
Лангерганса в
результате аутоиммунных реакций.
ПРИЧИНЫ СД
провоцировать возникновение СД I типа могут:
вирусные инфекции
вызывающие деструкцию бета-клеток:
вирусы оспы, краснухи, кори, цитомегаловирус,
эпидемический паратит, вирус Коксаки, аденовирус.
25-30 % диабетов - СД I
Слайд 27ИНСД – СД II типа
ПРИЧИНЫ
Развивается вследствие нарушения:
превращения проинсулина в инсулин,
регуляции
секреции инсулина,
повышения скорости катаболизма инсулина,
повреждения механизмов передачи инсулинового сигнала в
клетки-мишени
(например, дефекта рецептора инсулина,
повреждения внутриклеточных посредников
инсулинового сигнала и др.),
- образование антител к рецепторам инсулина, причём концентрации инсулина может быть нормальной или даже повышенной.
Провоцировать созникновение СД I типа могут:
вирусные инфекции вызывающие деструкцию бета-клеток:
оспы, краснухи, кори, цитомегаловирус, эпидемический
паратит, вирус Коксаки, аденовирус.
25-30 % - СД I
Слайд 28Факторы увеличивающие риск развития ИНСД:
ожирение,
неправильный режим питания,
гиподинамия,
стрессы.
Обычно после 40
лет.
Симптомы умеренны.
Острые осложнения бывают редко.
Слайд 29Изменения метаболизма при СД
1. соотношения инсулин-глюкагон (инсулин/глюкагон) снижено.
При этом ослабевает
стимуляция процессов
депонирования гликогена и жиров и усиливается
мобилизация запасов
энергоносителей.
Печень, мышцы и жировая ткань после приёма пищи
функционируют в режиме постабсорбтивного
состояния.
Слайд 30Рис. Пути использования основных энергоносителей при смене абсорбтивного состояния на
постабсорбтивное
1 – снижение инсулин-глюкагонового индекса,
Слайд 31Рис.
Изменение метаболизма
основных
энергоносителей при
голодании
1- снижение инсулин-глюкагонового индекса,
2- мобилизация гликогена,
3,4- транспорт Глк в мозг и эритроциты;
5- мобилизация ТАГ;
6- транспорт ЖК в мышцы;
7- синтез кетоновых тел;
8- транспорт ЖК в печени;
9- транспорт АК в печень;
10- глюконеогенез из АК;
11- транспорт лактата в печень.
Пунктиром обозначены
процессы, скорость которых
снижается.
Слайд 32Симптомы СД
Гиперглюкоземия
Кетонемия
Гиперлипопротеинемия
Азотемия
Полиурия
Слайд 33Симптомы СД
1. Гиперглюкоземия
Для всех форм диабета характерно повышение
концентрации глюкозы
в крови – гиперглюкоземия, как
после приема пищи так и натощак,
а также глюкозурия.
После приёма пищи концентрация глюкозы может
возрастать до 300-500 мг/дл.
(норма при алиментарной глюкоземии 120-140 мг/дл)
и сохраняться на высоком уровне в постабсорбтивном
периоде, т.е. снижается толерантность к глюкозе.
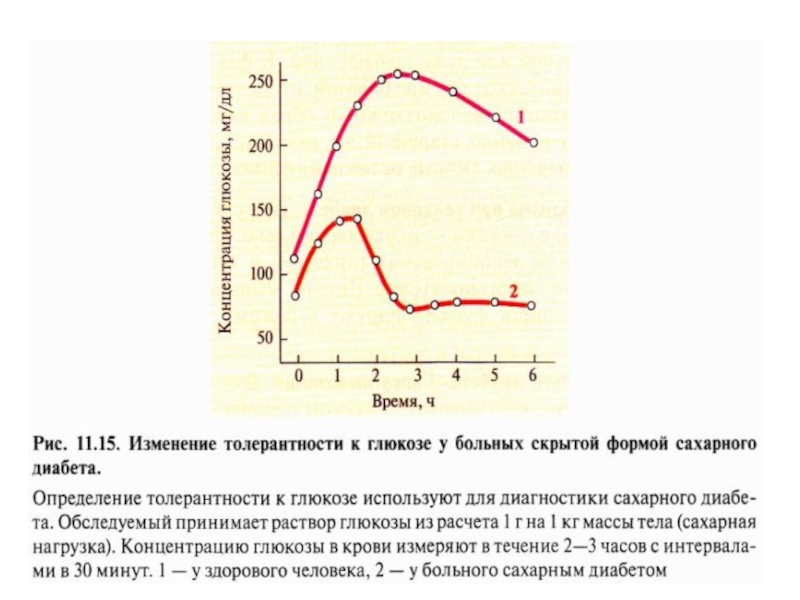
Скрытые формы СД выявляют сахарной нагрузкой:
Слайд 352. Кетонемия
характерный признак СД.
При низком соотношении инсулин-глюкагонового индекса
жиры не депонируются,
ускоряется их катаболизм, т.к.
гормончувствительная липаза в жировой ткани
находится в
фосфорилированной – активной форме.
Концентрации наэтерифицированных жирных кислот в
крови повышается. Печень захватывает жирные кислоты
и окисляет их до ацетил-КоА, который превращается в
кетоновые тела.
В крови концентрация КТ увеличивается до 100 мг/дл
( при норме 20 мг/дл). Развивается кетонурия.
Изменяется рН крови – кетоацидоз.
Слайд 363. Гиперлипопротеинемия
Пищевые жиры не депонируются в жировой ткани в
следствие
ослабления процессов запасания и низкой
активности ЛП-липазы, а поступают в
печень,
превращаются в ней в ЛПОНП и выносятся в кровь.
4. Азотемия
При СД дефицит инсулина приводит к снижению
скорости синтеза и усилению распада белков.
Печень синтезирует повышенное количество мочевины.
Следовательно развивается азотемия, азотурия.
Слайд 375. Полиурия
Для выведения большого количества глюкозы, кетоновых
тел, мочевины требуется большой
объем жидкости, в
результате чего может наступить обезвоживание
организма.
Это объясняется
концентрационной способностью почек.
Потеря воды вызывает постоянную жажду и увеличение
потребления воды – полидипсию.
Слайд 38Острые осложнения СД
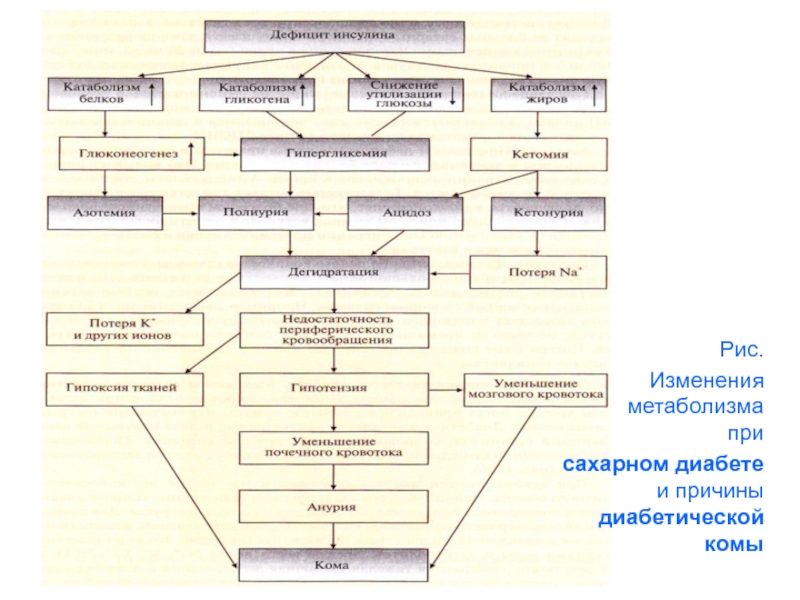
Механизм развития диабетической комы.
Нарушения метаболизма углеводов, жиров и
белков при СД
могут приводить к развитию коматозных состояний.
Диабетическая кома проявляется
как резкое нарушение
всех функций организма, сопровождающееся потерей
сознания.
Основными предшественниками диабетической комы
являются ацидоз и дегидротация тканей.
Слайд 39Коматозные состояния при СД
кетоацидотическая кома,
гиперосмолярная кома,
лактоацидотическая кома.
Для кетоацидотической формы характены
выраженный
дефицит инсулина, кетоацидоз, полиурия, полидипсия.
При гиперосмолярной форме - чрезвычайно высокие
концентрации глюкозы в крови, полиурия, полидипсия,
тяжелая дегидротация (сопутствующее нарушение
работы почек).
При лактоацидотической коме – гипотония, снижение
периферического кровообращения, гипоксия тканей
приводящая к анаэробному гликолизу и увеличению
лактата в крови (лактоацидоз).
Слайд 40Рис.
Изменения метаболизма при
сахарном диабете и причины диабетической комы
Слайд 41Поздние осложнения СД
Причина - длительная гиперглюкоземия.
Следствие – инвалидизация.
Из-за повреждения
кровеносных сосудов и следовательно
нарушения функций различных тканей и органов.
Механизм
повреждения сосудов – гликозилирование
белков, а следовательно нарушение функций.
Нарушение реологических свойств крови (текучесть,
вязкость).
Слайд 42Степень гликозилирования белков зависит от скорости
их обновления.
Также гликозилируются:
- белки
базальных мембран,
- клисталлины хрусталика глаза.
Нарушения водно-электролитного обмена
При декомпенсации организмом гиперглюкоземии
диабета развивается нарушение водно-электролитного
обмена – сопровождающегося повышением
осмотического давления в сосудистом русле.
Слайд 43 Для сохранения осмомолярности начинается
компенсаторное перемещение жидкости из клеток и
внеклеточного пространства в сосудистое русло.
Это ведет к потере ионов
Na+, К+, СI-, НСО3-.
В результате развивается тяжелая клеточная
дегидратация и дефицит внутриклеточных ионов
(прежде всего К+,) сопровождающаяся общей
дегидратацией. А это проводит к снижению
периферического кровообращения, уменьшению мозгового
и почечного кровотоков и гипоксии.
Один из первых признаков диабета – появление
гликозилирование гемоглобина (НвА1с).
.
Слайд 44
Диабетические ангиопатии
Макроангиопатии:
снижение эластичности артерий, повреждение крупных и
мелких сосудов мозга,
сердца, нижних конечностей.
Следствие нарушение кровообращения.
Микроангиопатии:
в следствие повреждения капилляров и
мелких сосудов -
нефроангиопатия, ретинопатия и катаракта.
причину увязывают и с образованием сорбитола.
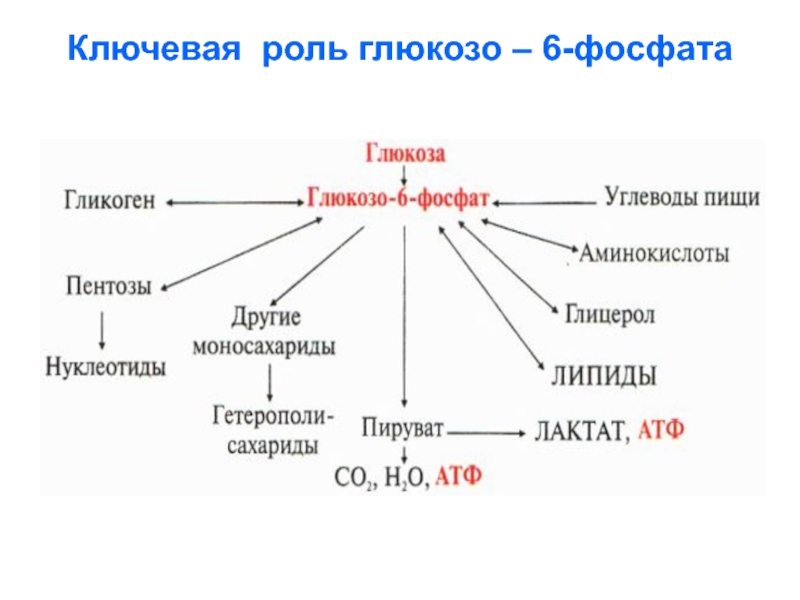
Слайд 47
Ключевая роль глюкозо – 6-фосфата
Слайд 501. Обмен гликогена
Гликогенез и
гликогенолиз
Слайд 51Гликоген – основная форма депонирования глюкозы в клетках животных (резервный
полисахарид).
У растений эту же функцию выполняет крахмал.
В структурном
отношении гликоген, как и крахмал,
представляет собой разветвленный полимер,
построенный из остатков глюкозы соединенных на линейных участках 1-4 альфа-, и в местах разветвления
1-6 альфа- гликозидными связями.
И гликоген и крахмал – гомополисахариды.
Гликоген более разветвлен и
компактен, чем крахмал.
В гликогене свыше
1 000 000 остатков глюкозы.
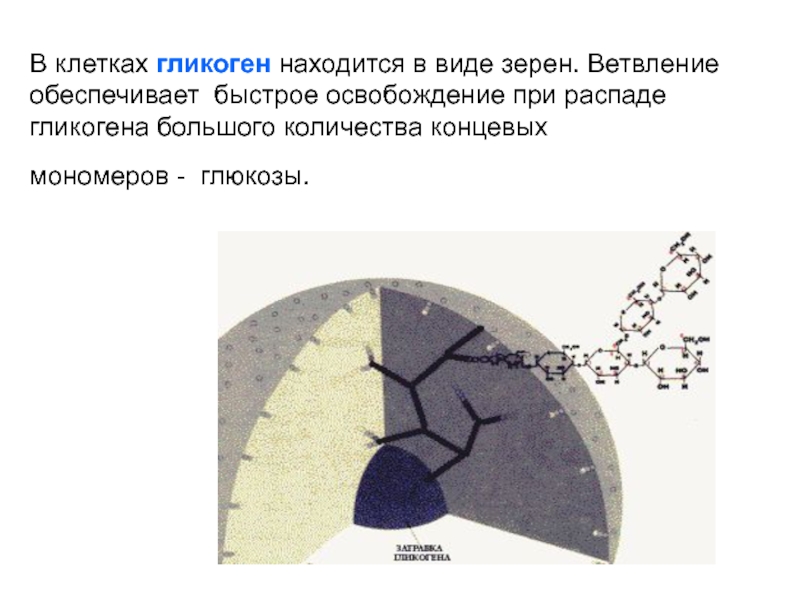
Слайд 52В клетках гликоген находится в виде зерен. Ветвление обеспечивает быстрое
освобождение при распаде гликогена большого количества концевых
мономеров - глюкозы.
Слайд 53Линейные участки молекулы гликогена образованы
остатками глюкозы, связанными
альфа-1,4-гликозидными связями,
а в местах
разветвления – альфа 1,6-гликозидными связями.
Линейные участки молекул
гликогена состоят из 6-10
остатков глюкозы.
(в крахмале линейные участки длиннее, и состоят из
20-24 остатков глюкозы). Следоватетельно, крахмал
менее разветвлен.
Слайд 54Синтез и распад гликогена
Синтез и распад гликогена гормонозависимый процессы
и регулируются инсулином и глюкагоном (и другими контринсулярными гормонами адреналином
и кортизолом).
Процессы синтеза и распада гликогена не являются
обращением друг в друга, эти процессы происходят
разными путями и разными ферментами.
У животных гликоген синтезируется во всех клетках тканей органов, но особенно активно синтез идёт в мышцах и в печени, где он откладывается (в цитоплазме) в виде видных под микроскопом зёрен.
350г в мышцах,
100г в печени.
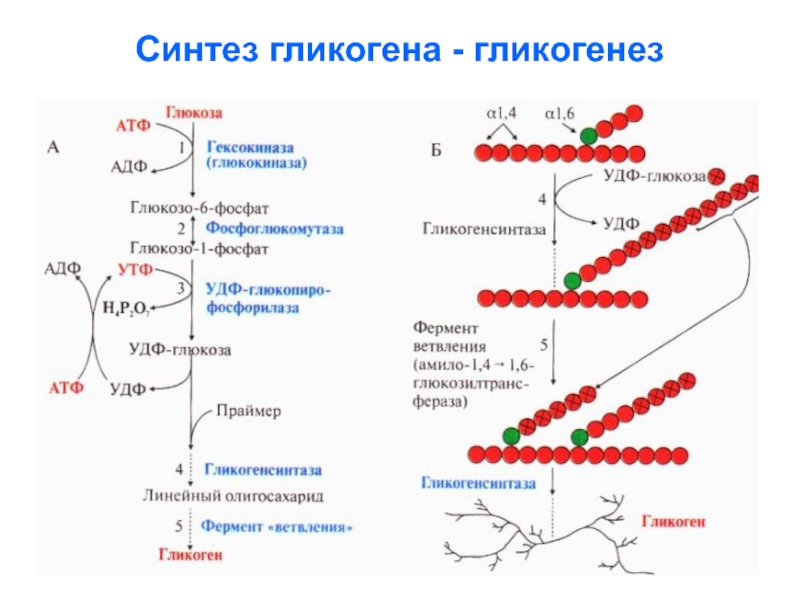
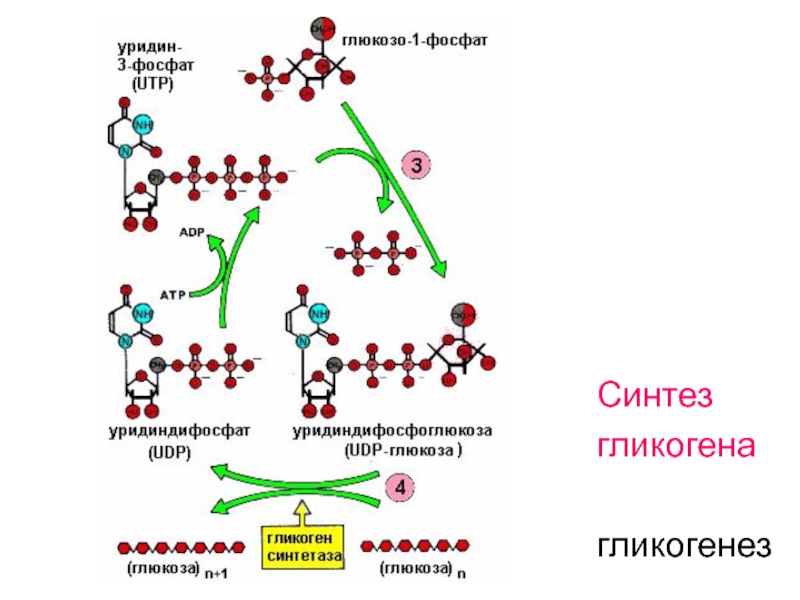
Слайд 55Синтез гликогена - гликогенез
Синтез гликогена ускоряется в период
пищеварения (абсорбтивный период
– 1-2 часа после
приёма пищи), когда глюкоза активно поступает
из
крови в клетки тканей и фосфорилируется, превращаясь
в глюкозо-1- фосфат (затрачивается АТФ), а затем для
синтеза гликогена глюкозо-1-фосфат превращается в
уридин-дифосфо-глюкозу (УДФ-глюкозу).
Затрачивается УТФ, аналог АТФ
УДФ-глюкоза – субстрат для гликогенсинтетазы.
Гликогенсинтетаза переносит остаток глюкозы на
праймер (олигосахарид из 4-8 остатков глюкозы) и
соединяет его альфа-1,4- гликозидной связью.
Слайд 56Когда длина синтезируемой цепи увеличивается на
11-12 остатков глюкозы, фермент
ветвления
переносит фрагмент из 5-6 остатков глюкозы на
внутренний остаток
глюкозы , соединяя его
альфа-1,6-гликозидной связью.
Удлинение цепей и ветвление их повторяется много
много (тысячи) раз. А так как в гликогене более
миллиона остатков глюкозы, то расходы энергии (АТФ и
УТФ) составляют в 2 раза большее количество молей,
чем молей глюкозы.
Т.е. синтез гликогена энергозатратный процесс.
Слайд 59
Далее подробно расписаны реакции гликогенеза:
Слайд 60 1. Получение активной формы глюкозы реакцией фосфорилирования:
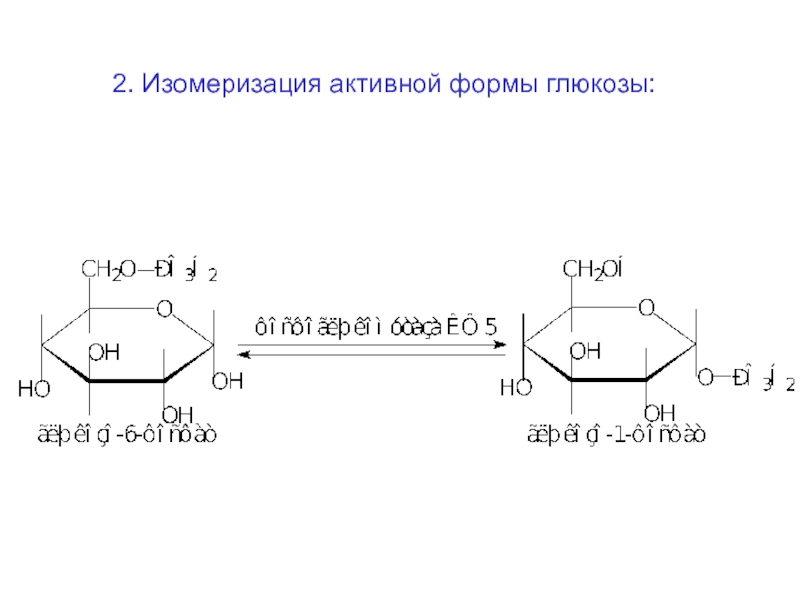
Слайд 612. Изомеризация активной формы глюкозы:
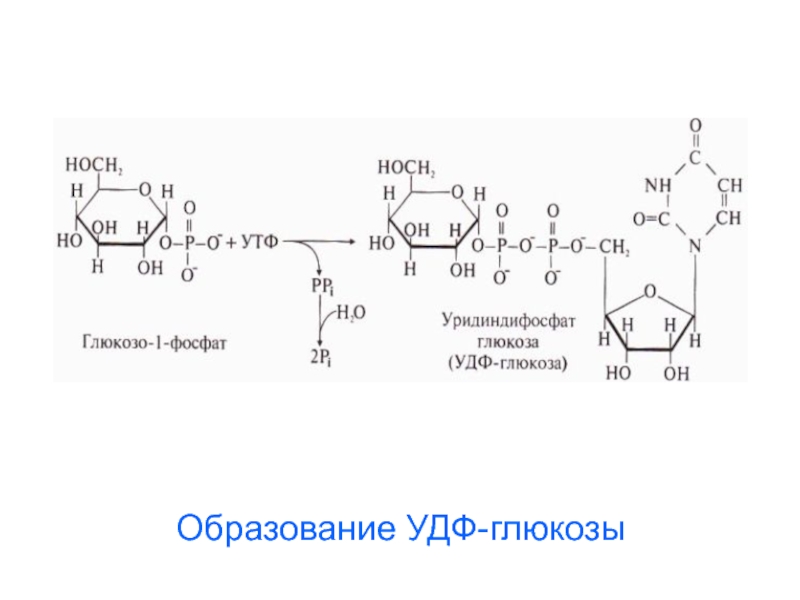
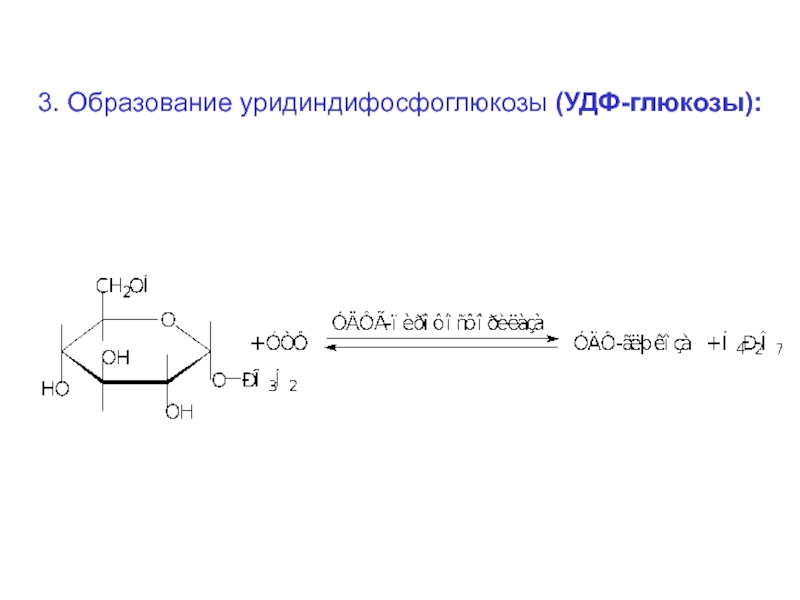
Слайд 623. Образование уридиндифосфоглюкозы (УДФ-глюкозы):
Слайд 63Строение УДФ-глюкозы
Нуклеозид-фосфосахара
используются как
переносчики
звеньев моноз
в реакциях
синтеза
полимерных
молекул
Слайд 644. Перенос остатка глюкозы с УДФ-глюкозы на
затравочную цепь
гликогена, которая содержит
не менее 4-х звеньев глюкозы:
при наращивании
цепи гликогена α-(1,4)-гликозидная связь
образуется за счёт полуацетального гидроксила
добавляемого звена и гидроксильной группы в 4-м
положении остатка глюкозы растущей цепи.
Слайд 65Ветвление гликогена
5. Синтез α-(1,6)-гликозидных связей происходит при
участии гликоген-ветвящегося фермента –
гликоген-трансферазы,
которая переносит концевой
олигосахарид молекулы с невосстанавливающего
конца на гидроксильную
группу у 6-го атома углерода
глюкозы той же или соседней цепи гликогена.
Благодаря способности гликогена накапливаться в
мышцах и в печени, в организме создаётся резерв
углеводов, который используется при повышении
энергозатрат организма.
Слайд 66Подводим итог:
Гликоген синтезируется в период пищеварения
(в течение 1-2 часов
после приема углеводной пищи).
Гликогенез особенно интенсивно протекает в печени
и
скелетных мышцах.
В начальных реакциях образуется УДФ-глюкоза (реакция 3),
которая является активированной формой глюкозы,
непосредственно включающейся в реакцию полимеризации
(реакция 4). Эта последняя реакция катализируется
гликогенсинтазой, которая присоединяет глюкозу к
олигосахариду или к уже имеющейся в клетке молекуле
гликогена, наращивая цепь новыми мономерами.
Слайд 67Для подготовки и включения глюкозы в растущую
полисахаридную цепь требуется
энергия
1 моль АТФ и 1 моль УTФ.
Ветвление полисахаридной
цепи происходит при
участии фермента
амило- a-1,4 - a-1,6-гликозил-трансферазы
путем разрыва одной aльфа -1,4-связи и переноса
олигосахаридного остатка от конца растущей цепи
к ее середине с образованием в этом месте
aльфа -1,6-гликозидной связи .
Молекула гликогена содержит до 1 млн. остатков глюкозы,
следовательно, на синтез расходуется значительное
количество энергии.
Т.е. гликогенез энергозатратный процесс.
Слайд 68Необходимость превращения глюкозы в гликоген
связана с тем, что накопление
значительного
количества глюкозы в клетке привело бы к повышению
осмотического давления,
так как глюкоза хорошо
растворимое вещество. Напротив, гликоген
содержится в клетке в виде гранул, и мало растворим.
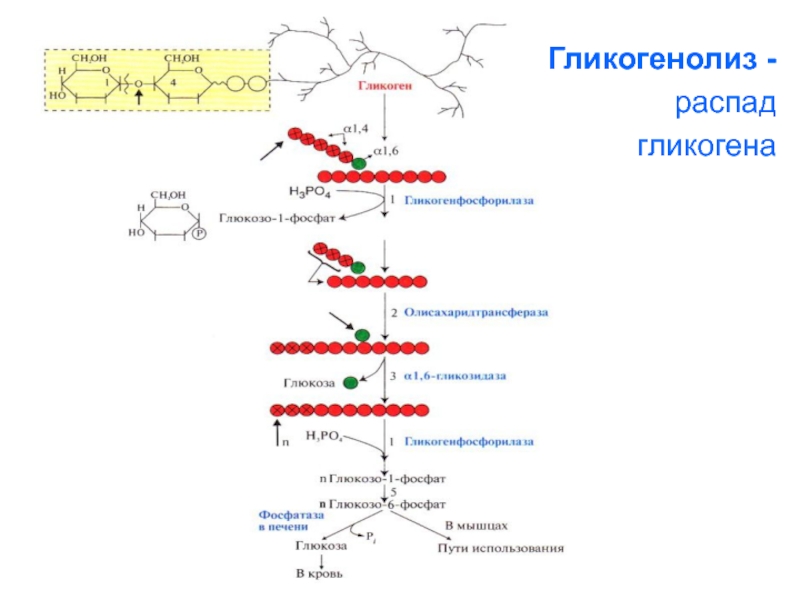
Слайд 69Распад гликогена - гликогенолиз
или мобилизация гликогена – происходит в основном
в
период между приёмами пищи (постабсорбтивный
период) и ускоряется во время
физической работы.
Этот процесс происходит путем последовательного
отщепления остатков глюкозы в виде
глюкозо-1-фосфата с помощью фермента
гликогенфосфорилазы . Этот фермент не расщепляет
альфа- 1,6- гликозидные связи в местах разветвлений,
поэтому необходимы еще 2 фермента, после действия
которых глюкозный остаток в точке ветвления
освобождается в форме свободной глюкозы. Гликоген
распадается до глюкозо-6-фосфата без затрат АТФ.
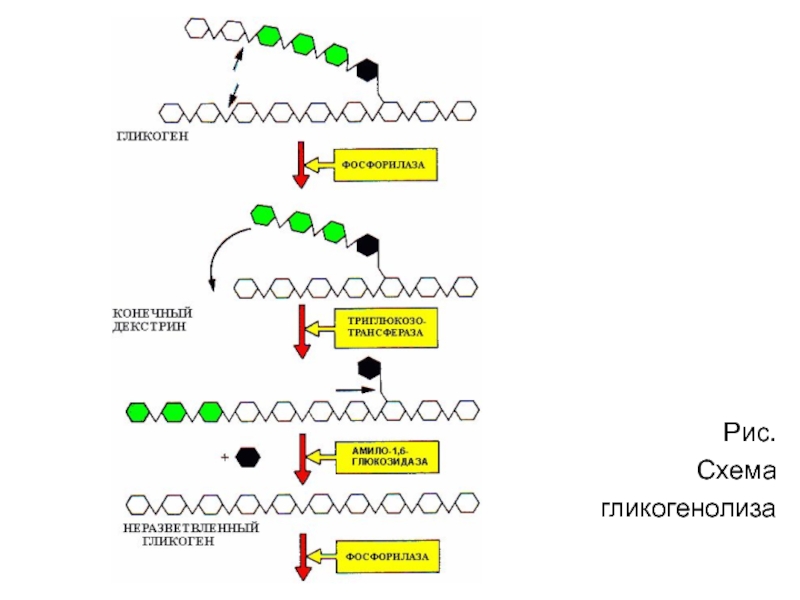
Слайд 711. Освобождение глюкозы в виде глюкозо-1-фосфата
(реакция 5) происходит в
результате фосфоролиза,
катализируемого фосфорилазой.
Фермент отщепляет концевые остатки один за
другим,
укорачивая цепи гликогена. Однако этот фермент
расщепляет только a -1,4 гликозидные связи.
2. Второй фермент олигозидтрансфераза переносит
олигомерный участок ветви на линейную цепь, где
работает опять фосфорилаза.
3. Связи в точке ветвления гидролизуются ферментом
амило-a-1,6-гликозидазой , который отщепляет
мономер глюкозы в свободном виде.
Слайд 73
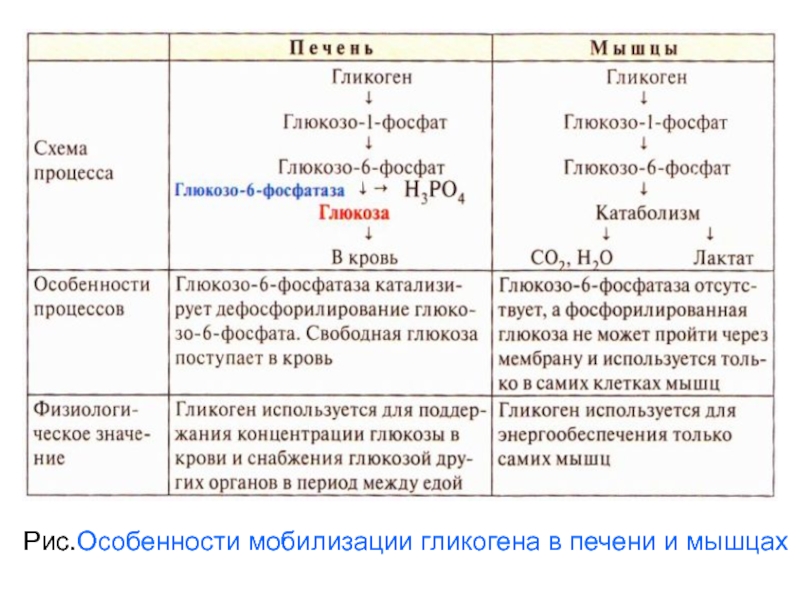
Мобилизация гликогена в печени и мыщцах отличаются
В печени есть
фермент глюкозо-6-фосфорилаза,
в мышцах нет.
Этот фермент осуществляет дефосфорилирование
глюкозо-6-фосфата с образованием
свободной
глюкозы, которая поступает из печени в кровь.
Следовательно главная функция гликогена печени –
резерв для поставки глюкозы в кровь в период между
приёмами пищи и использование её другими органами.
Таким образом, мобилизация гликогена печени
обеспечивает содержание глюкозы в крови на постоянном
Уровне. Это обстоятельство является обязательным
Условием для работы других органов и особенно мозга.
Слайд 74
Постоянный уровень глюкозы в крови в постабсорбтивный
период = 3,5-5,5
мМ/л
Органы мозг и эритроциты потребляют только глюкозу.
Через 10-18 часов после
приема пищи запасы гликогена
значительно уменьшаются, а голодание в течение
24 часов приводит к полному его исчезновению.
Фермент глюкозо-6-фосфорилаза содержится также в
почках и клетках кишечника.
В мышцах гликоген используется только на нужды
миоцитов.
Слайд 75Функция мышечного гликогена заключается в
высвобождении глюкозо-6фосфата, используемого в
самой
мышце для окисления и получения энергии.
Слайд 76
Рис.Особенности мобилизации гликогена в печени и мышцах
Слайд 77Гормоны регулирующие обмен гликогена
Переключение процессов синтеза и мобилизации
гликогена в
печени происходит при переходе состояния
пищеварения в постабсобтивный период или
состояния покоя на режим мышечной работы.
В печени – ИНСУЛИН, ГЛЮКАГОН и АДРЕНАЛИН
В мышцах – ИНСУЛИН и АДРЕНАЛИН
Действие гормонов в регулировании синтеза и распада
гликогена заключается в изменении активности 2х
ключевых ферментов:
гликогенсинтетазы и гликогенфосфорилазы путём
фосфорилировани и дефосфорилирования
Слайд 78Рис.
Изменение
активности
гликогенсинтетазы
и
гликогенфосфорилазы
Слайд 79Первичным сигналом для синтеза инсулина и
глюкагона является изменение концентрации
глюкозы в
Крови.
Инсулин и глюкагон постоянно присутствуют в крови,
при переходе
из абсорбтивного состояния в
постабсорбтивное изменяется их относительная
концентрация –
инсулин/глюкагоновый индекс.
В постабсорбтивный период инсулин/глюкагоновый индекс
снижается и решающим фактором является влияние
глюкагона, который стимулирует распад гликогена в
печени.
Механизм действия глюкагона включает каскад реакций,
приводящий к активации гликогенфосфорилазы .
Слайд 80В период пищеварения преобладающим является
влияние инсулина, и инсулин/глюкагоновый индекс
в
этом случае повышается .
Инсулин способствует поступлению глюкозы в
инсулинзависимые ткани.
Под действием инсулина происходит:
А – стимуляция транспорта глюкозы в клетки мышечной ткани
Б – изменение активности ферментов путем фосфорилирования и дефосфорилирования,
Слайд 81При интенсивной мышечной работе и стрессе в кровь
из мозгового
вещества надпочечников секретируется
гормон адреналин. Он ускоряет мобилизацию
гликогена печени
и мышц, обеспечивая тем самым
клетки разных тканей субстратом – глюкозой.
Действие этих гормонов в конечном счете сводится к
изменению скорости реакций катализируемых
ключевыми ферментами метаболических путей
гликогена. Активность которых регулируется
аллостерически и фосфорилированием.
Слайд 82Болезни углеводного обмена
Причины:
нарушения переваривания и всасывания углеводов,
синтеза и распада гликогена.
-
ферментопатии,
- патологии транспортеров моносахаридов,
- гормонзависимые болезни.
Слайд 83Нарушения переваривания дисахаридов
Слайд 88Глюконеогенез
Глюконеогенез – процесс синтеза глюкозы из веществ
неуглеводной природы.
Субстраты глюконеогенеза: пируват, лактат,
глицерол,
аминокислоты.
Важнейшей функцией глюконеогенеза является
поддержание уровня глюкозы в крови в
период
длительного голодания и интенсивной физической
нагрузки.
Постоянное поступление глюкозы в клетки особенно
необходимо нервной ткани и эритроцитам.
Слайд 89Процесс протекает главным образом в печени и менее
интенсивно в корковом
веществе почек и слизистой
кишечника.
Включение различных субстратов в глюконеогенез
зависит
от физиологического состояния организма:
лактат продукт анаэробного гликолиза в эритроцитах, работающих мышц и др. тканей при низком содержании О2;
глицерол продукт гидролиза жиров в жировой ткани в постабсорбтивный период и при интенсивной физической нагрузке;
аминокислоты образуются в результате распада белков мышц и соединительной ткани и включаются в глюконеогенез при длительном голодании или продолжительной мышечной нагрузке (прим.:культуризм).
Слайд 90Большинство реакций гликолиза и гликонеогенеза
являются обратимыми и катализируются одними
и теми
же ферментами.
Четыре реакции глюконеогенеза необратимы.
В целом синтез глюкозы в
глюконеогенезе можно
свести к двум особенностям:
образование трехуглеродной молекулы и
конденсация двух трехуглеродных молекул в гексозу с последующим преобразованием в глюкозу.
Глюконеогенез энергозатратный процесс.
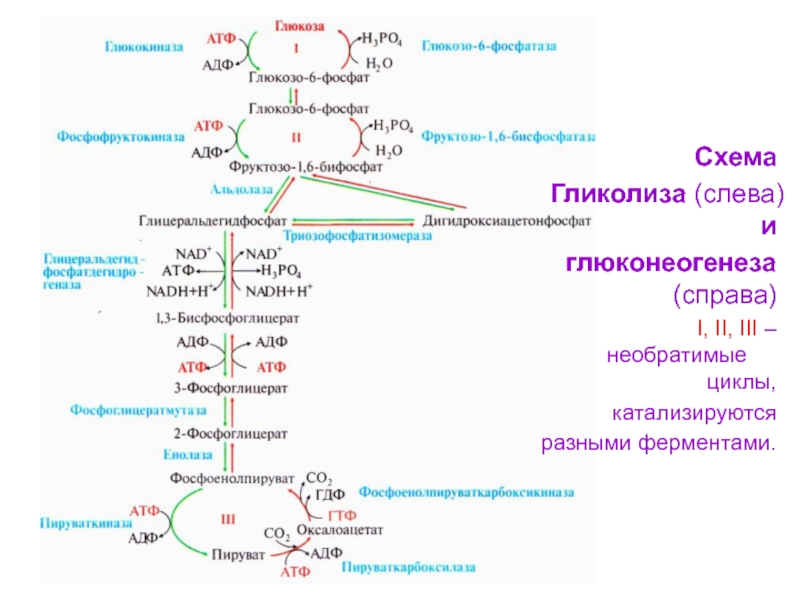
Слайд 91Схема
Гликолиза (слева) и
глюконеогенеза (справа)
I, II, III – необратимые
циклы,
катализируются
разными ферментами.
Слайд 92В митохондриях под действием ферментов
малатдегидроеназы и аминотрансферазы образуется
малат
и аспартат из оксалоацетата (ЩУК), которые
пассивным антипортом удаляется из
митохондрии.
В цитозоле малат и аспартат в результате
соответствующих реакций превращаются в оксалоацетат,
который декарбоксилируется и фосфорилируется под
действием фермента
Фосфоэнеол-пируват-карбокси-киназы с образованием
Фосфоэнолпирувата (ФЭП).
Все остальные реакции протекают в цитозоле.
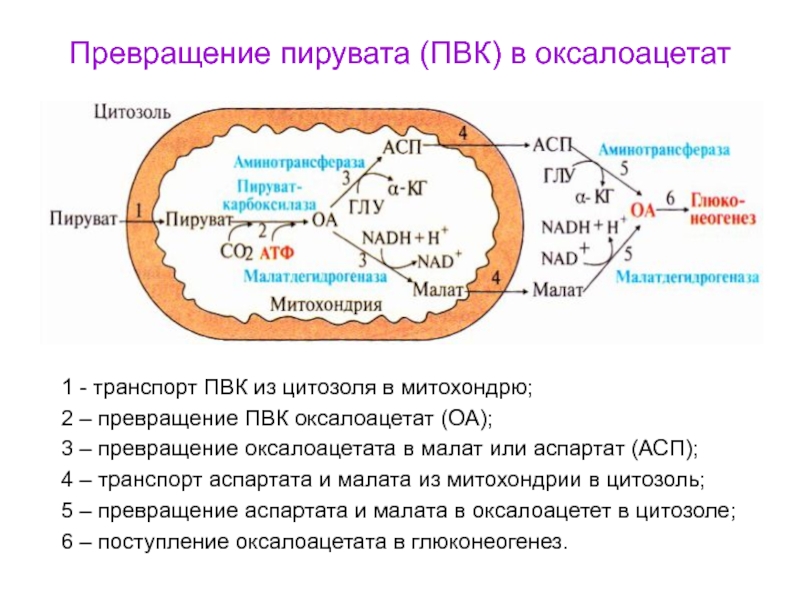
Слайд 93Превращение пирувата (ПВК) в оксалоацетат
1 - транспорт ПВК из цитозоля
в митохондрю;
2 – превращение ПВК оксалоацетат (ОА);
3 – превращение оксалоацетата
в малат или аспартат (АСП);
4 – транспорт аспартата и малата из митохондрии в цитозоль;
5 – превращение аспартата и малата в оксалоацетет в цитозоле;
6 – поступление оксалоацетата в глюконеогенез.
Слайд 94Рис.Суммарное уравнение образования глюкозы из пирувата
Видно, что синтез глюкозы энергозатратный
процесс
Слайд 95Использование лактата в качестве субстрата в
глюконеогенезе связано с транспортом его
в печень и
превращением в ПВК.
В период интенсивного мышечного сокращении в
мышце
ПВК превращается в лактат, при недостатке О2. Лактат из
мышцы кровью транспортируется в печень, где
превращается в ПВК (благодаря хорошему снабжению О2
и высокому содержанию НАД, а затем в глюкозу
(глюконеогенезом). И глюкоза опять с током крови
поступает в мышцы и эритроциты. Эту
последовательность событий назвали глюкозо-лактатным
циклом или циклом Кори.
Слайд 96Цикл Кори
1 – поступление лактата из сокращающейся мышцы и
эритроцитов с током крови в печень;
2, 3 –
синтез глюкозы в из лактата в печени;
4 – поступление глюкозы из печени с током крови в работающую мышцу и в эритроциты;
5, 6 – использование глюкозы как энергетического субстрата сокращающейся мышцей и эритроцитами с образованием лактата.
Слайд 97Часть ПВК, образовавшегося из лактата, окисляется в
печени до СО2
и Н2О. Энергия выделяющаяся при
окислении, используется для синтеза АТФ,
необходимого в процессе глюконеогенеза.
Помимо печени, потребителями лактата и являются почки
и сердечная мышца, где он тоже окисляется до СО2 и Н2О
с образованием АТФ.
В мышцах в покое отношение НАД/НАДН повышается и
лактат превращается в пируват , который будет окисляться
до СО2 и Н2О с образованием АТФ.
Слайд 98Снижение использования лактата в качестве субстрата
в синтезе глюкозы, вызванное
дефектом ферментов
глюконеогенеза, и может приводить к повышению
концентрации молочной
кислоты в крови, понижением
рН и, следовательно, к лактоацидозу.
Кратковременный лактоацидоз встречается довольно
часто даже у здоровых людей при интенсивной
мышечной работе, который компенсируется
гипервентиляцией легких и усиленным выведением СО2.
Н+ + НСО3- = Н2СО3 → Н2О + СО2 ↑
При некомпенсированном лактоацидозе содержание
лактата в крови увеличивается до 5 мМ/л (в норме до –
2мМ/л), значение рН крови может составлять 7,25 и менее
лактоацидоз (в норме рН крови 7,36 -7, 44)
Слайд 99Причиной повышения лактата в крови может быть нарушение метаболизма пирувата
вследствие:
тканевой гипоксии, вызывающей активацию анаэробного гликолиза;
поражений печени (токсические дистрофии, цирроз),
которые приводят к снижению утилизации лактата;
наследственных дефектов ферментов глюконеогенеза;
дефектов ферментов пируватдекарбоксилазного комплекса (ПДК);
гиповитаминозов В1, В2, РР.
Слайд 1003. Пентозофосфатный путь
в метаболизме глюкозы (ПФП)
Это альтернативный путь окиления
глюкозы.
К синтезу АТФ этот путь не приводит.
Этот процесс поставляет
клетке кофермент НАДФН
использующийся в клетке как донор водорода в реакциях
восстановления и гидроксилирования и обеспечивает
клетки рибозо-5-фосфатом (который участвует в синтезе
нуклеотидов и нуклеиновых кислот).
Все ферменты ПФП локализованы в цитозоле клетки.
В ПФП превращения глюкозы можно выделить окислительный
и неокислительный этапы образования пентоз
Слайд 101Кроме того, пентозофосфатный путь поставляет клетке
пентозофосфаты (пентозы) ,
необходимые
для синтеза нуклеиновых
кислот и коферментов (НАД, НАДФ, ФМН и
ФАД, КоА и
активной формы витамина В12).
Все реакции пентозофосфатного пути проходят в цитозоле
клетки.
Реакции неокислительного этапа пентозофосфатного
пути являются обратимыми, поэтому становится
возможным синтез гексоз из пентоз.
Энергию клетке пентозофасфатный путь не поставляет.
Слайд 102В пентозофосфатном пути превращения глюкозы можно
выделить две части:
А
– окислительный этап и
Б – неокислительный этап синтеза пентоз.
Окислительный этап синтеза поставляет клетке 2 основных продукта НАДФН и пентозы.
Неокислительный этап служит для образования пентоз
и может быть обратимым, следовательно, он служит и
для образования гексоз из пентоз
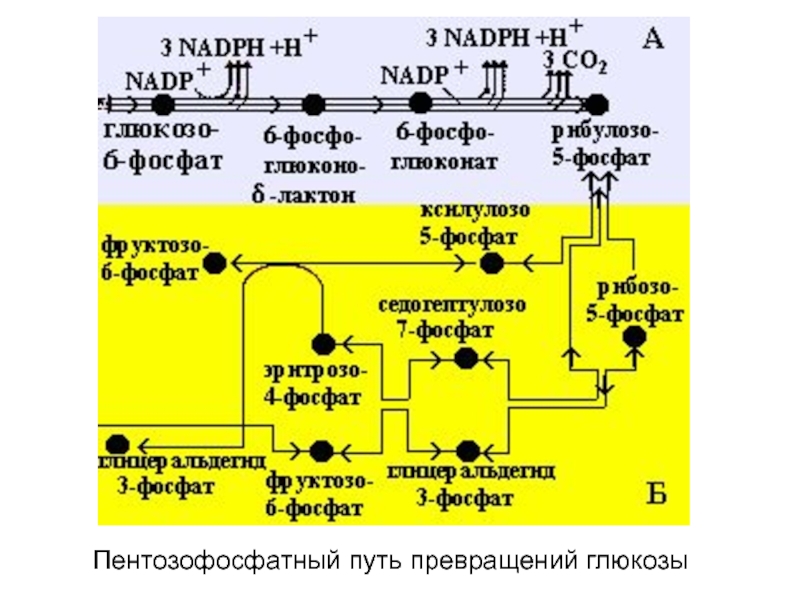
Слайд 103Пентозофосфатный путь превращений глюкозы
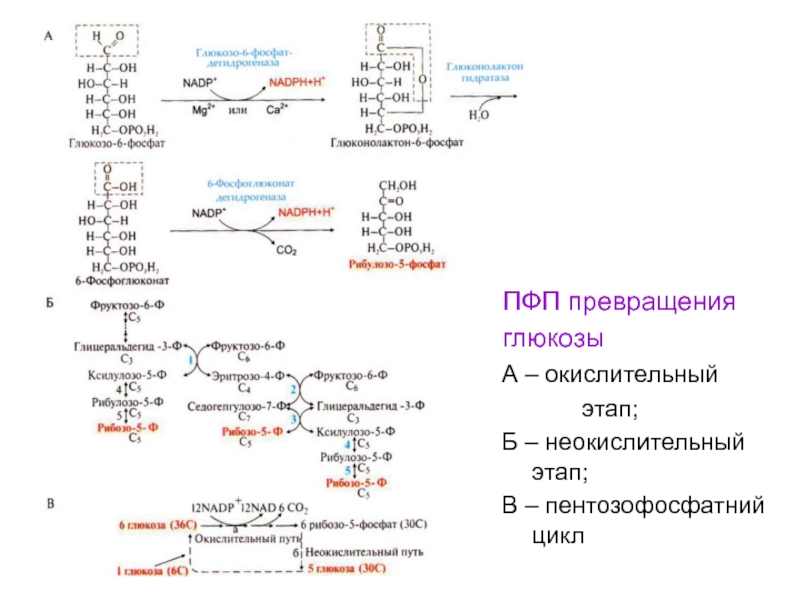
Слайд 104ПФП превращения
глюкозы
А – окислительный
этап;
Б – неокислительный этап;
В – пентозофосфатний
цикл
Слайд 105
Пентозофосфатный путь является
альтернативным путем окисления глюкозы.
Он включает
несколько циклов, в результате
функционирования которых из трех молекул
глюкозо-6-фосфата
образуются три молекулы СО2
и три молекулы пентоз.
Последние используются для регенерации двух
молекул глюкозо-6-фосфата и одной молекулы
глицеральдегид-3-фосфата. Поскольку из двух
молекул глицеральдегид-3-фосфата можно
регенерировать молекулу глюкозо-6-фосфата,
глюкоза может быть полностью окислена при
превращении по пентозофосфатному пути:
Слайд 1063глюкозо-6-фосфат + 6 НАДФ+ →
→ 3СО2 + 2глюкозо-6-фосфат +
глицеральдегид-3-фосфат
+ 6 НАДФ-Н2
Пентозофосфатный цикл не приводит к синтезу АТФ.
Он
выполняет две главные функции:
образование НАДФН для восстановительных синтезов, таких, как синтез жирных кислот и синтез стероидов (в цитоплазме клетки).
2) обеспечение рибозой синтеза нуклеотидов, синтеза нуклеиновых кислот и коферментов.
Слайд 107ПФП в эритроцитах
ПФП в эритроцитах очень важен, так как
восстановленный
НАДФН используется для защиты
клеток от активных форм кислорода.
Антиоксидант –
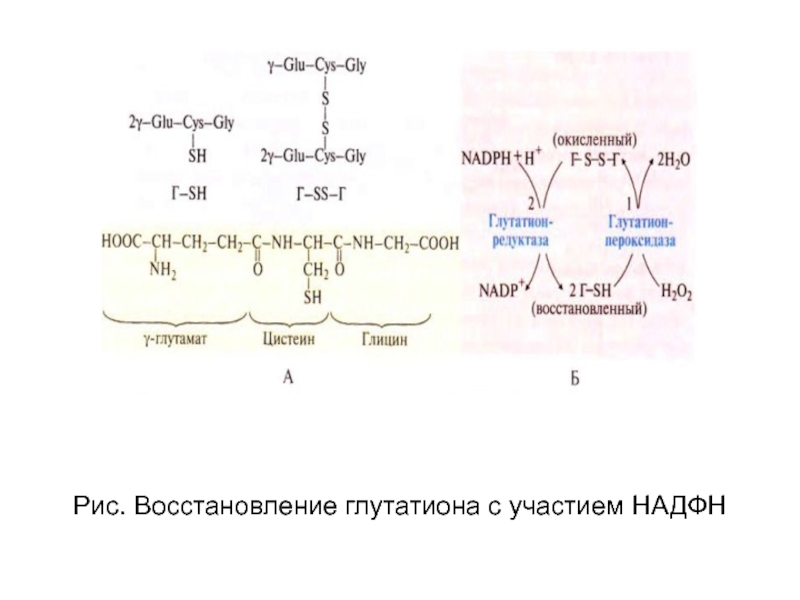
глутатион (ГsH) используется для
превращения перекиси водорода в молекулу воды.
Затем окисленный глутатион должен восстановиться.
Восстановление окисленного глутатиона происходит с
участием восстановленного НАДФН (2 реакция).
1) Обезвреживание перекиси водорода
Н2О2 + ГsH = Н2О + Гs-sГ
2) Восстановление глутатиона:
2НАДФН + Гs-sГ = 2НАДФ + 2ГsН
Слайд 108Дефект первого фермента ПФП
глюкозо-6-фосфат дегидрогеназы приводит к
дефициту НАДФН и
невозможности восстановления
глутатиона.
Это приводит к окислению –SH групп гемоглобина
перекисью,
с последующей агрегацией протомеров
гемоглобина.
Формируются тельца Хейнца.
Из за которых эритроциты теряют пластичность,
необходимую для прохождения через капилляры.
Нарушается целостность мембраны эритроцитов, что
приводит к гемолизу эритроцитов.
Слайд 109Рис. Восстановление глутатиона с участием НАДФН
Слайд 113Общие пути катаболизма
Окисление продуктов окисления глюкозы гликолизом
ПВК в общих
путях катаболизма в митохондриях:
Пируват декарбоксилазным комплексом (ПДК) декарбоксилирование и дегидрирование
с образованием АцКоа.
В цитратном цикле окисление АцКоА до СО2 и Н2О
Слайд 115Окислительное декарбоксилирование пировиноградной кислоты
Суммарный результат многостадийной
реакции выглядит следующим образом:
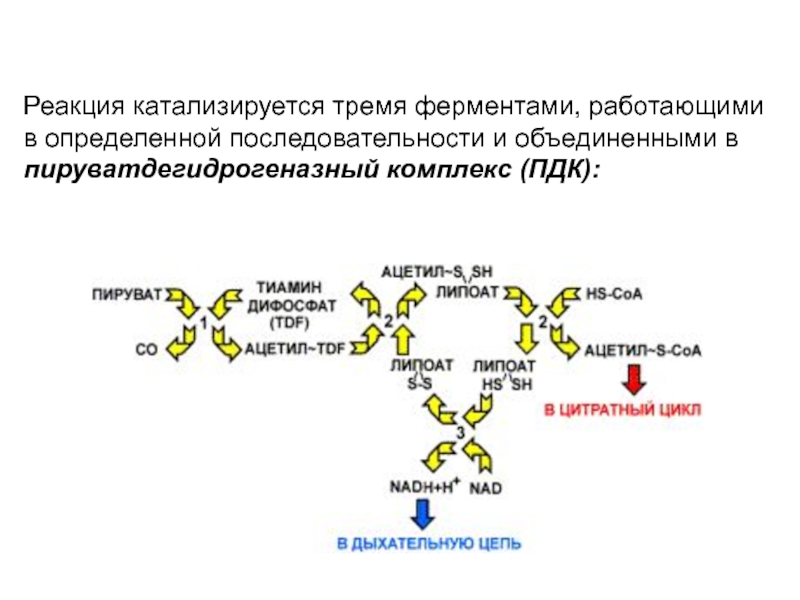
Слайд 116Реакция катализируется тремя ферментами, работающими в определенной последовательности и объединенными
в пируватдегидрогеназный комплекс (ПДК):
Слайд 117Этот комплекс ферментов работает подобно
конвейеру, в котором продукт передается
от
фермента к ферменту. Такой принцип повышает
эффективность работы ферментов, так
как снижает
случайность в контакте реагирующих веществ с
ферментом. М.м. ПДК более 6х1000 000 Да
Далее приводятся названия ферментов и
характеристика катализируемых реакций.
Пируватдекарбоксилаза (1). В качестве кофермента в
реакции участвует тиаминдифосфат - производное
витамина В1.
Фермент катализирует отщепление карбоксильной группы
в виде СО2, а ацетильный остаток присоединяет к
липоевой кислоте - коферменту второго фермента.
Получается ацетил-липоат.
Слайд 118Дигидролипоат-ацетилтрансфераза (2) - второй фермент
комплекса. Катализирует перенос ацетильного остатка,
соединенного с липоевой кислотой на второй кофермент
HS-КоА
с образованием ацетил-КоА.
Таким образом, в этой реакции участвуют два кофермента:
липоевая кислота, прочно соединенная с ферментом, и
кофермент А, объединяющийся с ферментом в момент
реакции. Водород остается связанным с липоевой кислотой,
которая превращается в дигидролипоат.
Слайд 119Дегидрогеназа дигидролипоевой кислоты (3й фермент)
отщепляет водород от липоевой кислоты
и
переносит его на НАД+. Далее водород на НАДН
транспортируется в
дыхательную цепью.
Главные продукты реакции - это
НАДH и ацетил-СоА.
NADH далее окисляется в дыхательной цепи,
где энергия используется на синтез 3 моль АТР, а
ацетил-СоА окисляется в цитратном цикле.
Пируватдекарбоксилазный комплекс находится на
внутренней мембране митохондрий и соединен с
ней со стороны матрикса.
Слайд 120Цикл лимонной кислоты
Цитратный цикл
(цикл Кребса, цикл трикарбоновых кислот (ЦТК)
–
это система реакций, приводящая к полному
окислению двухуглеродного ацетильного
фрагмента
до СО2 И Н2О, имеющего различное
происхождение.
Цитратный цикл является общим конечным путем
окисления белков, жиров и углеводов.
Все реакции цитратного цикла,
как и окислительного декарбоксилирования
пирувата, локализованы в митохондриях.
Слайд 121В ходе одного полного цитратного цикла происходит:
1. полное окисление
ацетильного остатка до двух молекул СО2;
2. образование трех молекул
восстановленного НАДН и одной молекулы ФAДH2;
3. образование одной молекулы ГТФ в результате субстратного фосфорилирования.
Реакции цитратного цикла,
ферменты и их характеристика приведена на
следующем слайде:
Слайд 123Энергетика полного окисления глюкозы в клетке
1. Гликолиз (распад глю до
2х ПВК) – 8 АТФ
2.
Пируват-декарбоксилазный комплекс
2 молекулы ПВК до 2 ацКоа 6 АТФ
3. 2 молекулы АцКоа до СО2 и Н2О 24 АТФ
----------------
Итого: 38 АТФ
Слайд 124Ферменты цитратного цикла
1 – цитратсинтаза,
2 – аконитаза,
3 – изоцитратдегидрогеназа,
4
– a-кетоглутаратдегидрогеназный комплекс,
5 – сукцинил-КоА-тиокиназа,
6 – сукцинатдегидрогеназа,
7 –
фумараза,
8 – малатдегидрогеназа.
Слайд 125Сопряжение общих путей катаболизма с дыхательной цепью
В общих путях катаболизма
происходит
пять реакций дегидрирования:
(одна на стадии окислительного декарбоксилирования
пирувата
и четыре в цитратном цикле).
Все 10 атомов водорода переносятся на коферменты
дегидрогеназ, которые в свою очередь окисляются
в дыхательной цепи. Окисленные коферменты
возвращаются в реакции общих путей катаболизма.
Регенерация коферментов - это обязательное
условие для протекания реакции дегидрирования.
Таким образом, общий путь катаболизма
и дыхательная цепь непрерывно связаны между собой и
отдельно функционировать не могут.
Слайд 126Энергетика цитратного цикла и общих путей катаболизма
За один оборот
цитратного цикла синтезируется
12 молекул АТФ.
Девять из них образуются за
счет энергии транспорта в дыхательной цепи трех пар водорода от трех молекул НАДH + H+.
Две молекулы АТР синтезируются при окислении 1 молекулы FADH2, так как в дыхательной цепи в данном случае действуют только два пункта сопряжения с окислительным фосфорилированием ADP.
Слайд 127Кроме того, в цитратном цикле происходит одна
реакция субстратного фосфорилирования,
дающая 1 моль ГТФ ( аналог АТР).
ИТОГО:
В общих путях катаболизма
синтезируется
15 молекул АТФ.
Три из них при окислительном декарбоксилировании пирувата (в ПДК) и
12 - в цитратном цикле.
Слайд 128 Схема
взаимосвязи
общего пути
катаболизма
и ЦПЭ
Слайд 129
задание на дом:
записать все реакции ПДК и цикла Кребса
Благодарю за
внимание
Слайд 130Использование метаболитов ЦТК в синтезе различных соединений
Слайд 132 Схема
взаимосвязи
общего пути
катаболизма
и ЦПЭ
Слайд 135Мобилизация (распад) гликогена
Происходит в интервалах после приема пищи
(постабсорбтивный период
или постсобтивный период)
и ускоряется после и во время физической работы.
Осуществляется
путем последовательного отщепления
остатков глюкозы, в виде глюкозо-1-фосфата ферментом
гликогенфосфорилазой с затратой молекулы Н3РО4.
В месте разветвления необходимы еще 2 фермента,
которые высвобождают глюкозу в свободном виде.
Гликоген распадается до глю-6-ф и свободной глюкозы
без затрат АТФ.