Слайд 1Химическая кинетика
Скорость химической реакции равна изменению количества реагирующего вещества в
единицу времени в единице реакционного пространства.
Гомогенная реакция – это реакция,
протекающая в одной среде (в одной фазе). Реакционное пространство – объём системы.
Гетерогенная реакция – протекает на границе раздела фаз (твердой и жидкой, твердой и газообразной и т.д.).
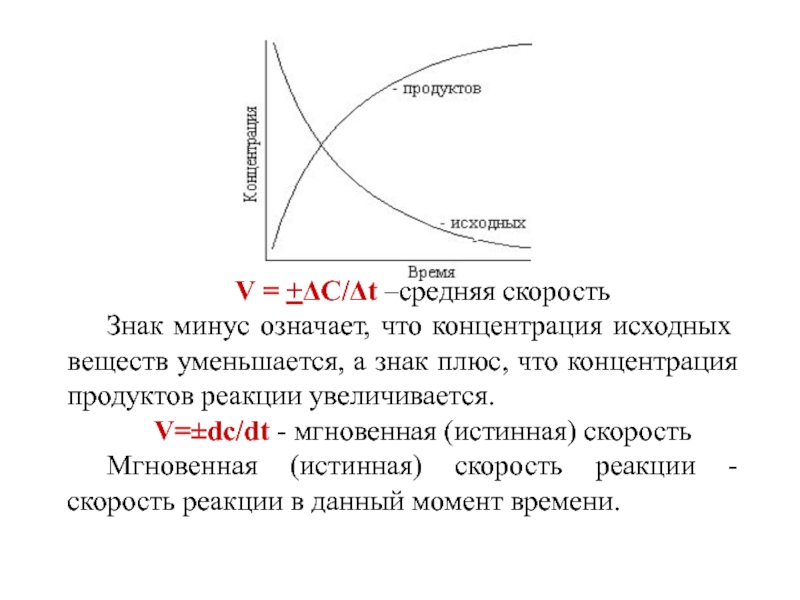
Слайд 2V = +ΔC/Δt –средняя скорость
Знак минус означает, что концентрация исходных
веществ уменьшается, а знак плюс, что концентрация продуктов реакции увеличивается.
V=±dc/dt - мгновенная (истинная) скорость
Мгновенная (истинная) скорость реакции - скорость реакции в данный момент времени.
Слайд 3Молекулярность реакции - число молекул (атомов или ионов) реагента одновременно
участвующих в одном элементарном акте реакции.
Для молекулярной реакции скорость
реакции прямо пропорциональна молярной концентрации вещества.
Для реакции разложения N2О5 скорость равна: V=k·СN2O5.
Слайд 4Для необратимой реакции bB + dD = lL + mM
V
= k·CBnb·CDnd
Это уравнение - кинетическое уравнение химической реакции.
k–константа скорости,
nb
и nd – коэффициенты, называемые порядком реакции по веществам B и D.
Сумма порядков реакции по реагентам называется общим порядком реакции n=nb+nd.
Физический смысл константы скорости реакции: она числено равна скорости реакции при единичных концентрациях реагирующих веществ.
Константа скорости не зависит от концентрации реагентов, но зависит от их природы и температуры.
Слайд 5Если реакция bB + dD = lL + mM протекает
в одну стадию, то nb =b и nd = d.
Тогда кинетическое уравнение имеет вид:
V = k·СBb·CDd.
Это уравнение является математическим выражением закона действующих масс.
Закон действующих масс:
Скорость реакции прямо пропорциональна произведению концентраций реагентов, возведенных в степени, равные коэффициентам в уравнении лимитирующей стадии, сумма которых равна порядку реакции.
Слайд 6Реакции первого порядка
Кинетическое уравнение имеет вид: V = k·С.
Приравняв
V=-dс/dt и V = k*С, получаем:
dс/с=-k·dt.
Отсюда k=ln(с0/с)/t, т.к.
ln(с0/с) безразмерен, то единицы измерения k [с-1].
Период полупревращения t ½ не зависит от концентрации и является эквивалентом константы скорости.
t ½=ln2/k = 0693/k.
Слайд 7Реакции второго порядка
Кинетическое уравнение V=k·СВ·СD.
Если СВ=СD или реагируют одинаковые частицы,
то V=kc2.
dc/с2=-k·dt
Единицы измерения константы скорости
[моль·л –1·с –1].
Период полупревращения зависит от концентрации. t ½=1/kc0.
Слайд 8Зависимость скорости реакции от времени
Слайд 9Гетерогенные реакции
Скорость реакции зависит от площади реакционной поверхности (S): V
= k*C*S.
Концентрация твердого вещества не входит в кинетическое уравнение. Её
принимают постоянной и равной 1.
СаО+СО2 →СаСО3 V=kCСО2·S.
Удельная скорость реакции – скорость, отнесенная к единице реакционной поверхности: VS = V/S = kC (моль/сек*м2).
Слайд 10Скорость гетерогенной химической реакции зависит от скорости подвода реагентов в
зону химической реакции.
Скорость диффузии VД в наиболее простом виде
описывается уравнением:
VД = D(CV – CS)S/δ
D – коэффициент диффузии, м2/сек,
D – зависит от вязкости реакционной среды, т.е. от природы растворителя и реагентов, а также от температуры.
- толщина диффузионного слоя.
δ уменьшается при перемешивании, соответственно, перемешивание увеличивает скорость подвода реагентов.
Слайд 11VД>>V - реагенты без проблем подаются в реакционное пространство -
кинетический контроль реакции.
VД=V - смешанный контроль.
VД
реакции. Наблюдается нулевой порядок реакции. В координатах V-C скорость не зависит от концентрации, а зависит от скорости диффузии, величины поверхности и температуры.
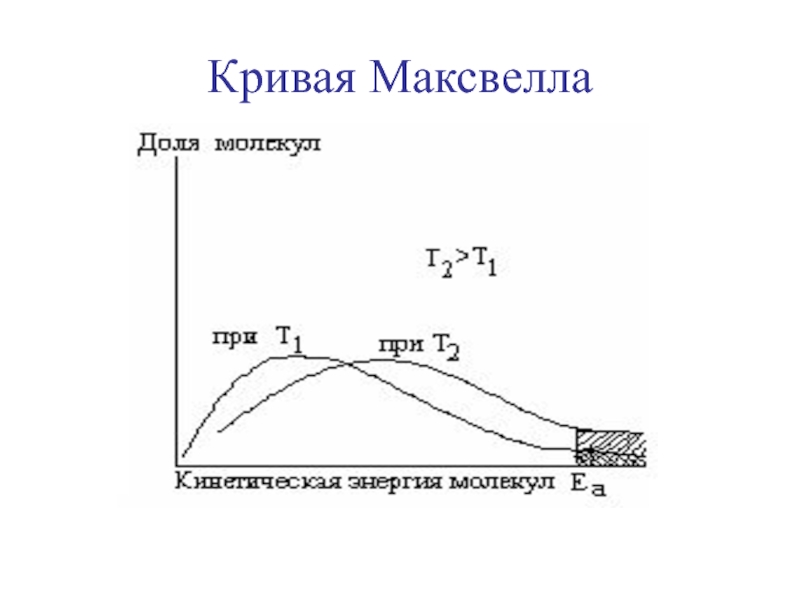
Слайд 12Зависимость константы скорости реакции от температуры
Правило Вант-Гоффа:
скорость реакции ускоряется
в 2-4 раза при повышении температуры на 100С (γ =
2-4).
υ2=υ1 · γΔT/10
γэндотерм > γэкзотерм
А
В
+ → : : → ⏐ + ⏐
Д⎯С Д……С Д С
Исходные Активированный Продукты
соединения комплекс реакции
Активированный комплекс - промежуточное соединение молекул, атомов, ионов реагентов, находящихся в возбужденном состоянии и, поэтому являющийся неустойчивым.
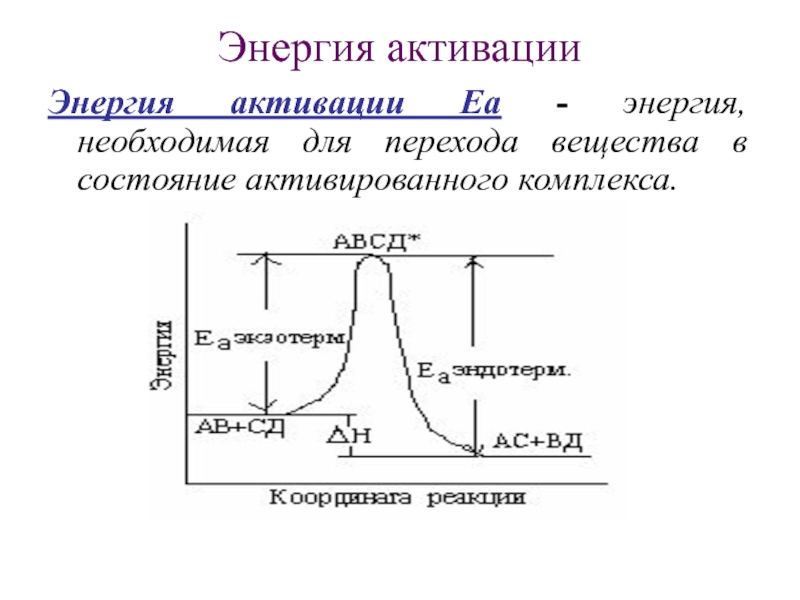
Слайд 14Энергия активации
Энергия активации Еа - энергия, необходимая для перехода вещества
в состояние активированного комплекса.
Слайд 16Уравнение Аррениуса :
экспоненциальная и
логарифмическая
k =
A·e‑Ea/RT lnk = - Ea/RT + lnA
При двух температурах:
lnk1 = - Ea/RT1+lnA ln k2 = - Ea/RT2+lnA
ln (k2/k1) = Ea/R(1/T2-1/Т1)
γ = k2/k1 при ΔТ = 10 К
Для γ = 2-4 при >300 К Еа = 57-114 кДж/моль.
Это соответствует значениям для большинства реакций.
При температурах 500 К таким значениям γ соответствуют Еа=236-472 кДж/моль, при таких энергиях активации реакции не протекают.
Уравнение Вант-Гоффа – приблизительное, справедливо при температурах близких к комнатным,
Уравнение Аррениуса справедливо во всем диапазоне температур.
Слайд 17Физический смысл предэкспоненциального множителя: Величина А соответствует такой (максимальной) скорости
реакции, когда Еа равна нулю, то есть в каждом столкновении
энергия сталкивающихся молекул достаточна, чтобы прошла реакция.
А=P*Z
Z–число столкновений частиц,
Р – стерический фактор реакции, связанный с энтропией активации.
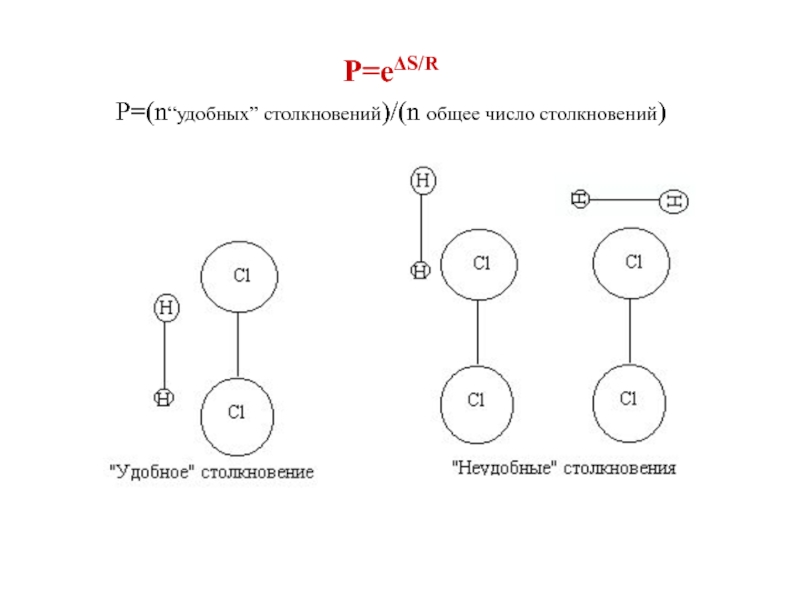
Слайд 18P=eΔS/R
Р=(n“удобных” столкновений)/(n общее число столкновений)
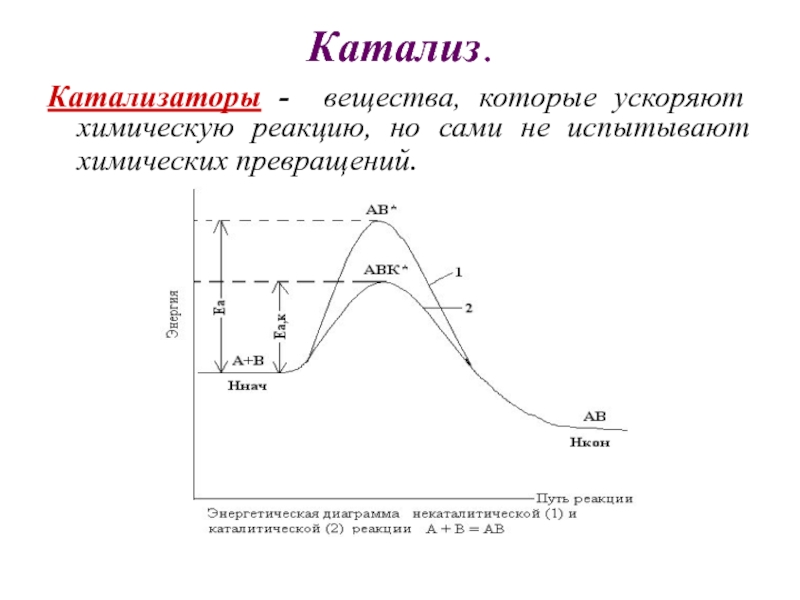
Слайд 19Катализ.
Катализаторы - вещества, которые ускоряют химическую реакцию, но сами
не испытывают химических превращений.
Слайд 20Виды катализа
Гомогенный – катализатор находится в системе в том же
фазовом состоянии, что и реагенты.
Механизм катализа: катализатор образует с
реагентами промежуточное соединение, разложение которого является лимитирующей стадией.
Разложение перекиси водорода, катализируемая солями йода:
H2O2(ж) +I- → H2O(ж) +IO-
IO- + H2O2(ж) → H2O(ж) + O2 +I-
Слайд 21Гетерогенный – катализатор и реагенты находятся в разных фазах и
имеют границу раздела.
Механизм:
Kat Kat
Адсорбция С2Н4 = С2Н4адс. и Н2 = 2Надс.
Десорбция С2Н4адс. + 2Надс. = С2Н6.
Высокая эффективность, селективность, технологичен: можно легко менять, регенерировать катализаторы .
Слайд 22Ферментативный катализ.
Наиболее эффективный вид катализа. Ферменты подходят к перерабатываемым
молекулам, как ключ к замку – точно по форме вырезов.
Ферментативный катализ протекает без нагревания при температурах 36-370С, быстро и селективно.
Энергии активации ферментативных реакций близки к нулю.
Слайд 23Катализатор резко ускоряет реакцию.
Реакция разложения 2HI→H2+I2 имеет следующие скорости:
Некатализируемая:
Еа = 168 кДж/моль Vотносит
= 1
Катализатор – золото
Еа = 105 кДж/моль Vотносит = 3*105
Катализатор – платина
Еа = 59 кДж/моль Vотносит = 1*1011
Слайд 24Промоторы катализа - вещества, которые сами не являются катализаторами, но
добавление к их в реакционную катализируемую систему резко повышает скорость
реакций.
Скорость окисления 2SO2 + O2 → 2SO3 на оксиде ванадия V2O5 возрастает в сотни раз при добавлении к катализатору Na2SO4, K2SO4, которые сами катализаторами не являются.
Существуют каталитические яды. Так, соединения мышьяка, сурьмы, серы отравляют катализаторы гидрирования (Pt, Pd).
Слайд 25Классификация химических реакций
Простые - протекают в одну стадию и
называются одностадийными.
Порядок реакции совпадает с молекулярностью, а кинетическое уравнение
с законом действующих масс.
Сложные – идут либо последовательно (многостадийные), либо параллельно, либо последовательно параллельно.
Состоят из ряда простых элементарных стадий, которые протекают по одно-, двух-, или трех молекулярному механизму. Поэтому реакции могут иметь разную молекулярность.
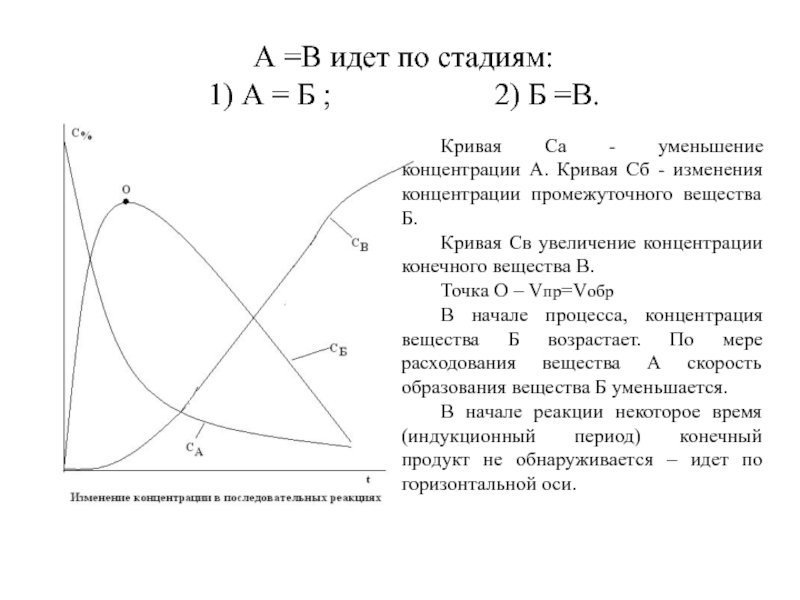
Слайд 26 А =В идет по стадиям:
1) А = Б
;
2) Б =В.
Кривая Са - уменьшение концентрации А. Кривая Сб - изменения концентрации промежуточного вещества Б.
Кривая Св увеличение концентрации конечного вещества В.
Точка О – Vпр=Vобр
В начале процесса, концентрация вещества Б возрастает. По мере расходования вещества А скорость образования вещества Б уменьшается.
В начале реакции некоторое время (индукционный период) конечный продукт не обнаруживается – идет по горизонтальной оси.
Слайд 27Скорость химической реакции определяется наиболее медленной стадией, эта стадия лимитирующая.
2
N2О5 = 4 NО2 + О2 протекает через стадии:
N2О5↔NО2+NО3 (
быстрая) мономолекулярная
NО2+NО3→NО2+NО+О2 (медленная ) бимолекулярная
NО2 + NО3 ↔ 2 NО2 (быстрая) бимолекулярная
NО2 и NО3 –интермедиаты, скорость их образования равна скорости их расходования.
Скорость лимитирующей стадии равна скорости всего процесса, следовательно, V = k*СN2О5.
Порядок реакции равен 1 и меньше суммы стехиометрических коэффициентов (2).
Слайд 28Реакции, которые могут идти двумя параллельными путями с образованием различных
продуктов реакции называются параллельными.
Разложение гидразина может протекать:
N2Н4=N2+2Н2
или 3N2Н4=4NН3+N2.
Скорость реакции рассчитывается по двум путям и суммируется.
Слайд 29А→Б Для 1-ой реакции
КБ и ЕаАБ; ΔНАБ,
↓
В
для 2-ой реакции КВ, ЕаАВ, ΔНАВ.
Кинетические уравнения для каждой реакции:
υБ=КБСА υВ=КВСА
Суммарная скорость расходования вещества А:
υ=-dс/dt=υБ+ υВ=КБСА+КВСА=СА(КБ+КВ)
После интегрирования (КБ+КВ)=(1/t)lnCоА/СА;
СоА -концентрация в исходный момент времени;
СА-в любой момент времени.
Если быстрая стадия А→Б, т.е. КБ>>Кв, то:
КБ=(1/t)lnСоА/СА.
Константа скорости: КБ=Ае-Еа,Б/RТ
Осуществляется стадия, имеющая более низкое значение энергии активации.
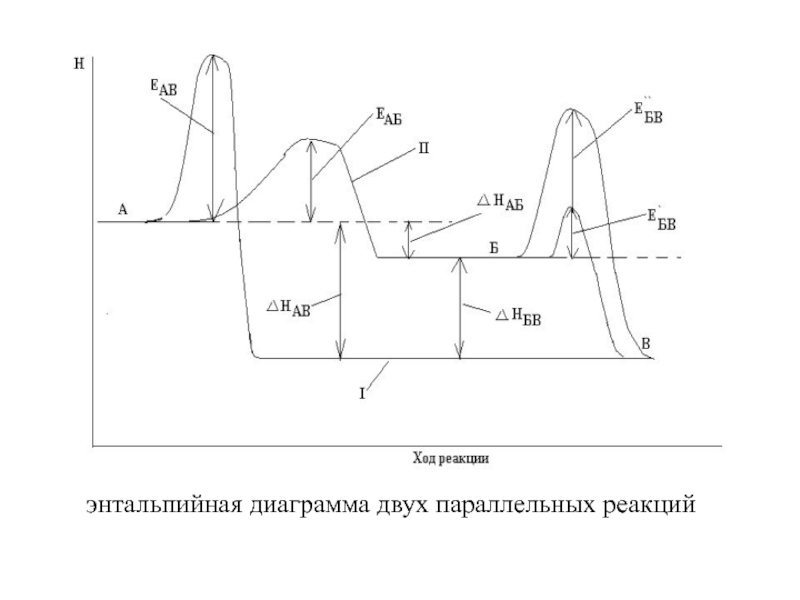
Слайд 30энтальпийная диаграмма двух параллельных реакций
Слайд 31Если ЕаАВ>ЕаАБ, а ΔНАВ>ΔНАБ, термодинамически более вероятно образование вещества В,
но из-за меньшего значения энергии активации образуется вещество Б.
Если
энергия ЕаАБ<<ЕаАВ, в качестве продукта реакции получается практически чистое вещество Б, которое термодинамически неустойчиво.
Если ЕаАВ≈ЕаАБ, то в начале реакции получается смесь продуктов Б и В, количество которых определяется соотношением энергий активаций АВ и АБ.
Вещество Б неустойчиво и может превращаться в более устойчивое вещество В.
Слайд 32Если с одним и тем же реагентом одновременно взаимодействуют два
или более вещества, то такие реакции называются сопряженными.
Сопряжение реакций
может вызывать их ускорение.
Реакция НВrО3 с НАsО2 ускоряется при одновременном протекании реакции НВrО3 с НВr.
Сопряжение влияет на термодинамику процессов.
А+В = АВ; ΔG1>0 и А + Д = АД; ΔG2<0
│ΔG2│>|ΔG1│, то в этих условиях возможно протекание первой реакции, т.к. суммарная ΔG будет ниже нуля:
2А+В+Д=АВ+АД; ΔG<0.
Слайд 33Цепные реакции
Их скорость зависит от формы, материала и объёма
сосуда, при определенных условиях реакция ускоряется лавинообразно
Механизм реакции
Зарождение цепи (инициирование)
- образование свободных радикалов. Инициирование бывает фотохимическим, термическим или химическим, с помощью химических веществ – инициаторов.
Cl2 + hν → Cl* + Cl*
Слайд 34Развитие цепи
H2 + Cl* → HCl + H*;
H* + Cl2 → HCl + Cl*
Обрыв цепи (рекомбинацией радикалов)
- взаимодействие радикалов со стенками сосудов или инертными молекулами с образованием нейтральных молекул.
Cl* + Cl* → Cl2;
H* + Cl* → HCl
Слайд 35Фотохимические реакции
Протекают под действием квантов света.
Первый закон фотохимии:
фотохимически
активным является лишь поглощенный свет.
Второй закон фотохимии: каждый поглощенный
фотон вызывает первичное фотохимическое изменение лишь одной молекулы.
Число молекул, прореагировавших при поглощении одного кванта света, называется квантовым выходом.
Слайд 36Использование фотохимических реакций
1) фотосинтез:
6СО2+6Н2О+hν→C6H12O6+6O2 ΔH0298= 2815
кДж
2) фотографирование:
2AgBr +2hν→ 2Ag + Br2
Слайд 373) фотохимических реакций в верхних слоях атмосферы:
Образование озонового слоя:
λ=241нм мягкое УФ - излучение:
O2+hν→2O
О+О2→О3*
О3*+О2→О3+О2*
О3*+N2→О3+N2*
Слайд 38Расходование озонового слоя:
1) λ=80-240нм жесткое УФ - излучение
O3+hν →O2+О
Слайд 39
2) Попадание в атмосферу фреонов – хлорфторметанов, используемых как теплоносители
в бытовых и промышленных холодильниках.
CCl2F2 +hν → CClF2* + Cl*
Cl* + O3 → ClO* + O2
ClO* + O → Cl* + O2
Элементарный хлор, получаемый при фотодиссоциации фреонов выступает как катализатор разрушения озона.