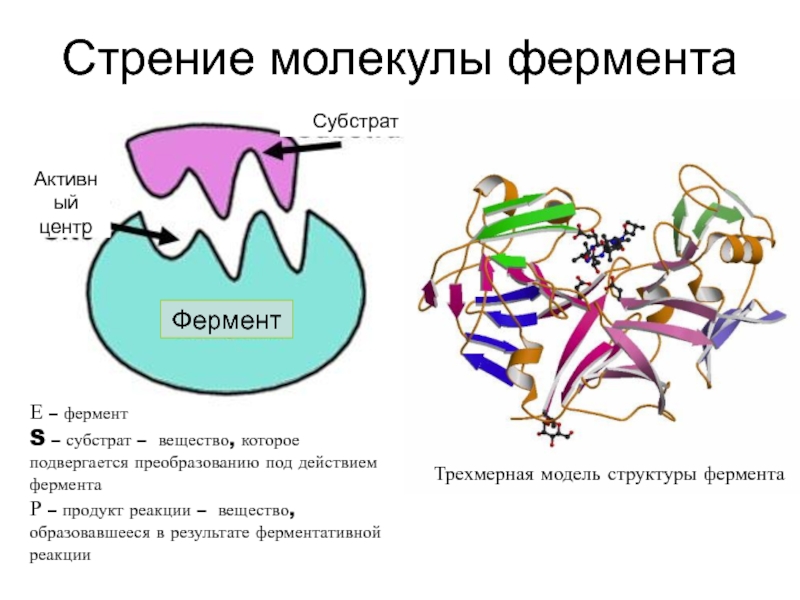
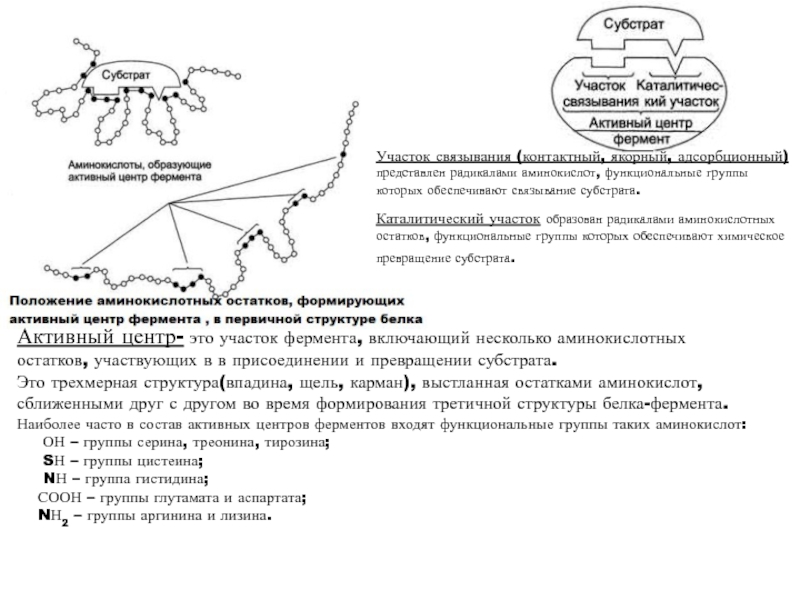
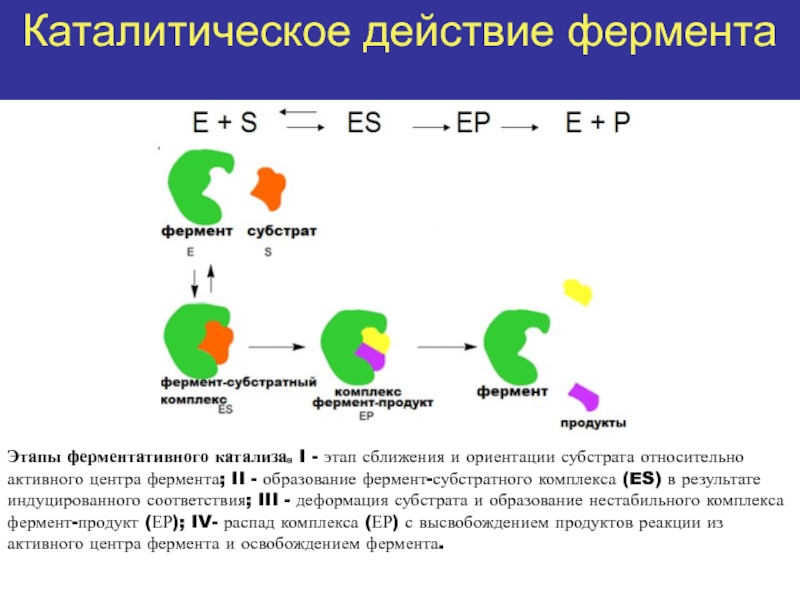
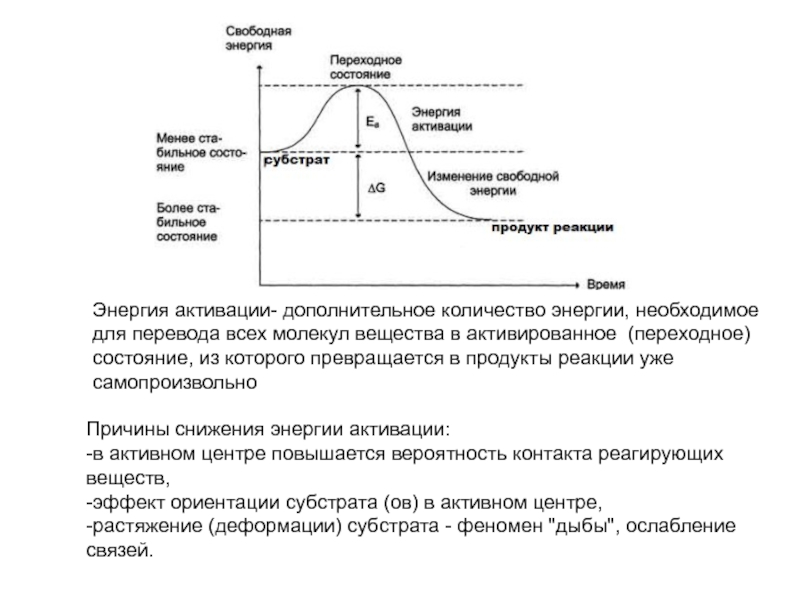
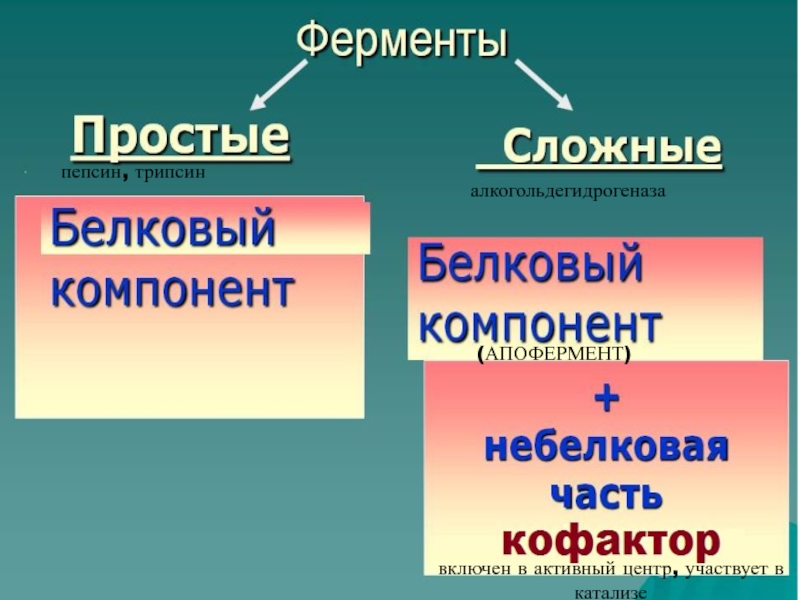
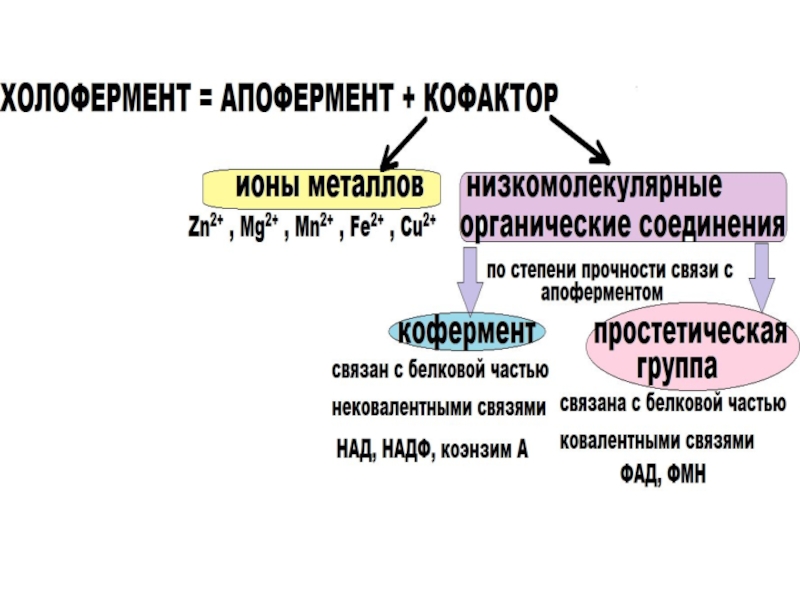
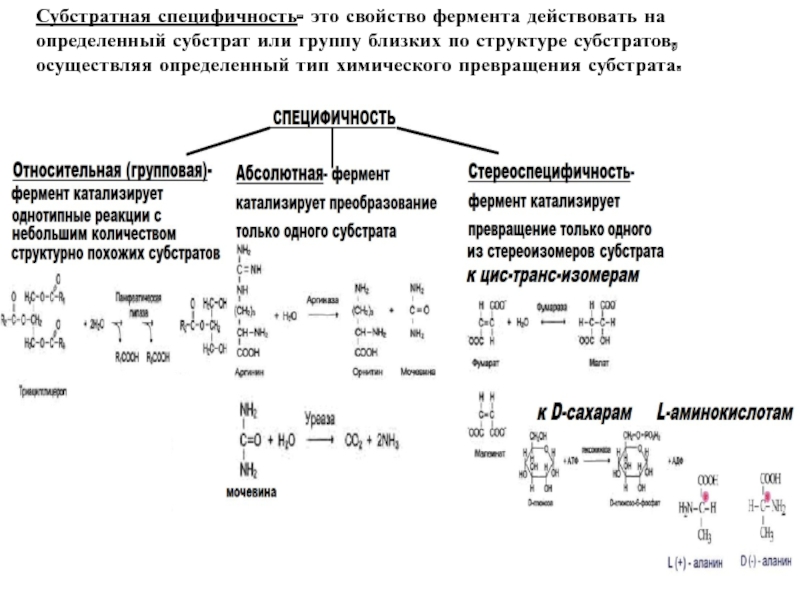
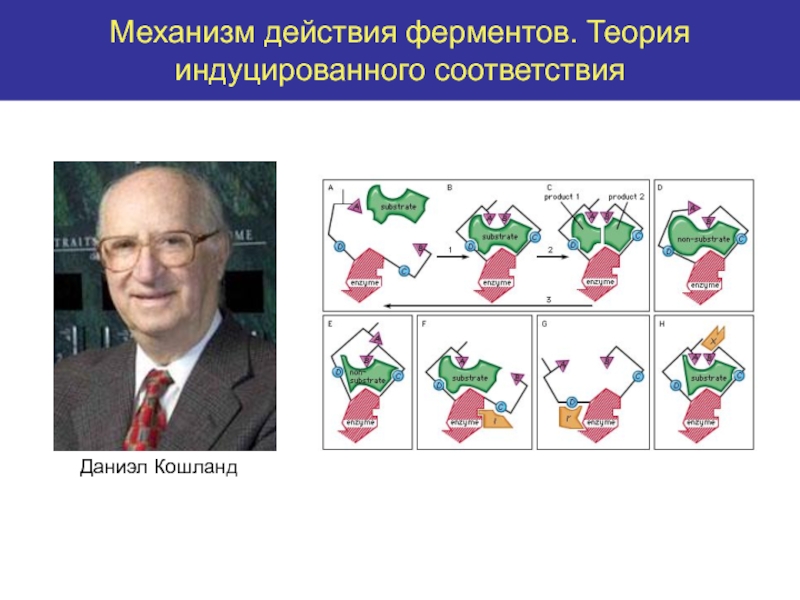
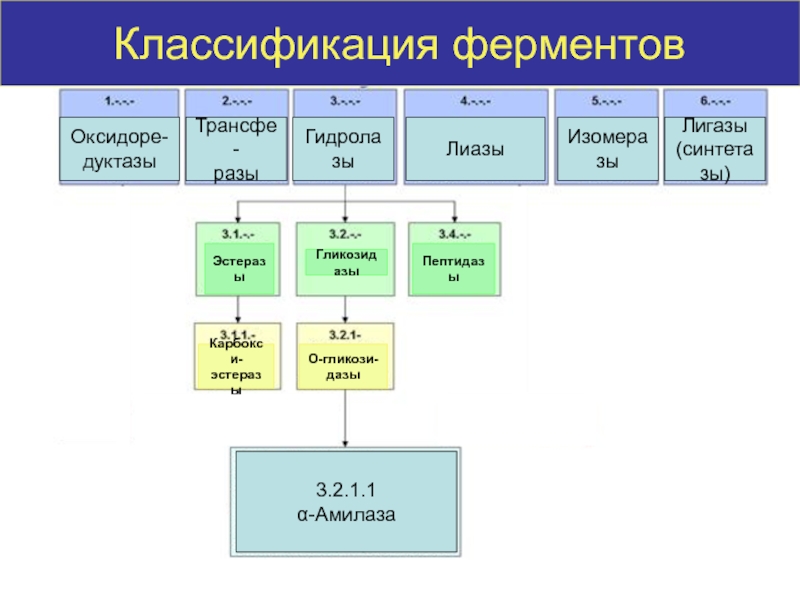
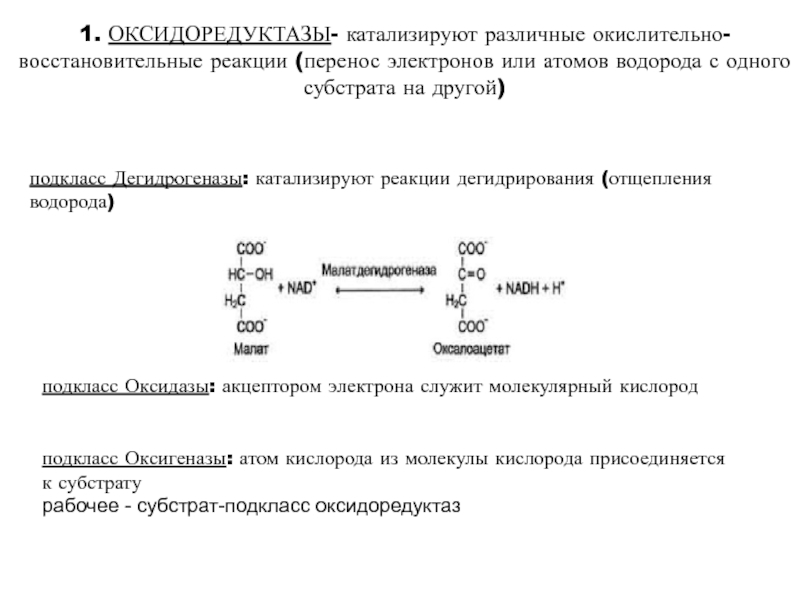
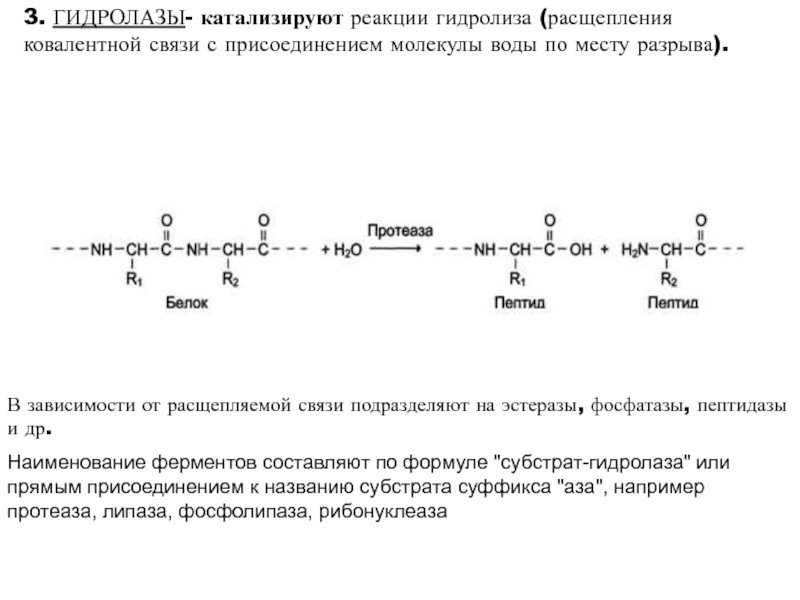
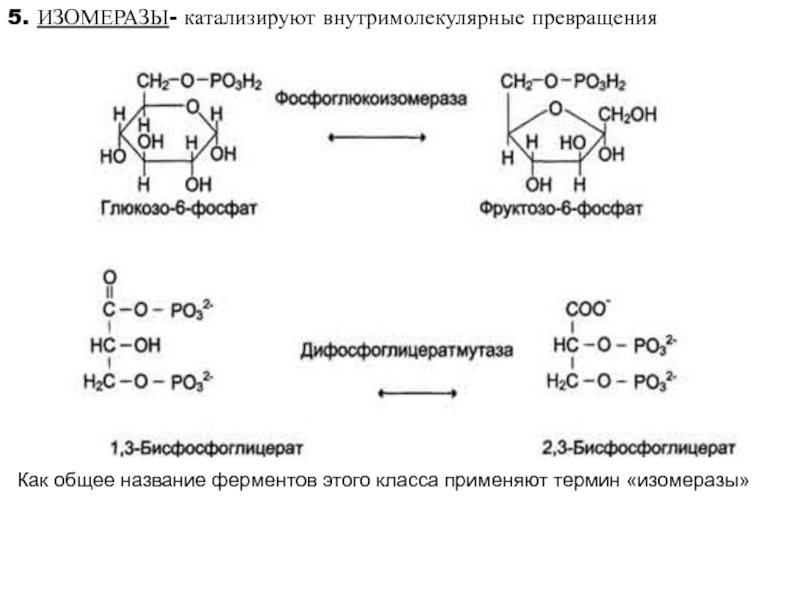
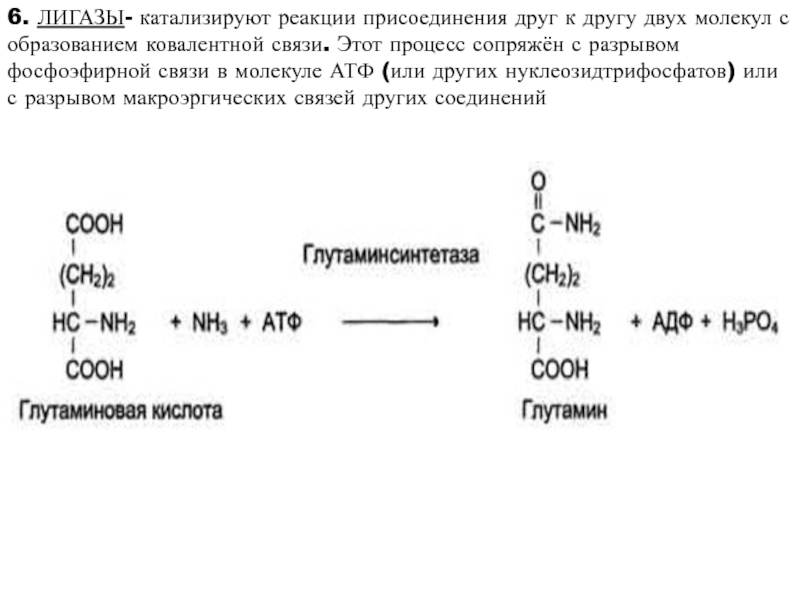
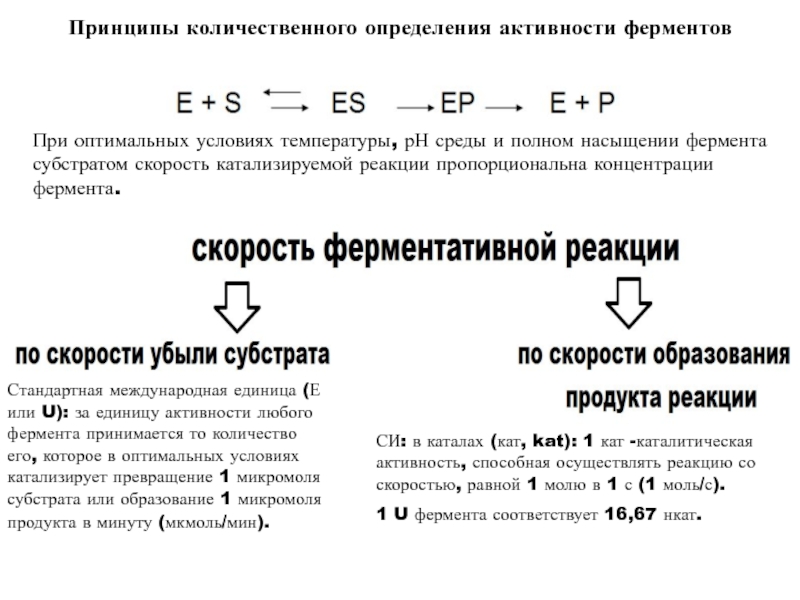
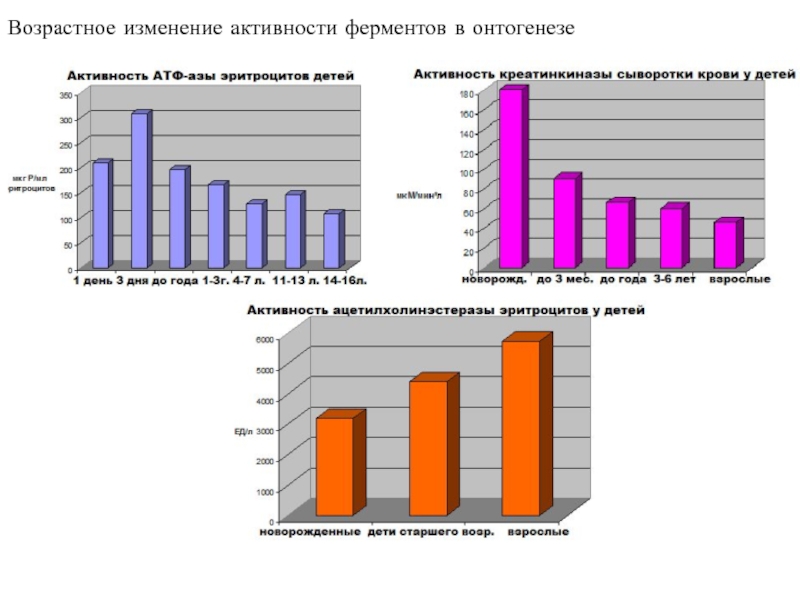
высокой скоростью различных химических реакций
Слово ≪фермент≫ происходит от слова ≪fermentatio≫
- брожение, а энзим – от ≪enzyme≫, что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией. КИРХГОФ
Константин Сигизмундович
(1764 –1833)
русский химик
1814г.- показано, что солод ячменя вызывает брожение крахмала
Джеймс Бэчеллер Самнер
(1887–1955)
американский химик
1926- очищен и выделен фермент уреаза