Слайд 1Классификация ферментов. Применение ферментов в медицине.
Слайд 2Номенклатура ферментов
название субстрата,
реакция, катализируемая ферментом,
аза – окончание.
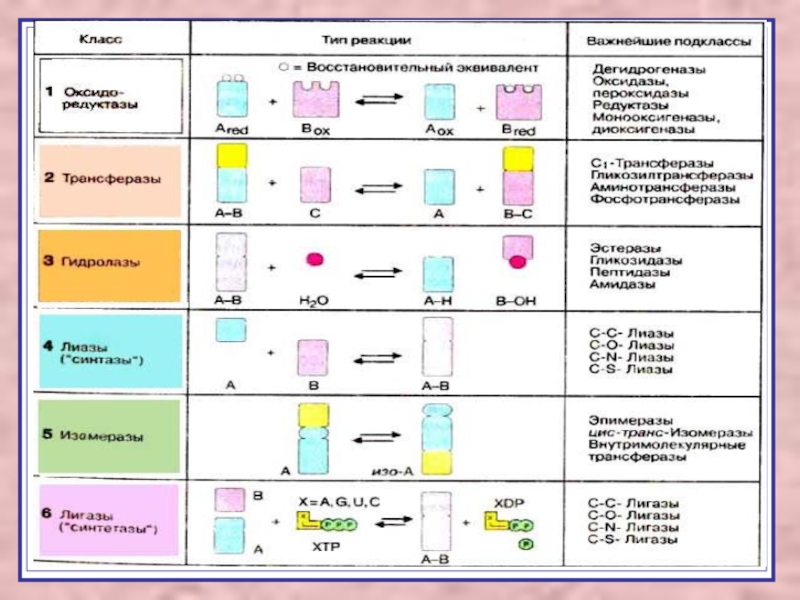
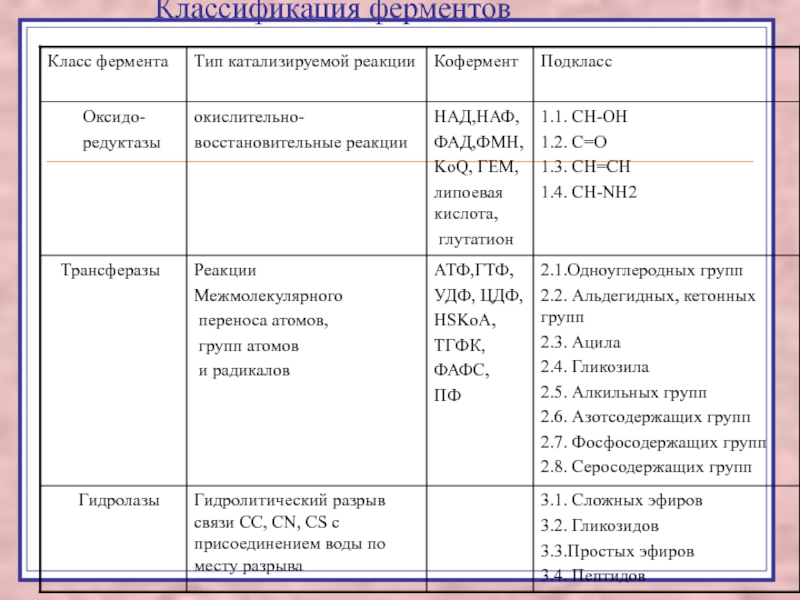
Слайд 3В основе классификации лежит тип катализируемой реакции.
Оксидоредуктазы катализируют
окислительно-восстановительные реакции.
Трансферазы - реакции с переносом групп.
Гидролазы - гидролитический разрыв связи СС, СN, СS с присоединением воды по месту разрыва.
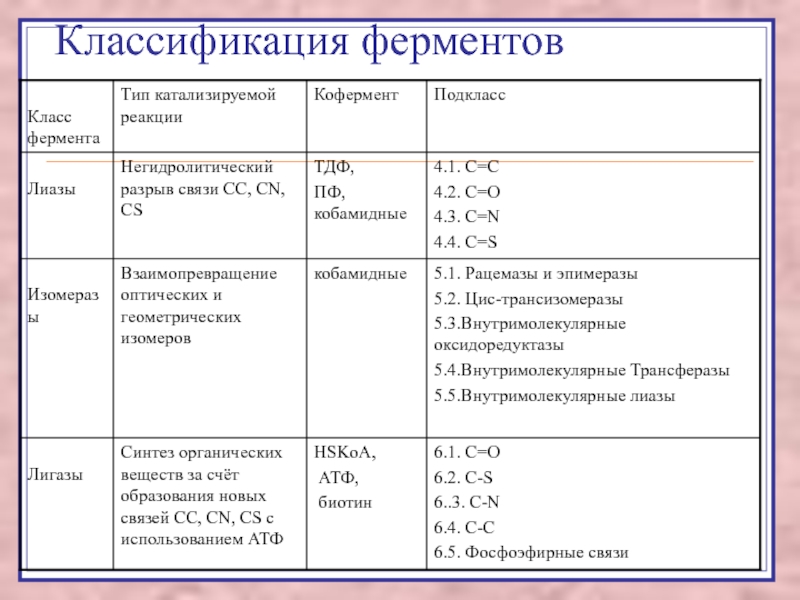
Лиазы – реакции негидролитического расщепления с образованием двойных связей, некоторые обратные реакции синтеза.
Изомеразы – перенос групп внутри молекулы с образованием изомеров.
Лигазы катализируют соединение двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ.
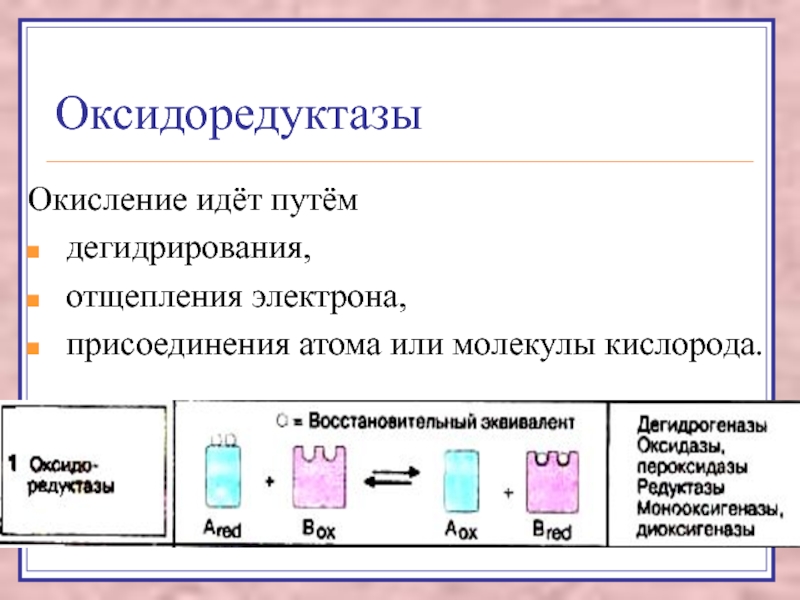
Слайд 5Оксидоредуктазы
Окисление идёт путём
дегидрирования,
отщепления электрона,
присоединения
атома или молекулы кислорода.
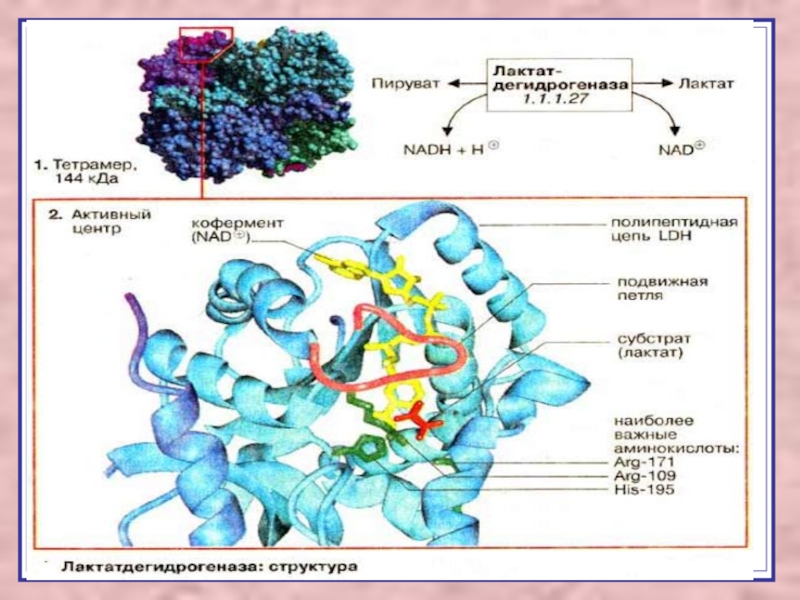
Слайд 6Шифр фермента ЛДГ- 1.1.1.27
Подкласс определяется строением группы донора протонов
и электронов.
1.1. -СН-ОН
Подподкласс определяется характером акцептора протонов и
электронов (НАД, кислород).
1.1.1. -НАД
Порядковый номер фермента ЛДГ - 27.
Слайд 8Оксидазы
отщепляют водород от субстрата и передают на кислород воздуха,
содержат
ионы меди, в результате продуктом реакции является вода,
цитохромоксидаза,
тирозиназа.
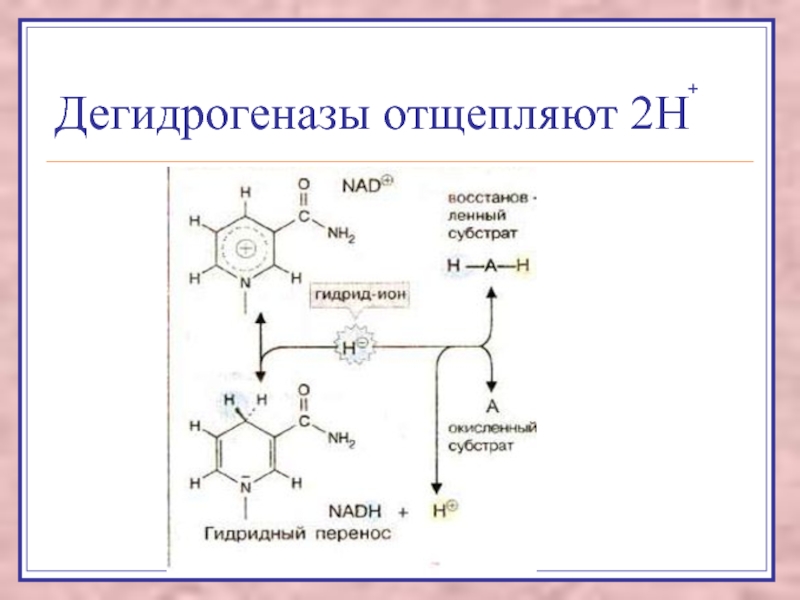
Слайд 9Аэробные дегидрогеназы -флавопротеины
удаляют водород от субстрата,
акцептором водорода может
быть кислород и искусственные акцепторы,
оксидазы L-аминокислот,
ксантиноксидаза,
альдегидДГ (ФАД).
Слайд 10Анаэробные дегидрогеназы
удаляют водород из субстрата и передают акцептору (но не
кислороду).
НАД-зависимые ДГ катализируют
окислительно-восстановительные
реакции окислительных
путей метаболизма (гликолиз, ЦТК,дыхательная цепь),
НАДФ-зависимые ДГ
участвуют в процессах
восстановительного синтеза
и пентозном цикле.
Редуктазы присоединяют 2 протона водорода к субстрату.
Слайд 11Оксигеназы
катализируют введение кислорода в молекулу субстрата.
Монооксигеназы (гидроксилазы).
Кофермент –
донор водорода
(НАДФН2, аскорбиновая кислота, ТГФК).
Диоксигеназы.
Слайд 12Трансферазы
Коферменты трансфераз:
ФП,
ТГФК,
АТФ,
ФАФС,
АДФ
Слайд 13Подкласс определяется типом переносимой группы
2.1. – одноуглеродные остатки,
2.6.
– азотистые группы.
Подподкласс уточняет тип переносимой группы:
2.6.1. –
аминотрансферазы,
2.6.1.2. – АЛТ.
Слайд 14Трансферазы
фосфотрансферазы,
аминотрансферазы,
гликозилтрансферазы,
ацилтрансферазы,
переносчики одноуглеродных частиц,
переносчики кетонных
и альдегидных групп.
Слайд 16Подкласс определяется типом расщепляемой связи
3.1. – сложноэфирные,
3.2.
– гликозильные,
3.4. – пептидные.
Подподкласс уточняет тип связи:
3.1.1. –
эфиры карбоновых кислот.
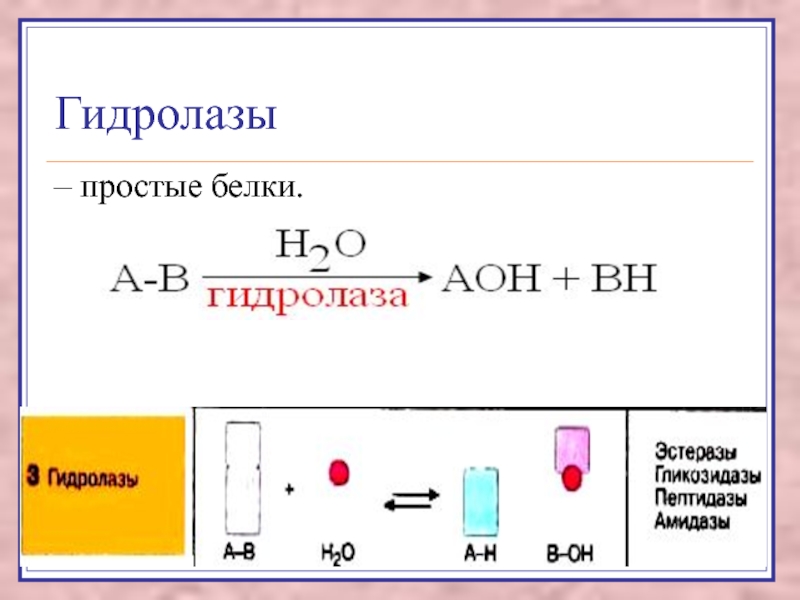
Слайд 17В класс гидролаз входят
пептидогидролазы,
эстеразы,
гликозидазы.
Слайд 18Пептидогидролазы
аминопептидазы,
карбоксипептидазы,
дипептидазы,
протеиназы (пепсин, трипсин, папаин).
Слайд 19Эстеразы расщепляют эфиры.
карбоксиэстеразы (липаза),
фосфоэстеразы (КФ, ЩФ),
сульфоэстеразы.
Гликозидазы
катализируют гидролиз гликозидов.
Слайд 20Лиазы
могут быть простыми и сложными белками.
Коферменты: ТПФ, ФП.
Слайд 21Подкласс определяется типом расщепляемой связи
4.1. расщепляют связь C-C,
4.2. расщепляют связь C-O,
4.3. расщепляют связь C-N,
4.4. расщепляют
связь C- S,
4.5. расщепляют связь C-Cl.
Подподкласс расшифровывает тип связи.
Слайд 22Примеры лиаз
фумараза,
альдолаза,
дегидратаза,
цитратсинтаза.
Слайд 23Изомеразы катализируют взаимопревращения изомеров
цис-транс-изомеразы,
мутазы,
триозофосфатизомераза катализирует взаимопревращение альдоз
и кетоз.
Подкласс определяется характером изомерных превращений.
Подподкласс уточняет тип реакции изомеризации.
Слайд 24Лигазы
Лигазы катализируют соединение
двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ.
В ходе реакции образуются связи C-O, C-S, C-N, C-C.
Подкласс определяется типом синтезируемой связи.
Примеры лигаз: глутаминсинтетаза,
ацетилКоА-карбоксилаза.
Слайд 27 Широкое использование определения активности ферментов во всём мире представляет
собой одно из наиболее важных достижений современной медицины.
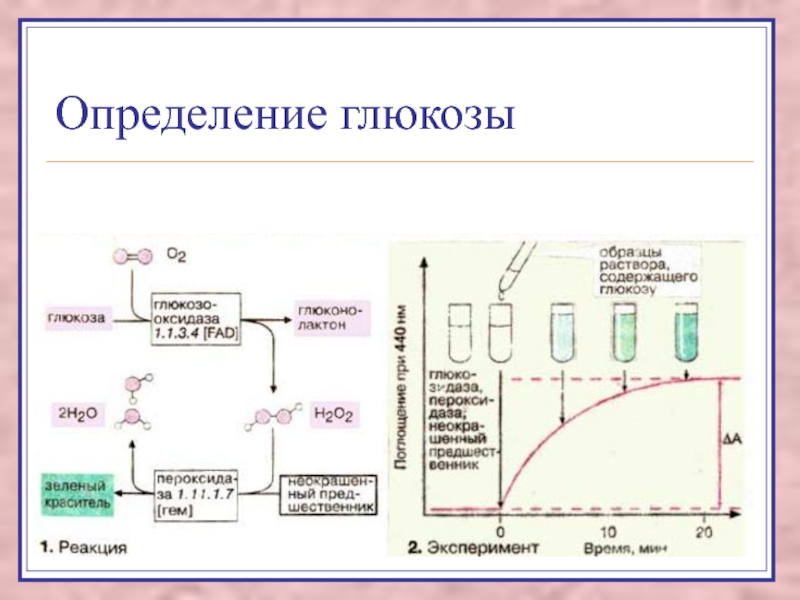
Слайд 28Энзимодиагностика
применение ферментов как аналитических реактивов:
- методы определения
глюкозы, мочевины,
активность ферментов определяют в биологических жидкостях и биоптатах для
диагностики.
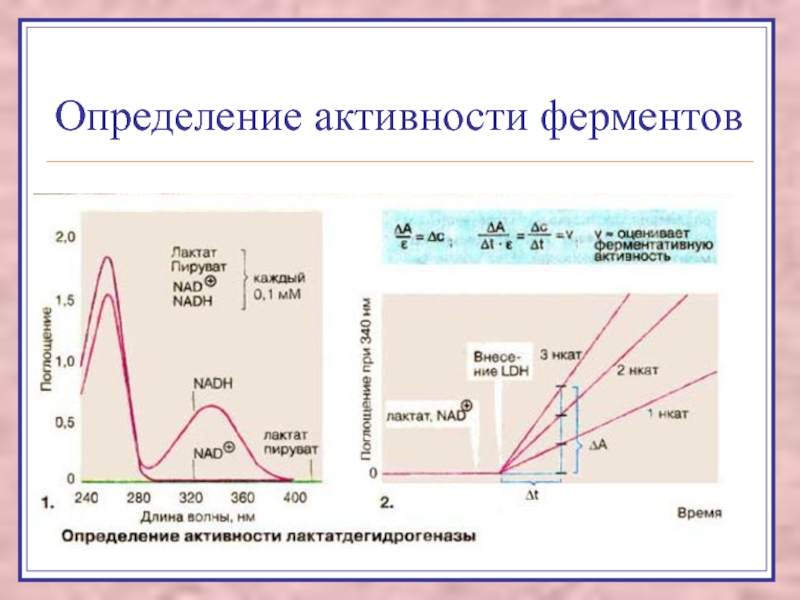
Слайд 30Определение активности ферментов
Слайд 31Гиперферментемия
повышение синтеза ЩФ при рахите,
повышение проницаемости мембран для
АЛТ и АСТ при гепатите,
некроз - клеток КФК, альдолаза,
АСТ,
понижение выведения ЩФ, ЛАП при закупорке желчных путей.
Слайд 32Гипоферментемия
уменьшение числа клеток, секретирующих фермент (ХЭ при циррозе печени,
пепсиноген при гастроэктомии),
избирательная недостаточность синтеза (церулоплазмин при болезни Вильсона-Коновалова),
усиление выделения фермента (церулоплазмин при нефрозе),
торможение активности фермента (трипсин под действием антитрипсина), действие ингибиторов.
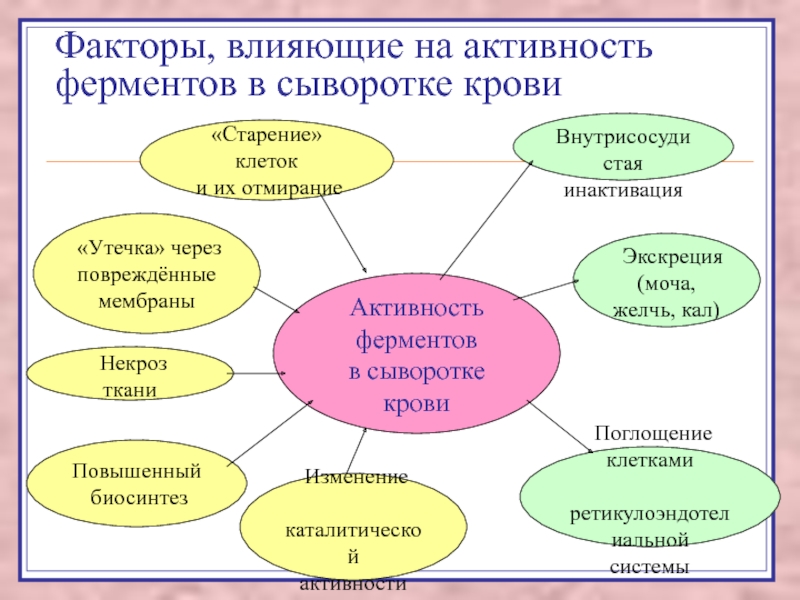
Слайд 33Факторы, влияющие на активность ферментов в сыворотке крови
Активность ферментов
в
сыворотке крови
«Старение» клеток
и их отмирание
«Утечка» через
повреждённые
мембраны
Некроз ткани
Повышенный
биосинтез
Изменение
каталитической
активности
Внутрисосудистая
инактивация
Поглощение клетками
ретикулоэндотелиальной
системы
Экскреция
(моча, желчь, кал)
Слайд 34Диагностическое значение исследования ферментов можно повысить двумя путями
определение изоферментов,
определение активности нескольких ферментов.
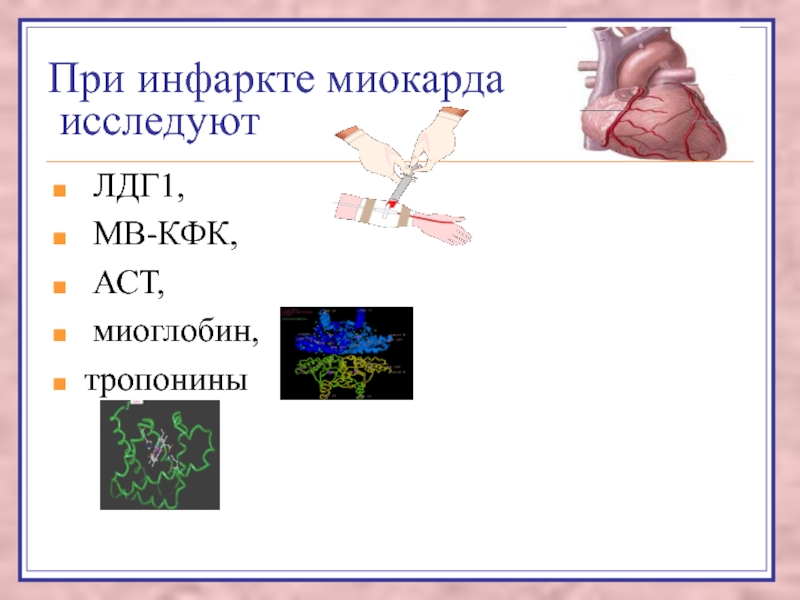
Слайд 35При инфаркте миокарда
исследуют
ЛДГ1,
МВ-КФК,
АСТ,
миоглобин,
тропонины
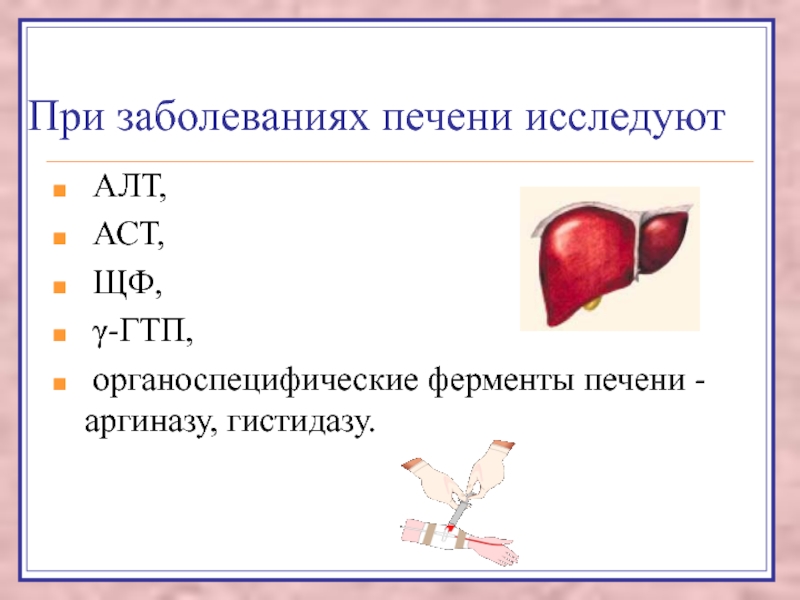
Слайд 36При заболеваниях печени исследуют
АЛТ,
АСТ,
ЩФ,
γ-ГТП,
органоспецифические ферменты
печени - аргиназу, гистидазу.
Слайд 37Ферменты плазмы крови
секреторные,
индикаторные,
экскреторные.
Слайд 38Секреторные ферменты
синтезируются в печени,
выделяются в плазму крови,
где играют определённую физиологическую роль,
снижение их активности указывает на
повреждение печени,
белковые факторы ССК, фибринолиза, кининогенеза (тромбин, плазмин, кининоген).
Слайд 39Секреторные ферменты
Ренин участвует в регуляции кровяного давления.
Лизоцим обеспечивает бактерицидные
свойства крови.
Холестеролэстераза разрушает ацетилхолин.
ЛХАТ – лецитин-холестеринацилтрансфераза – катализирует образование эфиров
холестерина.
Слайд 40Индикаторные ферменты
клеточные,
попадают в кровь из тканей, где они
выполняют определённые внутриклеточные функции.
Слайд 41Локализация внутриклеточных ферментов
в цитоплазме клетки (ЛДГ, альдолаза),
в митохондриях
(ГЛДГ),
в лизосомах (КФ, β-глюкуронидаза).
Слайд 42Цитозоль содержит ферменты
гликолиза,
пентозного цикла,
активации аминокислот,
глюконеогенеза,
мультиферментный
комплекс синтетазы жирных кислот,
АСТ,
МДГ (НАДФ-зависимая),
изоцитратДГ (НАДФ-зависимая),
гликогенфосфорилаза,
гликогенсинтетаза.
Слайд 43Ферменты митохондрий
пируватдегидрогеназный комплекс,
цитратсинтаза,
изоцитратДГ (НАД-зависимая),
МДГ и другие
ферменты ЦТК,
ацил-КоА-ДГ и другие ферменты β-окисления жирных кислот,
глутаматДГ,
ферменты дыхательной цепи и окислительного фосфорилирования,
АСТ.
Слайд 44Ферменты лизосом
кислая фосфатаза,
β-глюкуронидаза,
α-глюкозидаза,
β-глюкозидаза,
катепсины,
кислая рибонуклеаза,
кислая дезоксирибонуклеаза,
α-галактозидаза,
лизоцим,
гиалуронидаза,
арилсульфатаза,
коллагеназа.
Слайд 45Ферменты микросомальной фракции
глюкозо-6-фосфатаза,
рибосомальные ферменты белкового синтеза,
ферменты, участвующие
в реакциях гидроксилирования,
ферменты синтеза фосфолипидов, триглицеридов, холестерина.
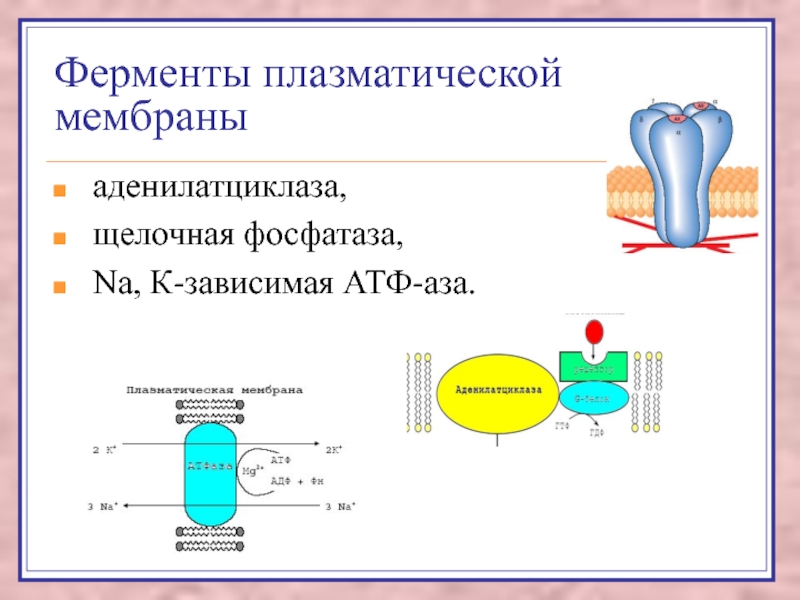
Слайд 46Ферменты плазматической мембраны
аденилатциклаза,
щелочная фосфатаза,
Na, К-зависимая АТФ-аза.
Слайд 47Ферменты ядра
ферменты репликации, транскрипции,
РНК-полимераза,
НАД-синтетаза.
Слайд 48В норме активность индикаторных ферментов в крови низкая.
При поражении
органа или ткани ферменты из клеток «вымываются» в кровь, их
активность возрастает в сыворотке, являясь индикатором степени и глубины повреждения этих тканей.
Слайд 49Индикаторные ферменты
неспецифические (общие для всех тканей),
органоспецифические (маркёрные).
Для печени:
аргиназа,
гистидаза,
уроканиназа,
сорбитолДГ,
орнитинкарбомоилтрансфераза.
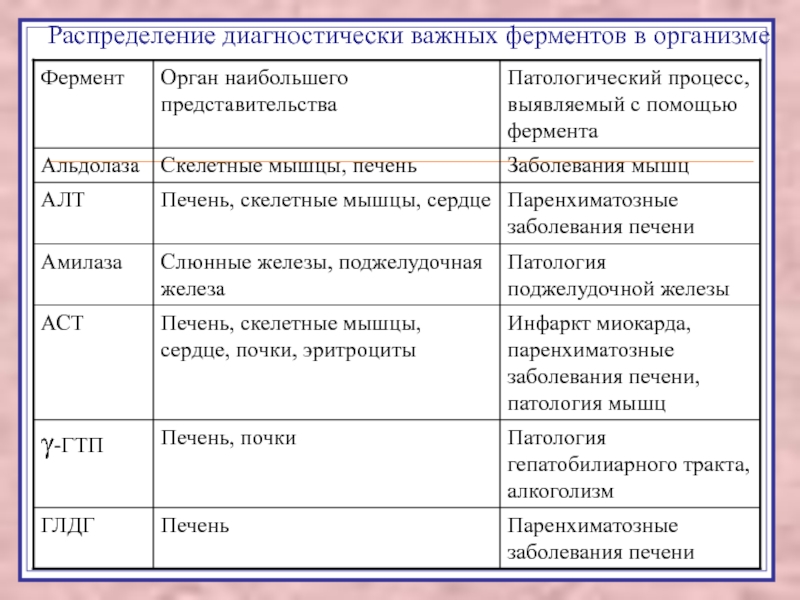
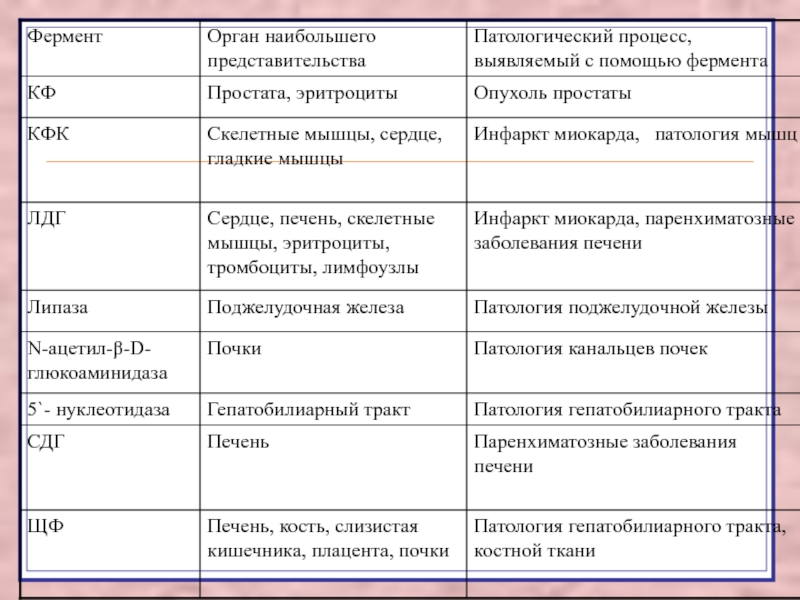
Слайд 50Распределение диагностически важных ферментов в организме
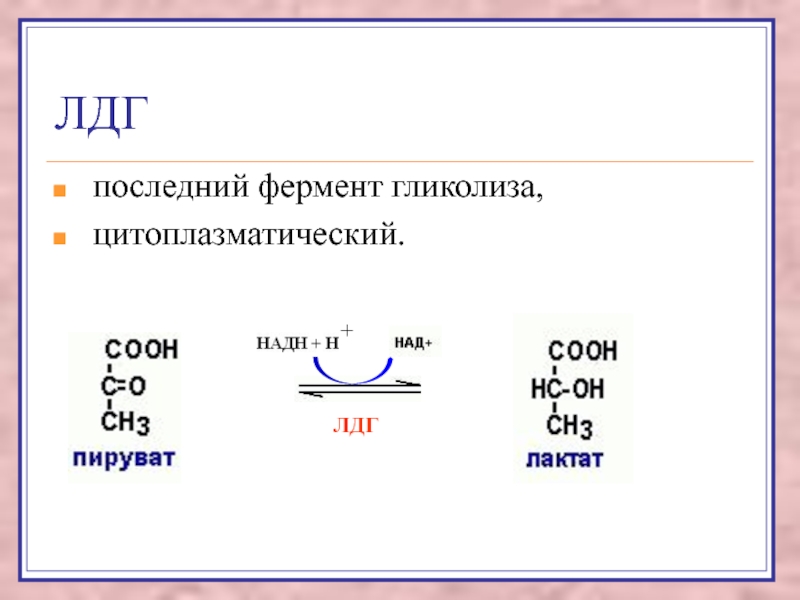
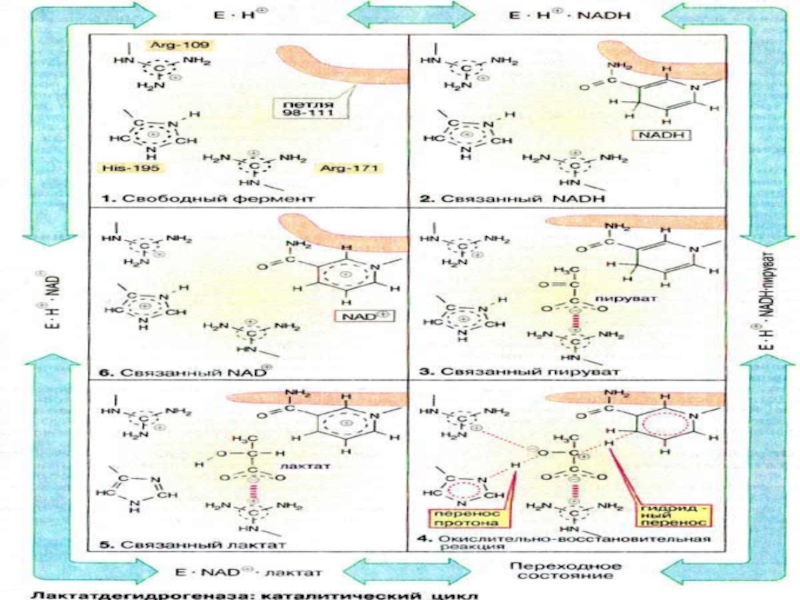
Слайд 52ЛДГ
последний фермент гликолиза,
цитоплазматический.
ЛДГ
+
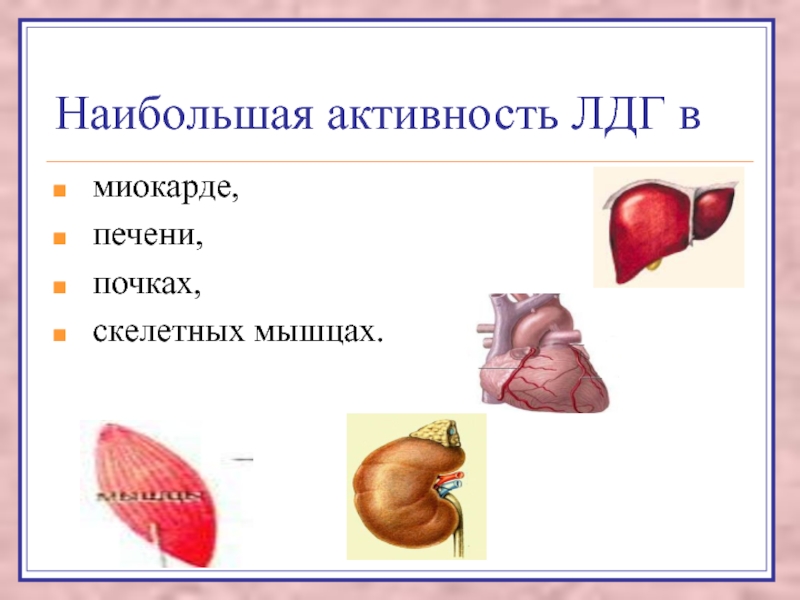
Слайд 55Наибольшая активность ЛДГ в
миокарде,
печени,
почках,
скелетных мышцах.
Слайд 56Изоферменты ЛДГ – органоспецифические ферменты.
В тканях, в которых преобладает аэробный
распад глюкозы присутствуют ЛДГ1,ЛДГ2 (низкое сродство к ПВК).
В тканях с
анаэробным распадом глюкозы присутствуют ЛДГ4,ЛДГ5.
В миокарде главный изофермент - ЛДГ1.
В эритроцитах и лёгких –ЛДГ1 и ЛДГ2.
В плазме крови – ЛДГ2.
В селезёнке, надпочечниках –ЛДГ3.
В скелетных мышцах – ЛДГ5, ЛДГ4.
В печени –ЛДГ5.
ЛДГ3 отмечена в лимфоидной ткани, тромбоцитах, опухолях.
В недифференцированных эмбриональных тканях преобладают ЛДГ2, ЛДГ3,ЛДГ4.
Слайд 57Показатели ЛДГ при патологии
При инфаркте миокарда ЛДГ1= ЛДГ2 в
сыворотке, либо даже превышает её.
При гепатитах и циррозе печени ЛДГ5
и ЛДГ4 повышаются.
При остром лейкозе повышаются в сыворотке ЛДГ2 и ЛДГ3.
При пневмонии возрастает ЛДГ3.
При стенокардии ЛДГ не меняется.
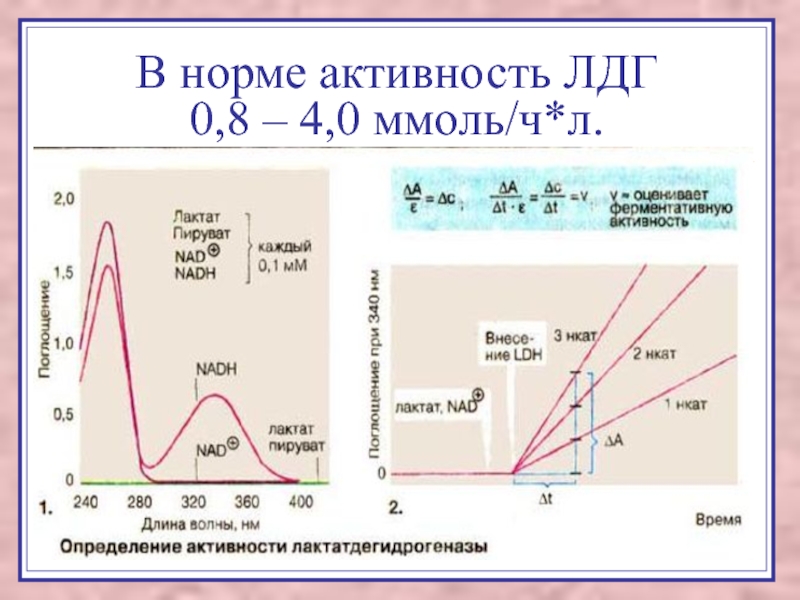
Слайд 58В норме активность ЛДГ
0,8 –
4,0 ммоль/ч*л.
Слайд 59Повышается ЛДГ при
повреждении миокарда,
лейкозах,
заболеваниях почек,
гемолитической анемии,
гепатитах,
мышечной дистрофии,
тромбах лёгочной артерии,
панкреатите.
Слайд 60 Возможность повышения ЛДГ1 при тестикулярных опухолях следует учитывать при
диагностике инфаркта миокарда.
ЛДГ1 и ЛДГ2 начинают нарастать через
12-24 часа после инфаркта миокарда. Максимальное повышение через 48-72 часов.
ЛДГ6 повышается при выраженном ацидозе, гипотонии, сепсисе.
Слайд 61Креатинкиназа
АТФ + креатин ⮀ АДФ + креатинфосфат
Активность фермента высока в:
мышцах,
миокарде.
В сыворотке креатинкиназа содержится в
следовых количествах.
КФК
Слайд 62Изоферменты КФК
ММ – в скелетных мышцах,
МВ – в
миокарде (+ММ),
ВВ - в ткани мозга.
Слайд 63При инфаркте миокарда
через 2-4 часа возрастает активность КФК,
через
3 дня – нормализация.
Обнаружение изофермента МВ – ранний маркёр инфаркта
миокарда.
Соотношение миоглобина и КФК-МВ даёт возможность диагностировать инфаркт миокарда.
На ранних этапах через 3-6 часов после инфаркта миокарда повышается тропонин Т.
Слайд 64При операциях аортокоронарного шунтирования повышаются
КФК,
миоглобин,
тропонин.
Слайд 65ММ-КФК повышается при
мышечной дистрофии,
дерматомиозите.
Слайд 66ВВ-КФК повышается при
гипоксии мозга,
метастазах рака простаты.
Слайд 67КФК повышается при
травмах,
операциях,
инфаркте миокарда,
полимиозите,
дерматомиозите,
миокардите,
мышечных дистрофиях,
гипотермии,
гипотиреозе,
инфекциях, столбняке, судорогах,
лечении
солями лития, отравлениях.
Слайд 68Причины повышения КФК в сыворотке крови
Артефактные:
- гемолиз эритроцитов in vitro,
Физиологические:
у
новорожденных активность
выше, чем у взрослых,
В период и в течение нескольких дней после родов.
Слайд 69Значительное повышение КФК при
шоке и циркуляторной недостаточности,
инфаркте миокарда,
мышечной дистрофии.
Слайд 70Умеренное повышение КФК при
механических повреждениях мышц,
воспалении мышечной ткани,
после хирургических вмешательств,
физической перегрузке,
после внутримышечных инъекций,
гипертиреозе,
алкоголизме,
инсульте, повреждении ткани мозга,
после приступа тяжёлой лихорадки.
Слайд 71КФК снижается при
тиреотоксикозе,
атрофии мышц.
Слайд 72АСТ наиболее активна в
миокарде,
печени,
головном мозге,
почках.
Активность
АСТ в миокарде
в 10 000 раз выше,
чем в сыворотке крови.
Слайд 73АЛТ наиболее активна в
печени,
поджелудочной железе,
сердце,
скелетных мышцах.
Слайд 74При инфаркте миокарда
в крови
увеличивается АСТ.
АСТ начинает нарастать через 6-8 часов после инфаркта миокарда.
Активность возрастает в 2-20 раз.
Прогностическое значение: если на четвёртый день не снижается, то прогноз плохой.
Четырёхкратное повышение АСТ – предвестник смерти.
При стенокардии АСТ в норме.
Слайд 75При болезнях печени в крови увеличивается АЛТ.
Особенно резко АЛТ повышается
при инфекционном гепатите
(за два дня до желтухи).
При инфаркте миокарда АЛТ умеренно повышается.
Слайд 76Коэффициент де Ритиса (1,33±0,4) АСТ/АЛТ
снижается при
инфекционном
гепатите,
повышается при
инфаркте миокарда.
Слайд 77Причины повышения АСТ в сыворотке крови
Артефактные:
- гемолиз эритроцитов in
vitro,
- существенная задержка отделения эритроцитов от сыворотки,
Физиологические:
- в плазме крови
новорожденных активность в 1.5 раза выше, чем у взрослых, из-за повышенной проницаемости клеточных мембран.
Слайд 78Значительное повышение АСТ при
недостаточности кровообращения при шоке и гипоксии,
инфаркте миокарда,
остром вирусном
и токсическом гепатите.
Слайд 79Умеренное повышение АСТ при
циррозе печени,
механической желтухе,
метастазах опухоли
в печень,
поражении скелетной мускулатуры,
после травмы или оперативного вмешательства,
выраженном внутрисосудистом гемолизе,
панкреатите,
дерматомиозите.
Слайд 80Активность АЛТ и АСТ повышается при использовании гепатотоксических препаратов
анаболические
стероиды,
аспирин,
индометацин.
Слайд 81Значение определения активности АСТ и АЛТ
Повышение активности АСТ в сыворотке
крови предложено использовать как прогностический тест при остром лейкозе.
Для диагностики
гепатита С используют АЛТ и активность катионной β-формы глутатион-S-трансферазы (участвует в детоксикации).
Слайд 82 γ-Глутамилтранспептидаза (γ-ГТП)
катализирует перенос γ-глутамильного остатка с γ-глутамилпептидов на
аминокислоты с образованием новых γ-глутамилпептидов.
Активность в норме: 0,6 – 3,96
ммоль/час*л.
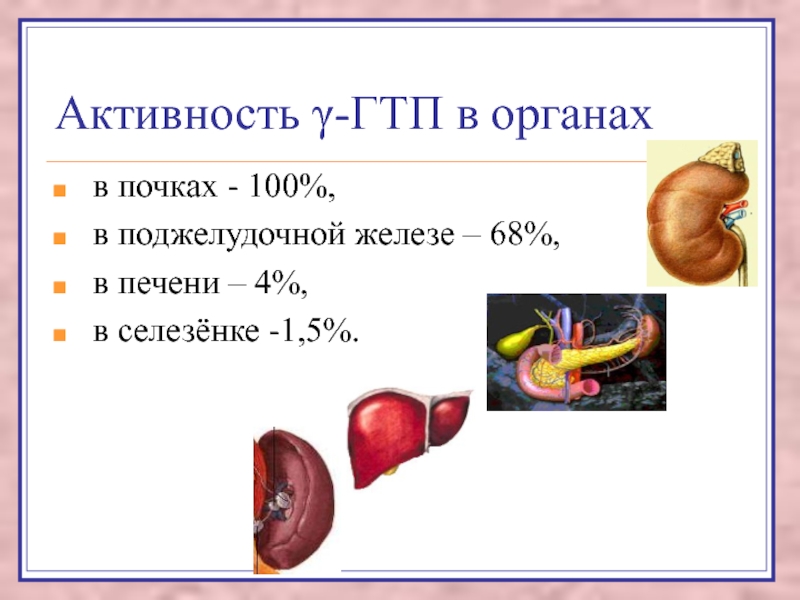
Слайд 83Активность γ-ГТП в органах
в почках - 100%,
в поджелудочной
железе – 68%,
в печени – 4%,
в селезёнке -1,5%.
Слайд 84Фермент обнаруживается в
сыворотке крови,
моче,
желчи.
γ-ГТП сыворотки
крови печёночного происхождения.
Слайд 85Резко повышается γ-ГТП
в 10 раз при
алкогольном поражении
печени,
холестазе,
раке поджелудочной железы с обструкцией желчного протока,
механической
желтухе,
холангите,
опухоли печени.
Слайд 86Умеренно повышается γ-ГТП в 5-10 раз при
гепатитах,
циррозе (без
холестаза),
панкреатите,
алкогольной интоксикации,
опухоли поджелудочной железы.
Слайд 87Превышение нормы γ-ГТП менее чем в 5 раз при
алкоголизме,
ятрогенных отравлениях (антиконвульсанты, фенобарбитал),
застойной сердечной недостаточности.
Слайд 88Диагностическое значение
При отсутствии желтухи определение γ-ГТП – чувствительный тест
для выявления патологии печени.
При онкозаболеваниях нормальное содержание γ-ГТП в крови
свидетельствует об отсутствии метастазов в печени.
Слайд 89 γ-ГТП – фермент «репарации»
Активность фермента возрастает в конце
третьей недели с начала инфаркта миокарда, что совпадает с наибольшим
напряжением репаративных процессов в некротизированном очаге миокарда.
Слайд 90Альдолаза
Концентрация в норме в сыворотке крови:
0,09-0,57ммоль/час*л.
Повышается при:
остром и хроническом гепатитах,
травме мышц, дерматомиозите, дистрофии мышц,
инфаркте миокарда,
опухоли печени,
гемопанкреатите,
столбняке,
инфекционном мононуклеозе,
болезни Мак-Ардля.
Слайд 91 α-Амилаза
расщепляет крахмал и гликоген до мальтозы,
в плазму
поступает из поджелудочной железы и слюнных желёз,
экскретируется с мочой.
Слайд 92 α-Амилаза содержится в
панкреатическом соке,
слюне,
печени,
мышцах,
фаллопиевых трубах.
Слайд 93Значительное повышение
α-амилазы в 10 раз при
остром панкреатите,
тяжёлой дисфункции почечных клубочков,
тяжёлом диабетическом кетоацидозе.
Слайд 94При остром панкреатите
α-Амилаза повышается через 3-12 часов после появления болей,
достигает максимума через 20-30 часов, затем снижается и через 2-5
дней может нормализоваться.
Повышение α-амилазы мочи наблюдается через 6-10 часов позднее, чем в крови.
Слайд 95Умеренное повышение
α-амилазы в 5 раз при
острых абдоминальных заболеваниях,
заболеваниях слюнных желёз,
дисфункции почечных клубочков,
инфаркте миокарда.
Слайд 96Снижение α-амилазы в сыворотке и моче при
некрозе поджелудочной железы,
тиреотоксикозе,
ожоговой болезни,
позднем токсикозе,
отравлениях мышьяком, барбитуратами.
Слайд 97Диагностика панкреатита
Наиболее чувствительным и специфичным тестом для диагностики панкреатита
служит уровень активности Р-изофермента
α-амилазы.
Слайд 98Причины гиперамилаземии и гиперамилазурии
Патология поджелудочной железы (повышается Р-изоамилаза).
Панкреатит: острый, хронический.
Осложнения:
ложная киста, асцит, абсцесс.
Травма поджелудочной железы, включая повреждения при пальпации.
Рак
поджелудочной железы
Слайд 99Патология, несвязанная с поджелудочной железой
почечная недостаточность
(повышается Р- и S-изоамилаза),
гиперамилаземия при раке слюнных желёз или бронхов (повышается S-изоамилаза),
повреждение слюнных желёз (эпидемический паротит) (повышается S-изоамилаза),
макроамилаземия (повышается S-изоамилаза).
Слайд 100Заболевания брюшной полости комплексные
патология билиарного тракта,
перфорация пептической язвы
(повышается Р-изоамилаза),
непроходимость кишечника (повышается Р-изоамилаза),
инфаркт брыжейки (повышается Р-изоамилаза),
перитонит,
аневризма аорты с расслоением,
травма мозга,
ожоговый и травматический шок,
постоперативная гиперамилаземия (повышается S-изоамилаза),
диабетический кетоацидоз (повышается Р- и S-изоамилаза),
алкогольная интоксикация(повышается Р- и S-изоамилаза),
передозировках лекарственных препаратов (опиаты) (повышается Р-изоамилаза).
Слайд 101Экскреторные ферменты
синтезируются в печени (ЛАП, ЩФ) и поджелудочной железе
(амилаза, липаза, трипсин),
в норме выделяются с желчью,
активность возрастает при патологии в плазме крови.
Слайд 102 оптимум рН 8,6-10,1,
гидролизует разные субстраты при рН
10,
цинк и магний повышают активность фермента,
присутствует во всех
органах человека,
прикреплена к плазматической мембране,
участвует в минерализации костной ткани,
повышается при росте костной ткани и её разрушении (остеопороз),
маркёр остеобластов.
Щелочная фосфатаза
Слайд 103Изоферменты ЩФ
костный,
плацентарный,
кишечный.
Изофермент 1 содержится в костях,
Изоферменты 2
и 3 содержатся в печени.
В печени ЩФ локализована
в клетках эндотелия вокруг вен как в синусоидах, так и в желчных канальцах.
Слайд 104Диагностическое значение определения ЩФ
Определение активности ЩФ в крови
имеет диагностическое значение при заболеваниях печени и костной ткани.
Слайд 105Активность ЩФ возрастает при
рахите,
остеомаляции,
остеопорозах,
остеосаркомах,
туберкулёзе костей,
механической желтухе,
циррозе печени,
инфаркте миокарда,
саркоидозе, амилоидозе.
Повышение в крови
активности ЩФ может быть единственным признаком злокачественного образования в печени.
Слайд 106Причины гиперферментемии ЩФ при холестазе
повышенный синтез фермента,
экстракция фермента
с плазматической мембраны,
поступление в циркуляцию ЩФ, ЛАП, γ-ГТП.
Высокомолекулярный фермент
ЩФ – лучший тест и более чувствительный индикатор ранних сроков холестаза.
Слайд 107Кислая фосфатаза
сосредоточена в простате,
эритроцитах, печени, селезёнке,
нормальная концентрация в крови 0,24- 0,6 ммоль/ч*л,
рН оптимум 5-5,5.
Слайд 108Кислая фосфатаза повышается при
гемолитических анемиях,
тромбоцитопении,
тромбозах,
миеломной болезни,
раке простаты.
Слайд 109Значение определения КФ при раке простаты
в 25% при раке
простаты
без метастазов повышается КФ,
в 80-90% при раке простаты с метастазами повышается КФ.
Определяют PSA – простат-специфический антиген.
Слайд 110Г-6-ФДГ повышается при
инфекционном гепатите,
диабетическом кетоацидозе,
отравлениях.
Дефицит Г-6-ФДГ приводит
к гемолитической анемии.
Слайд 111Холинэстераза
расщепляет ацетилхолин на холин и уксусную кислоту.
Слайд 112Формы холинэстеразы:
1. холинэстераза
в эритроцитах,
нервной ткани,
мозге,
мышцах,
2. в
плазме крови – псевдохолинэстераза, которая синтезируется в печени.
Слайд 113Холинэстераза повышается в плазме при
выздоровлении после поражений печени,
нефрозе,
гиперлипопротеинемии IV типа,
столбняке,
сахарном диабете.
Слайд 114Холинэстераза понижается в плазме при
заболеваниях паренхимы печени,
действии антихолинэстераз
(ФОС),
наследственных аномалиях холинэстеразы,
инфаркте миокарда,
анемиях,
острых инфекциях,
дерматомиозите,
приёме половых гормонов, контрацептивов.
Слайд 115Диагностическое значение определения изоферментов холинэстеразы
Исследование изоферментов холинэстеразы в
сыворотке крови лиц, имеющих контакт с ФОС, показали, что этот
тест является более чувствительным, чем обычно используемый метод определения общей активности ХЭ крови.
Появление в сыворотке крови изоферментов холинэстеразы с высокой электрофоретической подвижностью свидетельствует о наличии дистрофических изменений внутри мышечного волокна.
Слайд 116Липаза повышается в сыворотке при
панкреатите,
желчнокаменной болезни,
перфорации полого
органа,
инфаркте кишки,
кисте или псевдокисте
поджелудочной железы,
перитоните.
Слайд 117Фосфолипазы А и С
Активность фосфолипаз А и С – критерий
активности воспалительных и деструктивных изменений в ране, контроля эффективности проводимой
терапии.
В первые 3 дня после травмы, ожога возрастает активность фосфолипазы А с последующей активацией фосфолипазы С.
Слайд 118Увеличение активности протеиназ в сыворотке крови сопутствует
ревматизму,
коллагенозам,
острым
воспалениям,
инфекциям,
ожоговой болезни,
радиационным поражениям.
Слайд 119Трипсин повышается при
остром панкреатите,
язвенной болезни.
Слайд 120Трипсин снижается при
эмфиземе лёгких,
циррозе печени.
цирроз
Слайд 121 циррозе печени,
хронических инфекционных заболеваниях,
шизофрении,
после инфаркта миокарда.
Уровень
церулоплазмина повышается при
цирроз
Слайд 122Уровень церулоплазмина снижается при
нефротическом синдроме,
гепатоцеребральной дистрофии.
Слайд 123Основные ферменты печени, используемые в диагностике
Слайд 125Соотношение АСТ+АЛТ/ГлДГ
Метастазы в печень
10
Обструктивная желтуха
Билиарный цирроз 5-20
Острое начало:
А. хронический гепатит
Б. цирроз печени 30-40
Холестатический гепатоз
Острый вирусный гепатит
Острый алкогольный гепатит 50
Слайд 126Соотношение γ-ГТ /АСТ
Активный вирусный гепатит
Токсический гепатит
Хронический персистирующий гепатит
≤ 1
Хронический гепатит
Острый алкогольный гепатит 1-3
Цирроз печени
Алкогольный цирроз 3-6
Недавняя обструктивная желтуха
Билиарный цирроз
Длительная обструктивная желтуха
Рак печени/метастазы в печень
Слайд 127При остром вирусном гепатите
Повышается в сыворотке крови активность:
АЛТ,
АСТ,
ЛАП,
γ-ГТП,
аденозиндезаминазы.
Коэффициент де Ритиса меньше 1.
Снижается активность холинэстеразы.
Слайд 128При некрозе гепатоцитов в крови
Повышается активность:
АСТ,
ГЛДГ,
IgM,
IgG,
Снижаются:
альбумины,
протромбин,
проконвертин,
антигемофильный глобулин.
Слайд 129Энзимы в пище
салат из моркови, орехов,
лука
порея, сельдерея,
к тяжело усвояемому мясу для улучшения пищеварения добавляют
кислую капусту, лук, чеснок, свежие пряности,
продукты моря, водоросли,
соевый соус.
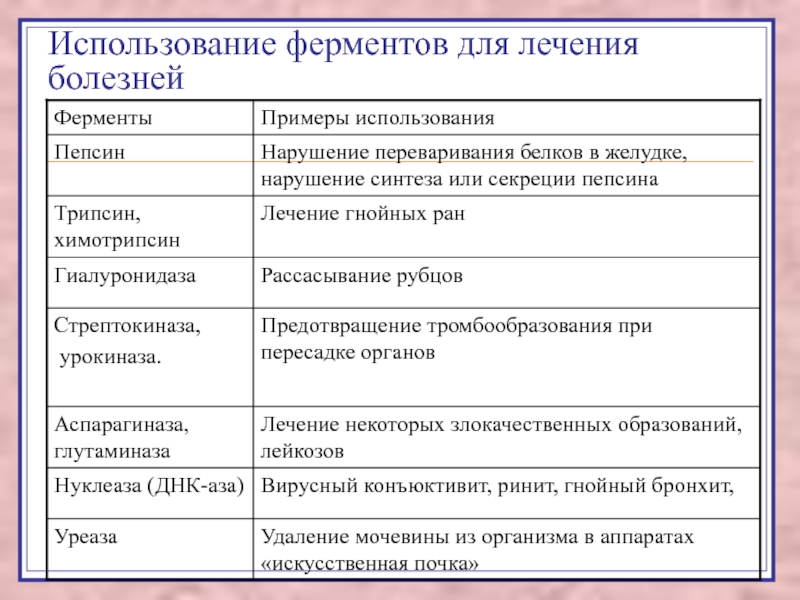
Слайд 130Использование ферментов для лечения болезней
Слайд 131Заместительная терапия при дефицитах, недостатке ферментов
пепсин,
фестал,
панзинорм.
Слайд 132Патогенетическая терапия
Трипсин применяется для обработки гнойных ран, разжижения и удаления
вязких секретов.
Гиалуронидаза представлена двумя формами: лидазной и ронидазной. Гиалуронидаза расщепляет
гиалуроновую кислоту – основное вещество соединительной ткани. Применяют для рассасывания спаек, коллоидных рубцов.
Слайд 133Лечение тромбозов ферментами ПССК
фибринолизином,
стрептокиназой,
урокиназой.
Эндоваскулярная терапия
тромбином способствует эмболизации сосудов при кровотечениях, лечению гемангином и артериовенозных
свищей.
Слайд 134Ингибиторы протеолитических ферментов:
контрикал,
гордокс,
трансилол,
ингитрил
Слайд 135Ингибиторы протеолитических ферментов применяются при
панкреатитах,
активации фибринолиза,
инфаркте
миокарда,
артритах,
аллергических заболеваниях.
Слайд 136Лечение острого панкреатита
В лечении острого панкреатита применяется селективная сорбция
протеиназ.
Созданный на основе овомукоида из белка утиных яиц новый гемадсорбент
«овосорб» обеспечивает извлечение из крови активных потеолитических ферментов. Идёт детоксикация.
Слайд 137 Ингибитор МАО - ниаламид представляет одну из основных групп
антидепрессантов.
Ингибиторангиотензин-конвертирующего фермента в составе катиотена применяется для лечения артериальных гипертензий.
Слайд 138Применение микроконтейнеров (ферменты в липосоме)
Разработки по увеличению степени тропности
липосом введение в их оболочку антител, углеводов, гормонов и других
соединений, имеющих сродство к рецепторам определённых клеток.
Слайд 139Условия успешной энзимотерапии
получение фермента в чистом виде,
введение фермента,
чтобы он достиг органа-мишени.
Слайд 140Иммобилизация ферментов
Ковалентная иммобилизация ферментов – фермент ковалентно присоединён к
полимерному носителю.
Нековалентная иммобилизация ферментов – адсорбция, включение в клетки,
микрокапсулирование.
Слайд 141Преимущества
устойчивость к протеолитическим ферментам,
термостабильность,
длительное действие,
снижение антигенности.
Слайд 142Примеры применения иммобилизации ферментов
тампоны и бинты с иммобилизованными
на них протеазами для ускорения заживления ран и ожогов и
предотвращения гнойных осложнений,
плёнки из ацетата целлюлозы, в которые вводят трипсин, накладываются на поверхность гнойной раны,
для удаления из крови мочевины может быть использования колонна с включённой в волокна ацетата целлюлозы микрокапсулированной уреазой.
Слайд 143Использование ферментов в качестве аналитических реактивов
Слайд 144Новые возможности энзимотерапии:
генная терапия
Используют неповреждённые копии мутантного участка ДНК.
Ген
фермента – АДА.