Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Структура и общие свойства ферментов
Содержание
- 1. Структура и общие свойства ферментов
- 2. Энзимология – наука о ферментахФермент – биологический
- 3. Значение ферментов любые химические превращения веществ в
- 4. Значение ферментов
- 5. Инженерная энзимологияИммобилизованная β-галактозидаза, присоединённая к магнитному стержню-мешалке,
- 6. История развития энзимологииПоявилась энзимология в 1814 году,
- 7. Доказательства белковой природы ферментов все выделенные ферменты
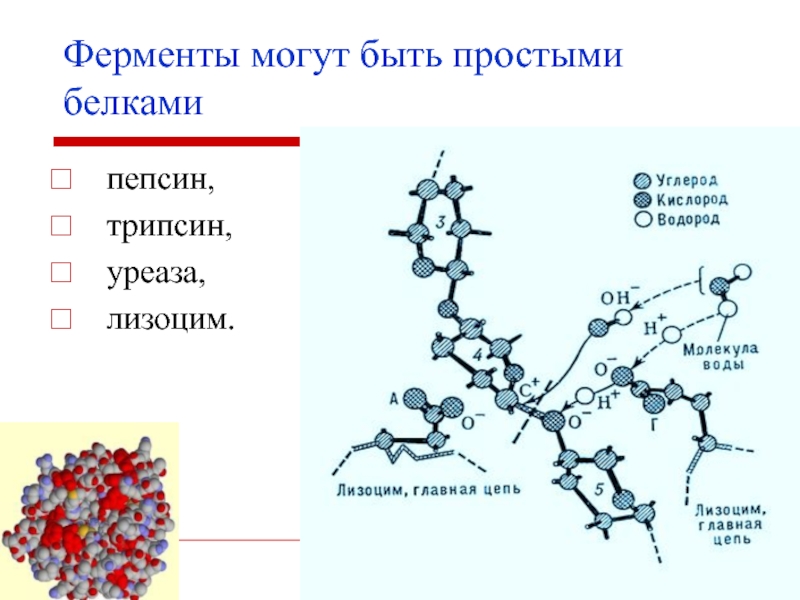
- 8. Ферменты могут быть простыми белками пепсин, трипсин, уреаза, лизоцим.
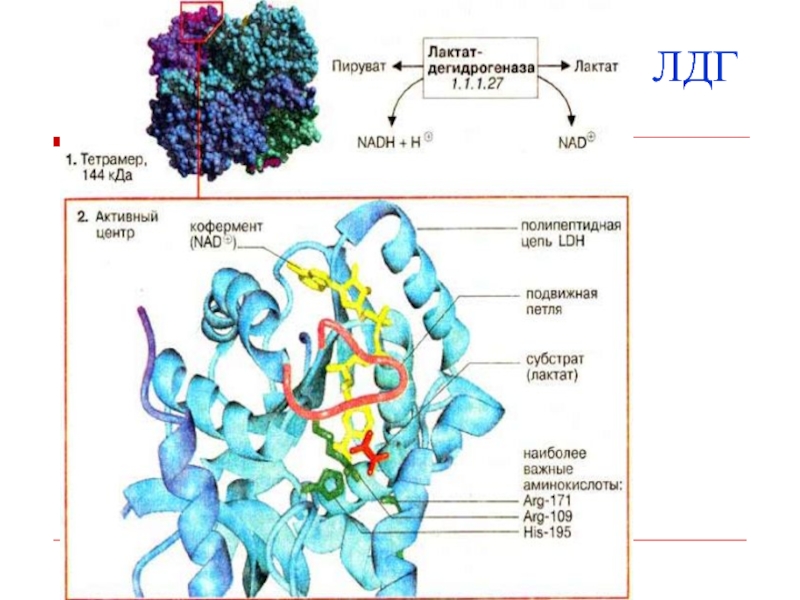
- 9. ЛДГ, трансаминазы.Сложные ферменты помимо белковой части содержатнебелковую часть – кофермент.Ферменты могут быть сложными белками
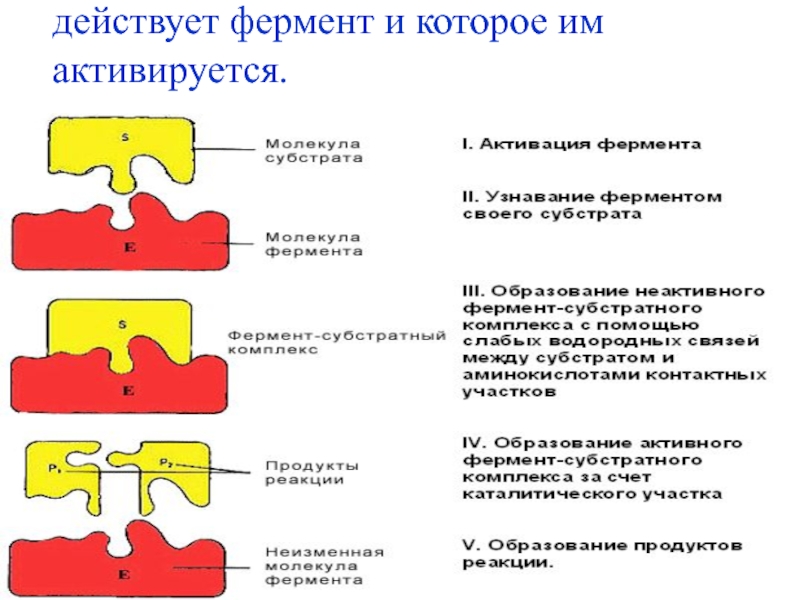
- 10. Субстрат – вещество, на которое действует фермент и которое им активируется.
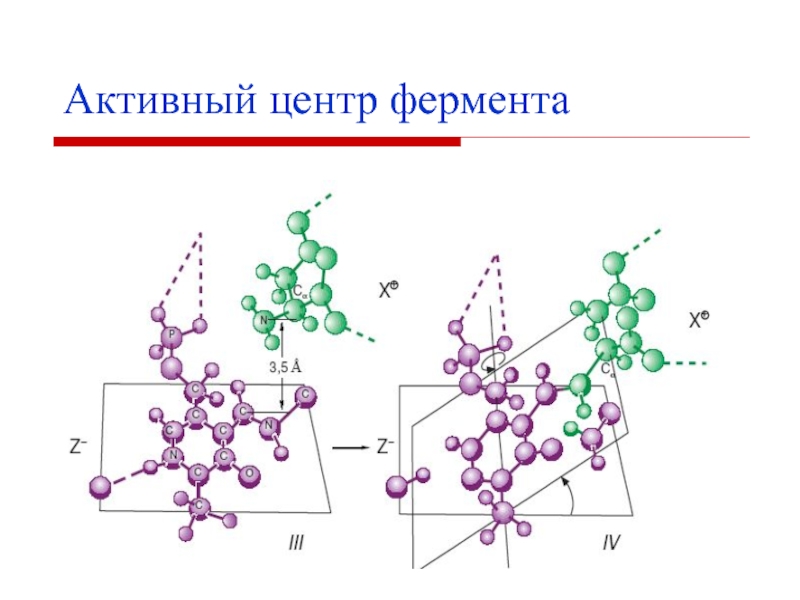
- 11. Активный центр фермента – несколько аминокислотных остатков,
- 12. Активный центр фермента
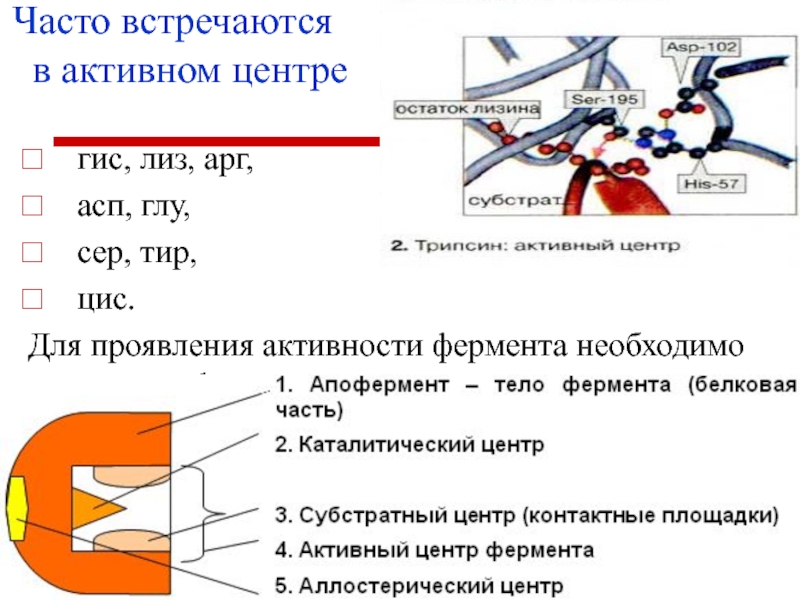
- 13. Часто встречаются в активном центре гис,
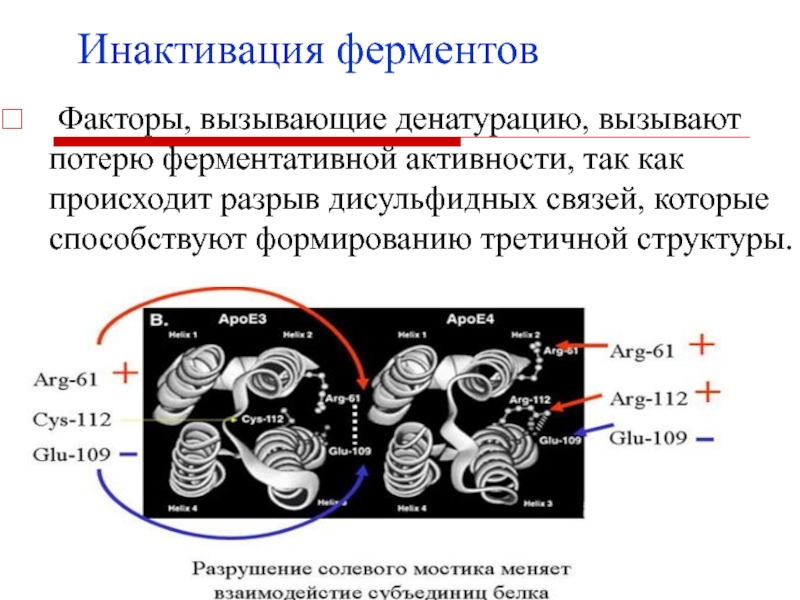
- 14. Инактивация ферментов Факторы, вызывающие денатурацию, вызывают потерю
- 15. Отличия ферментов от неорганических катализаторов высокая молекулярная
- 16. Влияние температуры Термолабильность – чувствительность ферментов к
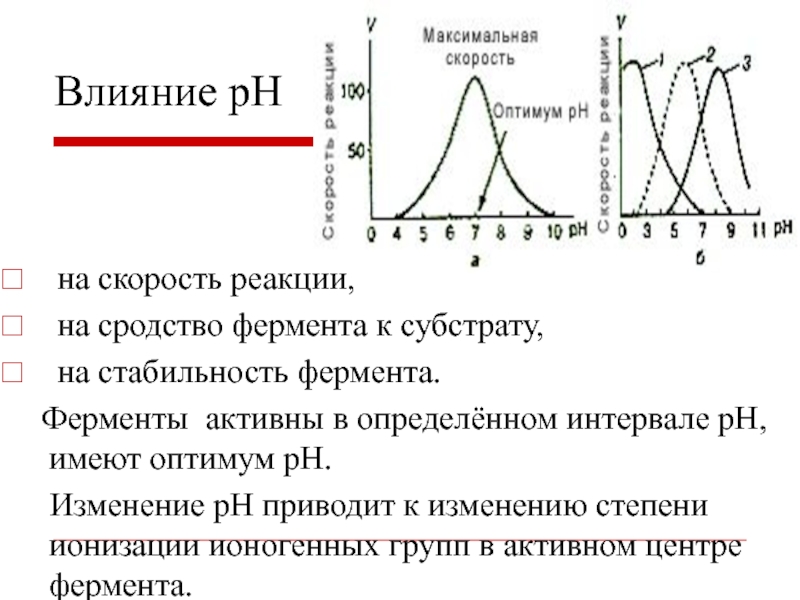
- 17. на скорость реакции, на сродство фермента
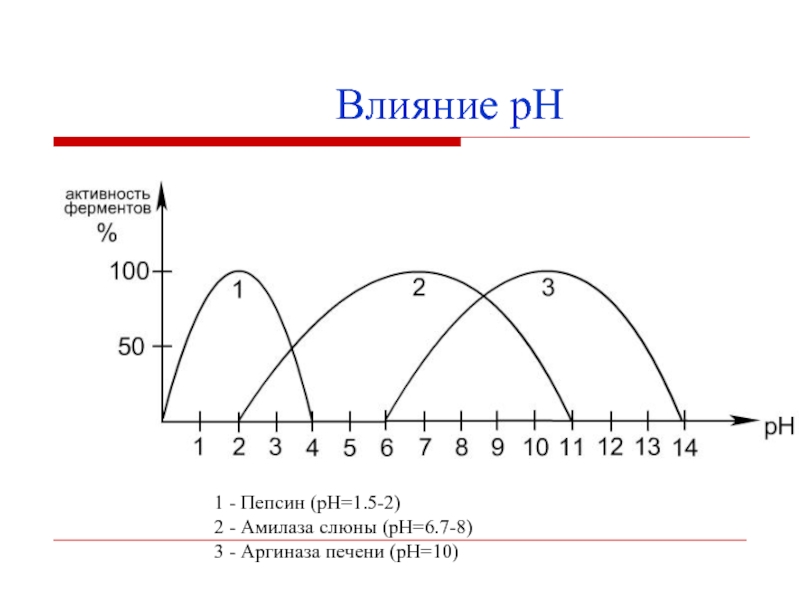
- 18. 1 - Пепсин (pH=1.5-2)2 - Амилаза слюны (pH=6.7-8)3 - Аргиназа печени (pH=10)Влияние рН
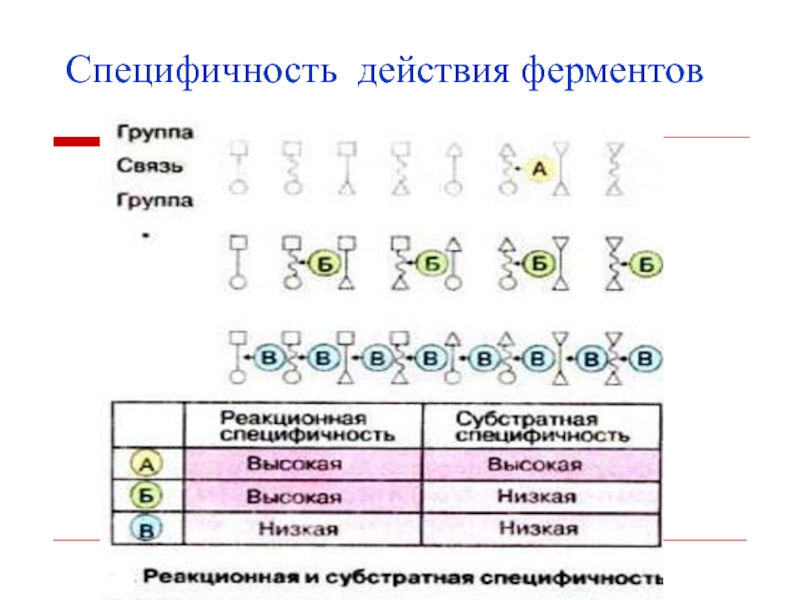
- 19. Специфичность действия ферментовКаждый фермент действует строго на
- 20. Специфичность действия ферментов
- 21. Абсолютная специфичностьФермент катализирует превращение только одного субстрата. уреаза, аргиназа.
- 22. Стереоспецифичность фермент катализирует превращение одного из стереоизомеров, оксидазы L и D аминокислот.
- 23. Относительная специфичностьФермент действует на субстраты разных групп химических соединений.Специфичность по типу реакции. Цитохром Р450.
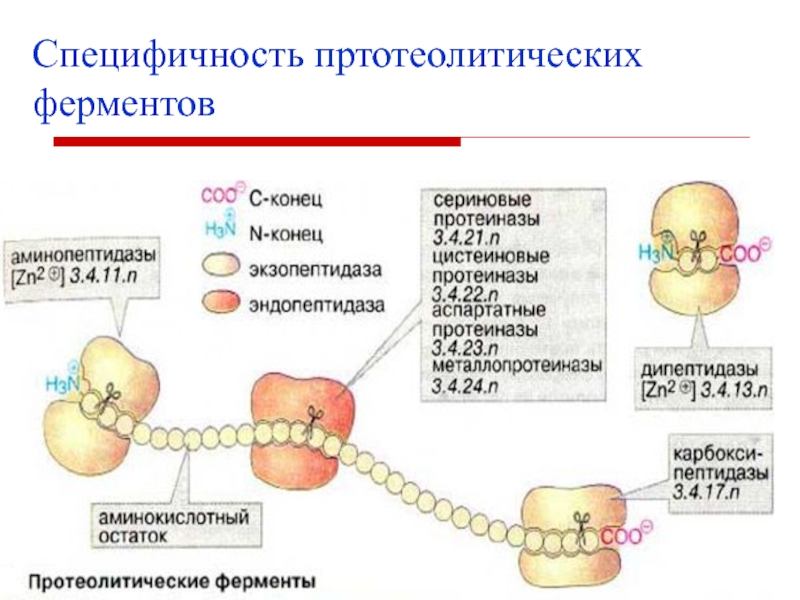
- 24. Групповая специфичностьФермент действует на отдельные связи определённой
- 25. Специфичность пртотеолитических ферментов
- 26. Энзимопатология раздел медицины, изучающий заболевания, связанные с нарушением функционирования ферментов.
- 27. Энзимопатии наследственные (фенилкетонурия, гликогенозы), токсические (передозировка лекарств,
- 28. Изоферменты- множественные молекулярные формы фермента данной
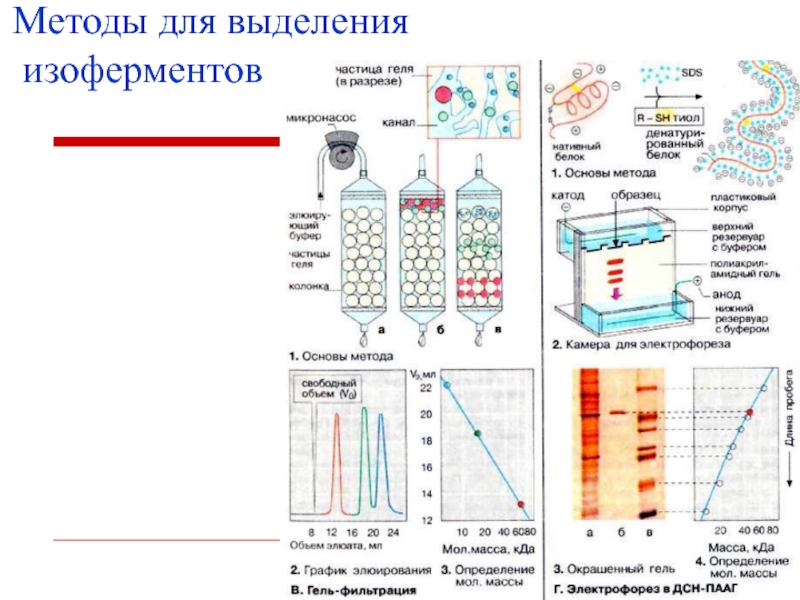
- 29. Методы для выделения изоферментов электрофорез, ионообменная хроматография, гельфильтрация, избирательная адсорбция, иммунохимический метод.
- 30. Методы для выделения изоферментов
- 31. Изоферменты Генетически детерминированные изоферменты возникают в результате
- 32. Применение изоферментовС помощью изоферментного анализа удаётся выявить
- 33. ЛДГТкани человека продуцируют 2 электрофоретически различающихся субъединицы
- 34. ЛДГ
- 35. ЛДГ5 катализирует образование лактата, а ЛДГ1 –
- 36. Определение изоферментов сыворотке крови для диагностики При
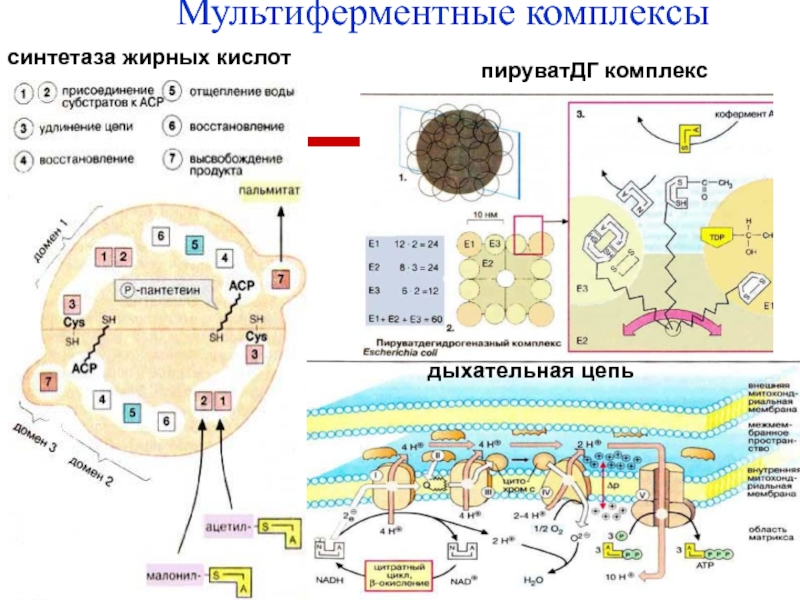
- 37. Мультиферментные комплексы ряд ферментов многоэтапного биохимического процесса:
- 38. Мультиферментные комплексы синтетаза жирных кислот, пируватДГ комплекс, дыхательная цепь, ферменты гликолиза.
- 39. Мультиферментные комплексысинтетаза жирных кислотдыхательная цепьпируватДГ комплекс
- 40. СтроениеЧаще ферменты построены из двух или более полипептидов, каждый из которых уложен в отдельную глобулу.
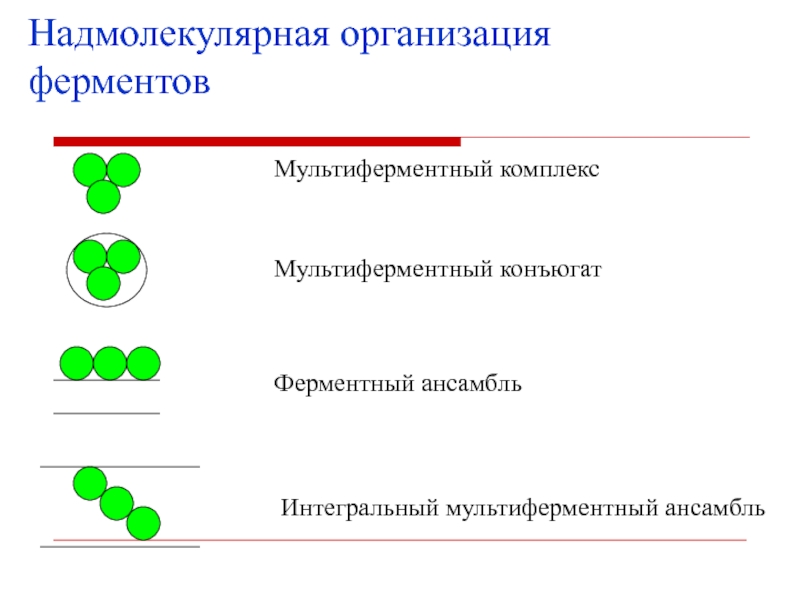
- 41. Надмолекулярная организация ферментовМультиферментный комплексМультиферментный конъюгатФерментный ансамбльИнтегральный мультиферментный ансамбль
- 42. Скачать презентанцию
Энзимология – наука о ферментахФермент – биологический катализатор белковой природы.Энзимология появилась на стыке химической, биологической и медицинской наук.
Слайды и текст этой презентации
Слайд 2Энзимология – наука о ферментах
Фермент – биологический катализатор
белковой природы.
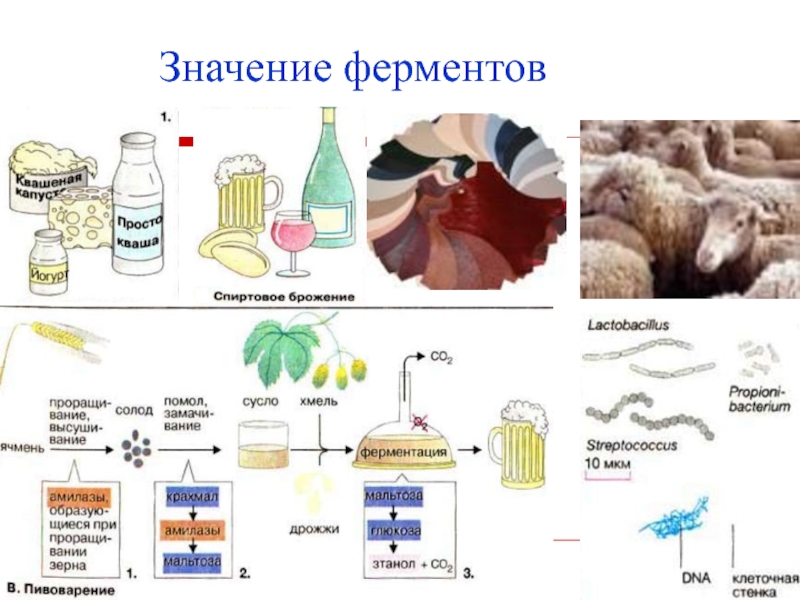
на стыке химической, биологической и медицинской наук.Слайд 3Значение ферментов
любые химические превращения веществ в организме происходят при
участии ферментов,
практическое применение ферментов во всех областях деятельности, где
речь идёт о живых существах:хлебопечение,
виноделие,
сыроварение,
чайное, кожевенное, меховое производство.
Слайд 5Инженерная энзимология
Иммобилизованная β-галактозидаза, присоединённая к магнитному стержню-мешалке, используется для снижения
содержания молочного сахара в молоке, то есть продукта, который не
расщепляется в организме больного ребёнка с наследственной непереносимостью лактозы.Методами генной инженерии получены L-треонин, витамин В12, интерфероны.
Слайд 6История развития энзимологии
Появилась энзимология в 1814 году, когда Кирхгоф показал,
что в вытяжке из проросшего ячменя содержится вещество, которое вызывает
превращение крахмала в сахар (амилаза).В 1836 году Т.Шванн выделил из
желудочного сока пепсин.
В настоящее время известно
10 000 ферментов, 500 получено в кристаллическом состоянии.
Слайд 7Доказательства белковой природы ферментов
все выделенные ферменты – белки,
методы
получение ферментов и белков одинаковы,
факторы, вызывающие денатурацию белка, вызывают
инактивацию ферментов,при гидролизе ферменты дают аминокислоты,
ферменты обладают высокой специфичностью.
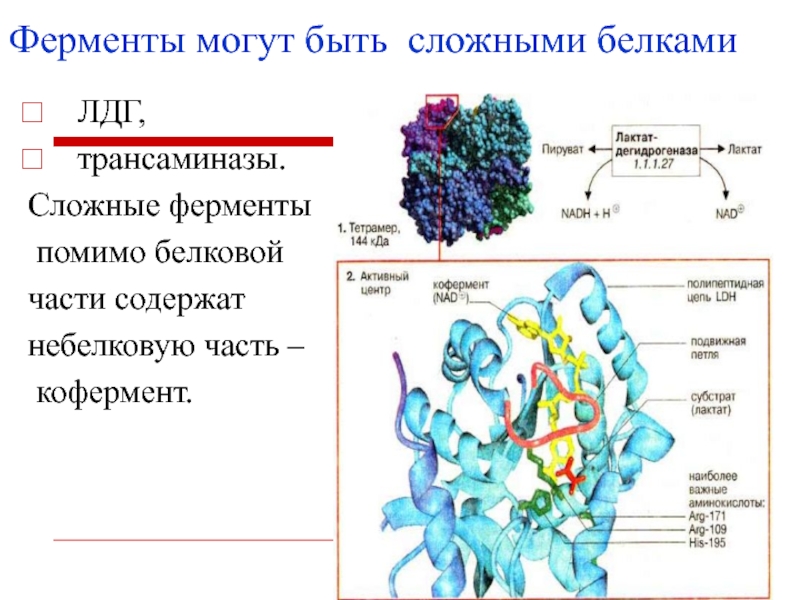
Слайд 9 ЛДГ,
трансаминазы.
Сложные ферменты
помимо белковой
части содержат
небелковую часть
–
кофермент.
Ферменты могут быть сложными белками
Слайд 11Активный центр фермента – несколько аминокислотных остатков, которые в ходе
ферментативного катализа взаимодействуют с субстратом.
У сложных ферментов в активный центр
входят и простетические группы (коферменты).Для формирования активного центра имеют значение третичная и четвертичная структуры фермента, так как в активный центр входят аминокислоты, расположенные далеко друг от друга.
Наиболее часто в активный центр входят 3-5 аминокислот.
Активный центр фермента
Слайд 13Часто встречаются
в активном центре
гис, лиз, арг,
асп,
глу,
сер, тир,
цис.
Для проявления активности фермента необходимо
наличие функциональных групп.Слайд 14Инактивация ферментов
Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так
как происходит разрыв дисульфидных связей, которые способствуют формированию третичной структуры.
Слайд 15Отличия ферментов от неорганических катализаторов
высокая молекулярная активность,
лабильность -
ферменты действуют при относительно мягких условиях (t, рН, давление),
специфичность
действия,регуляция ферментов нейрогуморальным путём с участием других ферментов.
Слайд 16Влияние температуры
Термолабильность – чувствительность ферментов к температуре.
При температуре 60º
наступает денатурация.
Миокиназа мышц выдерживает нагревание до 100º.
Оптимум температуры 37-40º С.
При
температуре 50º снижается активность ферментов.Эффект температуры в отношении скорости реакции объясняется её влиянием на кинетическую энергию молекул.
Слайд 17
на скорость реакции,
на сродство фермента к
субстрату,
на стабильность фермента.
Ферменты активны в определённом интервале
рН, имеют оптимум рН.Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре фермента.
Влияние рН
Слайд 19Специфичность действия ферментов
Каждый фермент действует строго на одно вещество или
очень небольшое число близкородственных веществ.
Если бы ферменты не обладали специфичностью,
их действие приводило бы к распаду клеточного материала.Структура активного центра фермента комплементарна структуре его субстрата.
Слайд 21Абсолютная специфичность
Фермент катализирует превращение только одного субстрата.
уреаза,
аргиназа.
Слайд 22Стереоспецифичность
фермент катализирует превращение одного из стереоизомеров,
оксидазы L и
D аминокислот.
Слайд 23Относительная специфичность
Фермент действует на субстраты разных групп химических соединений.
Специфичность по
типу реакции.
Цитохром Р450.
Слайд 24Групповая специфичность
Фермент действует на отдельные связи определённой группы субстратов.
Пепсин расщепляет
связи, образованные аминогруппой тирозина или фенилаланина.
Трипсин гидролизует пептидные связи, в
образовании которых принимают участие СООН-группы лиз и арг.Химотрипсин гидролизует пептидные связи, в образовании которых участвуют СООН-группы ароматических АМК.
Эластаза гидролизует пептидные связи, в образовании которых участвуют СООН-группы гли, ала.
Слайд 26Энзимопатология
раздел медицины, изучающий заболевания, связанные с нарушением функционирования ферментов.
Слайд 27Энзимопатии
наследственные (фенилкетонурия, гликогенозы),
токсические (передозировка лекарств, воздействие токсинов инфекционных
агентов),
алиментарные (при недостаточном поступлении в организм витаминов, микроэлементов),
из-за
нарушения организации ферментных процессов в клетке (нарушение кровоснабжения тканей).Слайд 28Изоферменты- множественные молекулярные формы фермента данной особи, катализирующие одну и
ту же реакцию, но разделяющиеся при помощи физико-химических методов, так
как отличаются по физико-химическим свойствам: электрофоретические свойства,
адсорбционные свойства,
оптимум рН,
термостабильность,
чувствительность к ингибиторам,
сродство к субстрату,
небольшие различи в первичной структуре.
Слайд 29Методы для выделения изоферментов
электрофорез,
ионообменная хроматография,
гельфильтрация,
избирательная адсорбция,
иммунохимический метод.
Слайд 31Изоферменты
Генетически детерминированные изоферменты возникают в результате множественности аллелей в
одном локусе.
Посттрансляционные (вторичные) изоферменты возникают в результате химической модификации исходного
фермента или его частичного протеолиза.Слайд 32Применение изоферментов
С помощью изоферментного анализа удаётся выявить небольшие мутации.
Изоферменты изменяются
в процессе развития и дифференцировки (в печени эмбриона – ГК1,
а в печени взрослого – ГК3 и ГК4).Изоферменты играют роль в регуляции метаболизма.
Слайд 33ЛДГ
Ткани человека продуцируют 2 электрофоретически различающихся субъединицы ЛДГ: Н и
М.
Так как ЛДГ – фермент-тетрамер, то образуется 5 изоферментов.
ЛДГ1
ЛДГ2
ЛДГ3
ЛДГ4
ЛДГ5
Слайд 35ЛДГ5 катализирует образование лактата, а ЛДГ1 – её утилизацию.
В тканях
с высоким уровнем аэробного обмена (сердце) содержится ЛДГ1.
ЛДГ1
+
Слайд 36Определение изоферментов сыворотке крови для диагностики
При инфаркте миокарда в
крови повышается активность ЛДГ1, а при патологии печени – ЛДГ5
и ЛДГ4.В опухолевых тканях повышается ЛДГ5 и уменьшается ЛДГ1, возможен эмбриональный изоферментный спектр.
При детском церебральном параличе повышается ЛДГ5 и ЛДГ4, уменьшается ЛДГ1, ЛДГ2, МДГ1, МДГ2, повышается МДГ4.