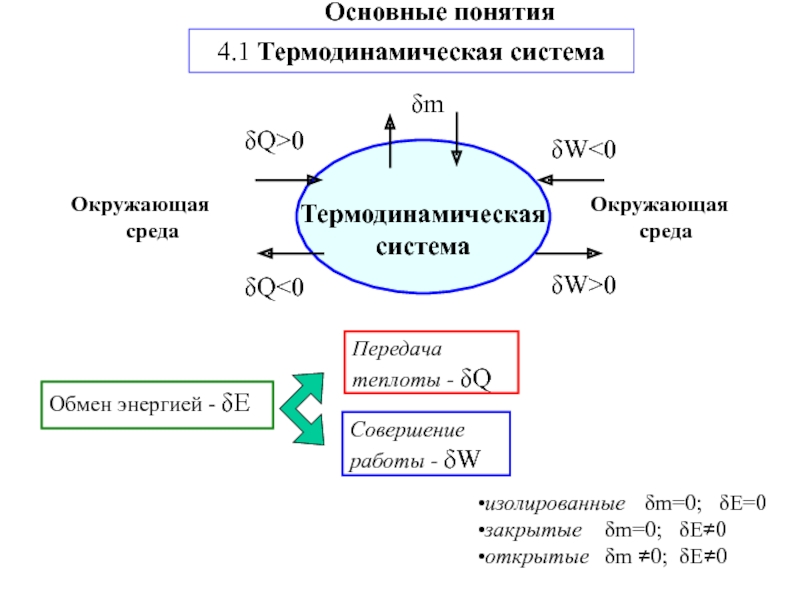
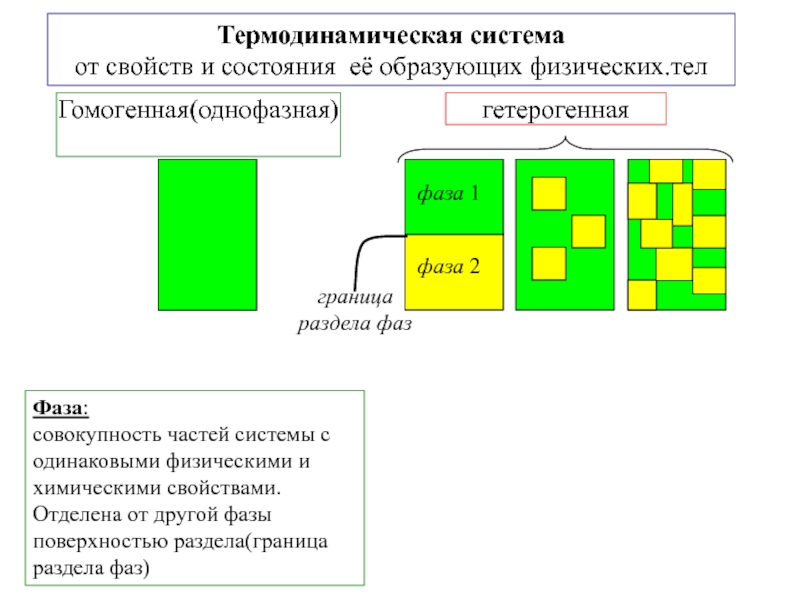
другую, от одной части системы к другой
Химическая термодинамика -
термодинамика
химических процессов.Описывает статистически значимые процессы (большое число частиц)
энергетические эффекты, сопровождающие физические и химические процессы
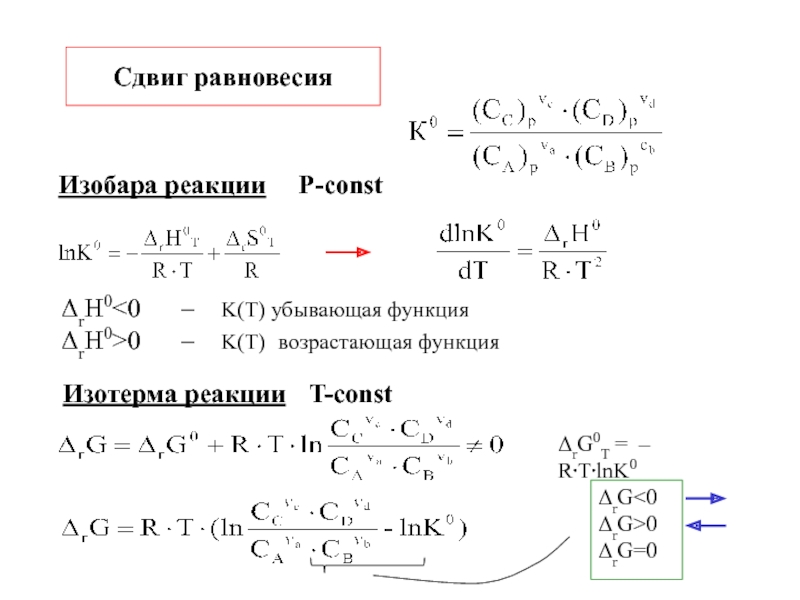
возможность, направления и предел самопроизвольного протекания процессов.

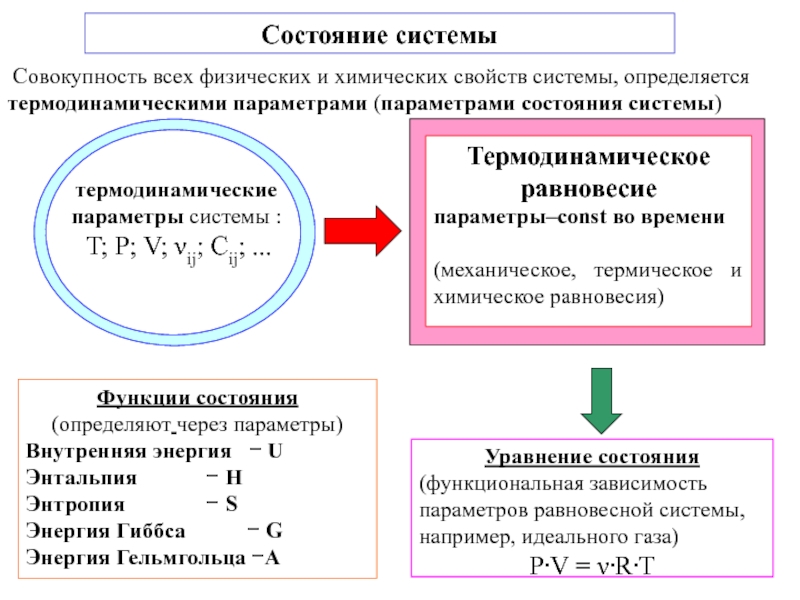
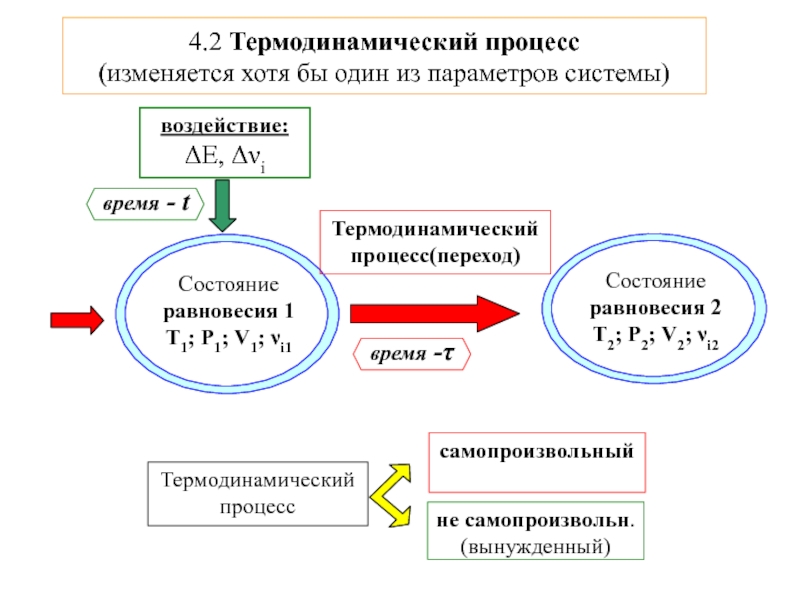
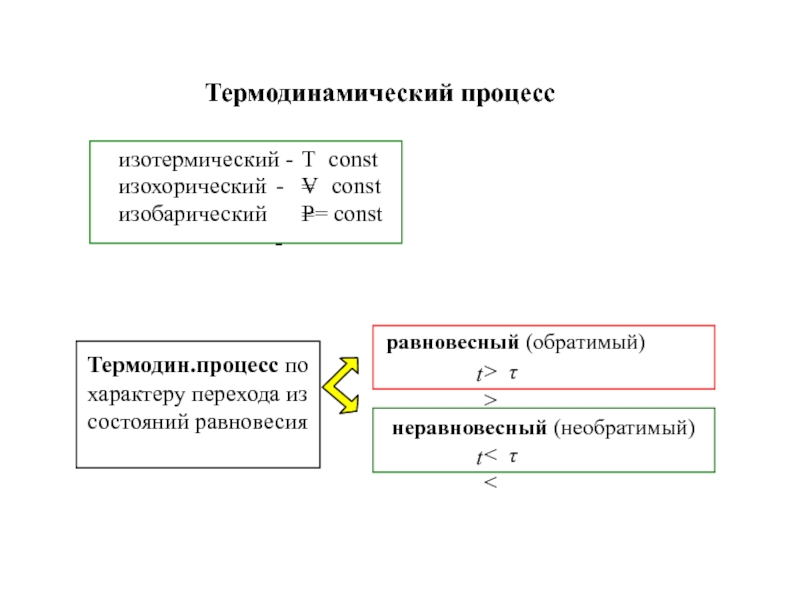
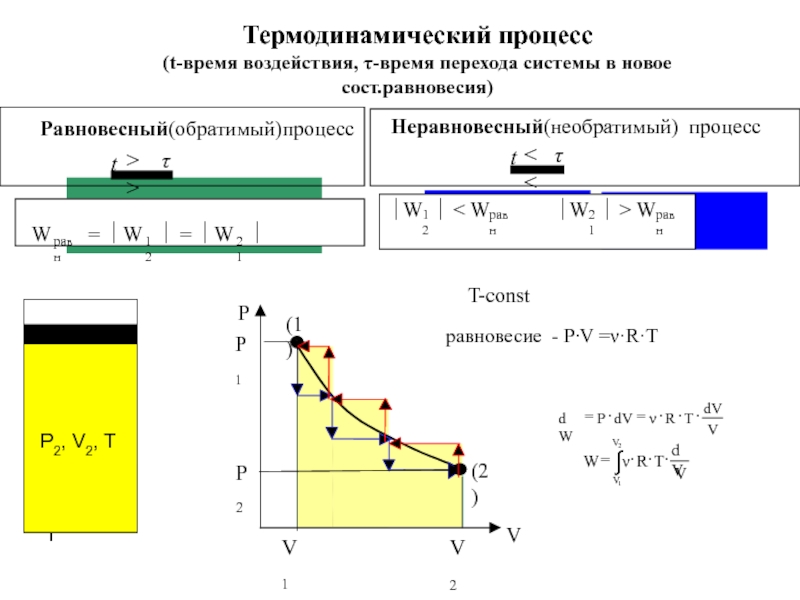

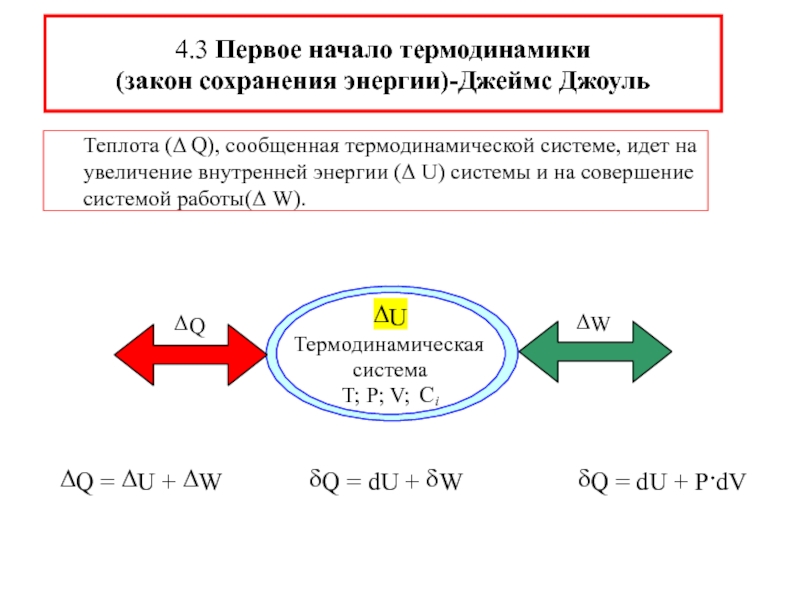

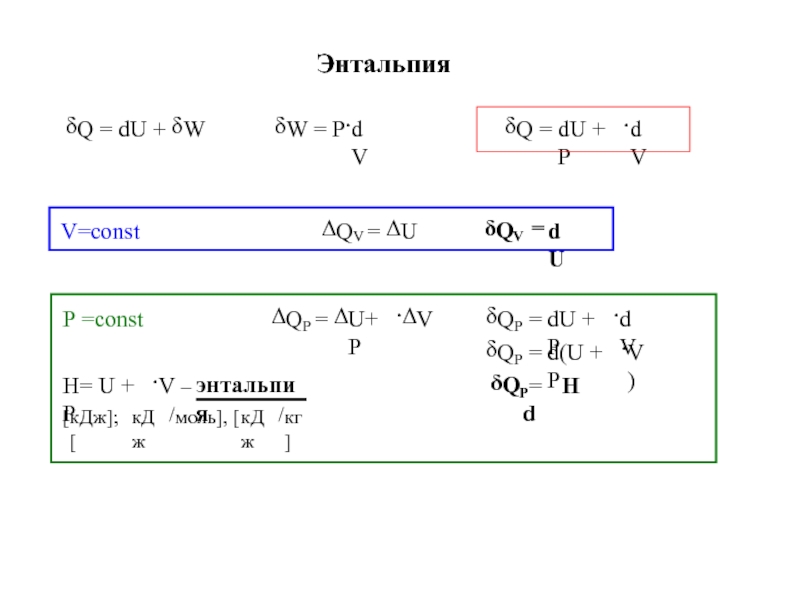
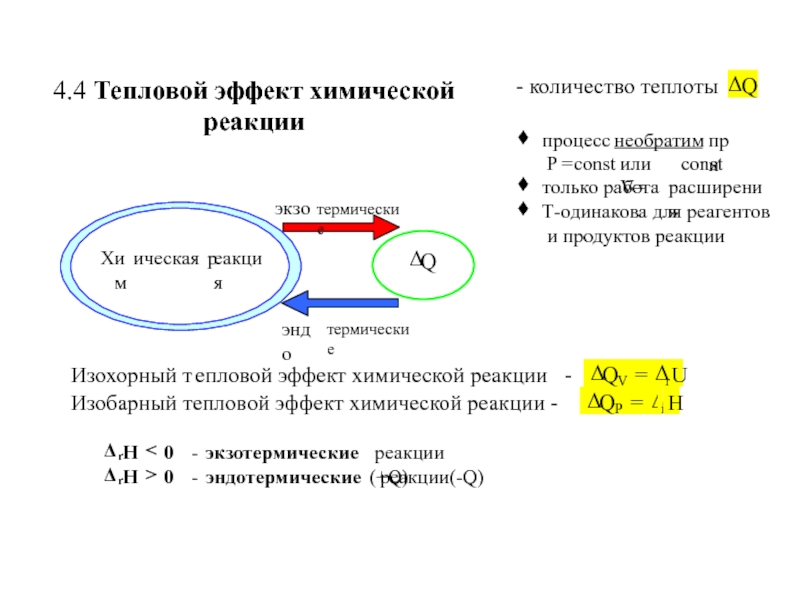

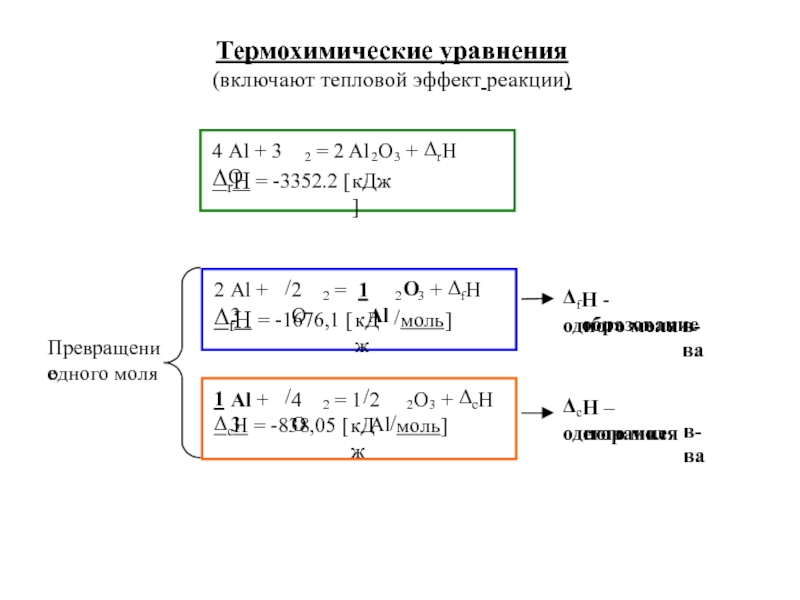



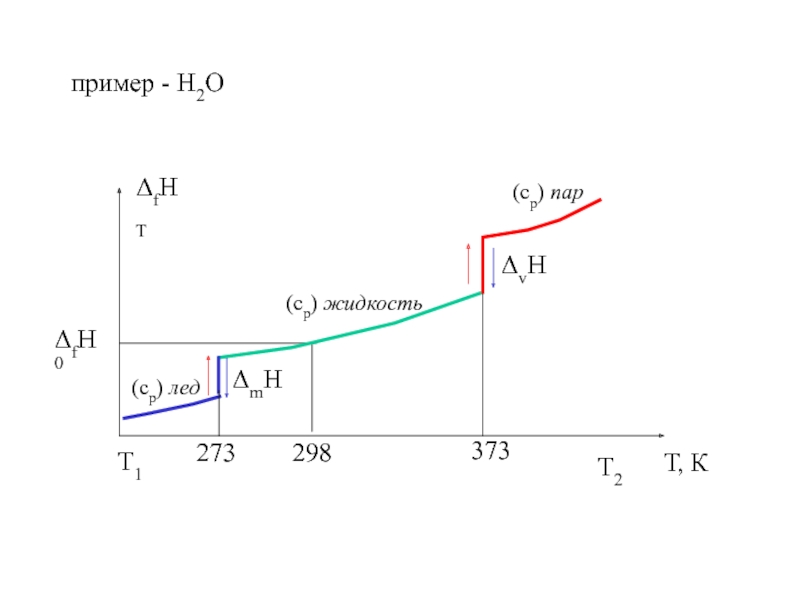

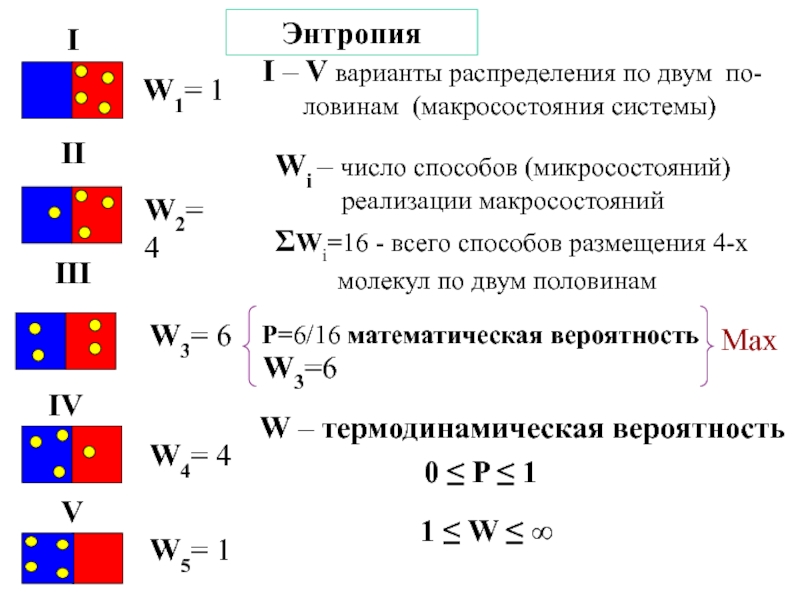


![ТЕРМОДИНАМИКА S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/img/thumbs/d76a5da5bd14d2d0bb3f890ea2e96103-800x.jpg)