Слайд 1ФЕРМЕНТЫ
Строение, свойства,
механизмы действия
Слайд 2«О ферментах как и о людях судят по их поведению»
Академик В.А.Энгельгарт
Фермент (от лат. fermentatio – брожение)
Энзим (от греч. en zyme – в дрожжах)
1814 г. – Кирхгоф (Санкт-Петербург) – превращение крахмала в мальтозу под действием экстрактов из ячменя (амилаза)
1860 г. – Л.Пастер (Париж) – исследование брожения с участием дрожжей
1872 г. – М.Манассеина в лаборатории проф. Вайснера (Вена) – опыты по спиртовому брожению в бесклеточном экстракте дрожжей
1897 г. – Э.Бюхнер (Германия) – опыты по спиртовому брожению в отсутствие клеток, за которые ему в 1907 году вручена Нобелевская премия
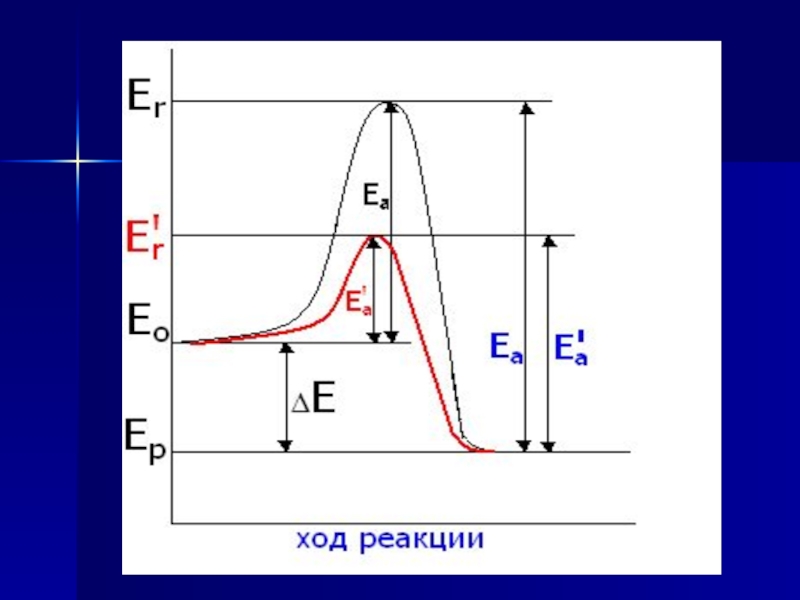
Слайд 3Скорость химической реакции зависит
от концентрации реагентов
от энергии активации
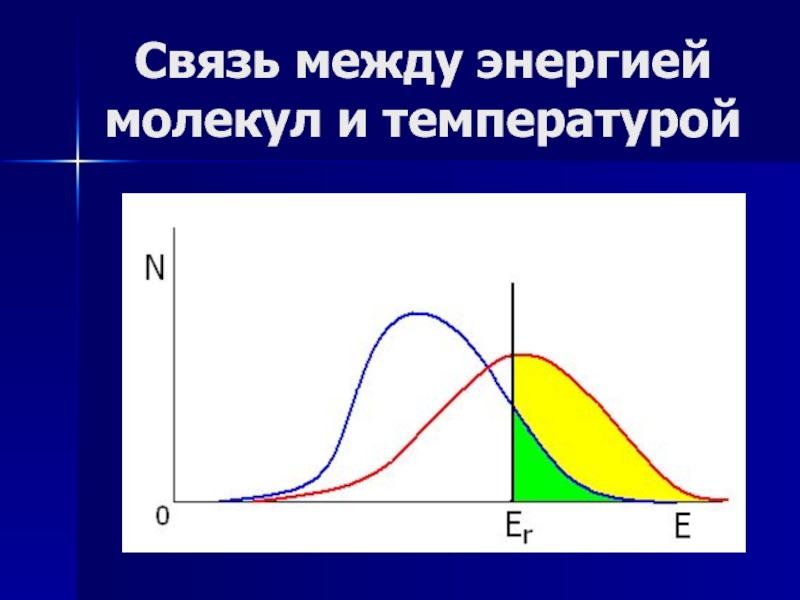
Слайд 4Связь между энергией молекул и температурой
Слайд 6Свойства катализаторов
Катализатор не вызывает, а лишь УСКОРЯЕТ химическую реакцию
Катализатор не
влияет на величину энергетического итога реакции
В обратимых реакциях в присутствии
катализатора ускоряется как прямая, так и обратная реакции
(с.110)
Слайд 7Свойства ферментов
как биокатализаторов
Высокая эффективность
Специфичность действия
Субстратная специфичность
Зависимость от температуры
Зависимость
от рН среды
Чувствительность к ионному составу среды
Чувствительность к действию лигандов
(активаторов и ингибиторов)
(с.110)
Слайд 8Эффективность биокатализа
H2O2
H2O + O2
Спонтанно k = 10-6 c-1
Катализатор FeCl2
(k = 6x10-2 c-1)
Фермент каталаза (k = 7x106 c-1)
При равных (в молярном выражении)
концентрациях соли и фермента
Слайд 9Специфичность действия ферментов
Способность ферментов катализировать превращение субстрата в химической реакции
определенного типа называется специфичностью действия. Современная классификация и номенклатура ферментов
основана на делении ферментов на группы по специфичности их действия.
Слайд 10Классификация ферментов
1 класс – Оксидоредуктазы
2 класс – Трансферазы
3 класс –
Гидролазы
4 класс – Лиазы
5 класс – Изомеразы
6 класс – Лигазы
(Синтетазы)
Слайд 11Субстратная специфичность ферментов
Относительная (групповая) субстратная специфичность – это способность фермента
катализировать превращение похожих по строению субстратов. (вариант – стереоспецифичность)
Абсолютная субстратная
специфичность – способность фермента катализировать превращение единственного субстрата
Слайд 12Активный центр фермента состоит из двух функционально различных участков:
1) Адсорбционный
участок (центр) – для ориентированной сорбции молекулы субстрата на поверхности
молекулы фермента.
2) Каталитический участок (центр) – отвечает за реакцию катализа, т.е. за химическое преобразование субстрата, связавшегося с боковыми радикалами аминокислот, входящих в состав активного центра.
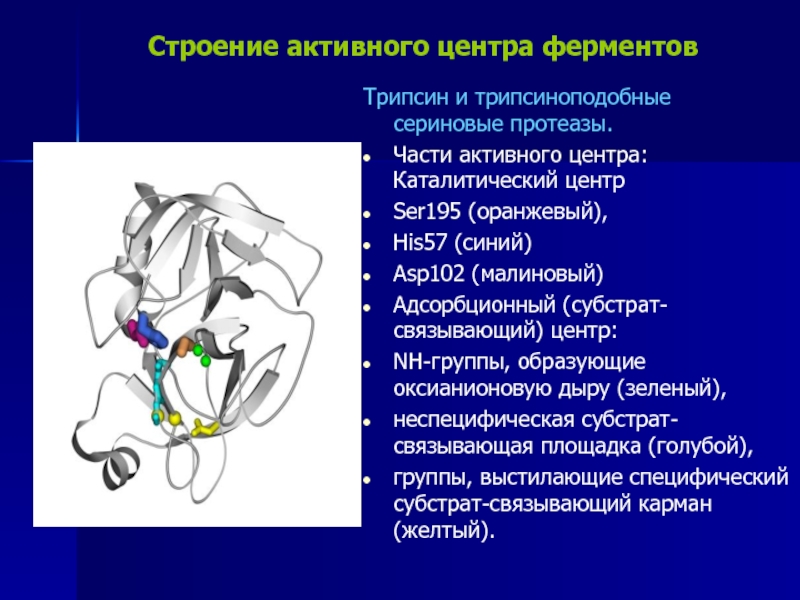
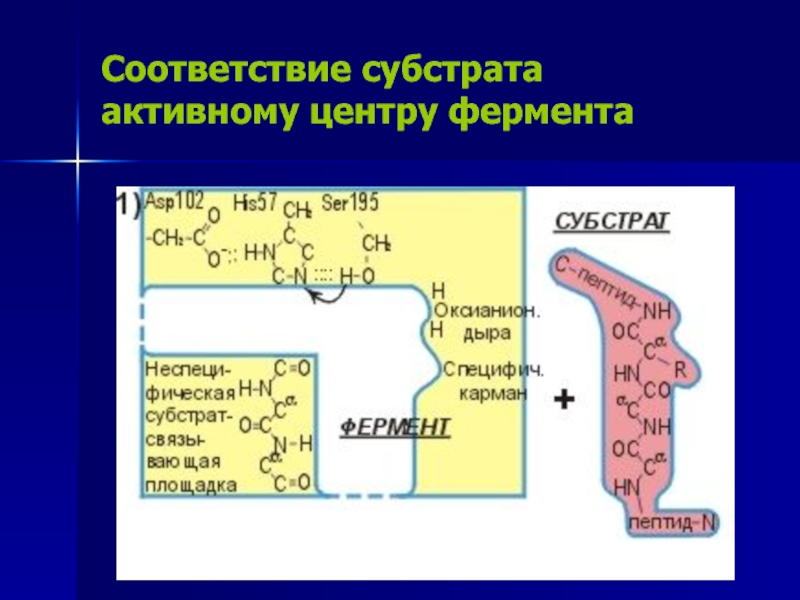
Слайд 13Строение активного центра ферментов
Трипсин и трипсиноподобные сериновые протеазы.
Части активного
центра: Каталитический центр
Ser195 (оранжевый),
His57 (синий)
Asp102 (малиновый)
Адсорбционный
(субстрат-связывающий) центр:
NH-группы, образующие оксианионовую дыру (зеленый),
неспецифическая субстрат-связывающая площадка (голубой),
группы, выстилающие специфический субстрат-связывающий карман (желтый).
Слайд 14Соответствие субстрата активному центру фермента
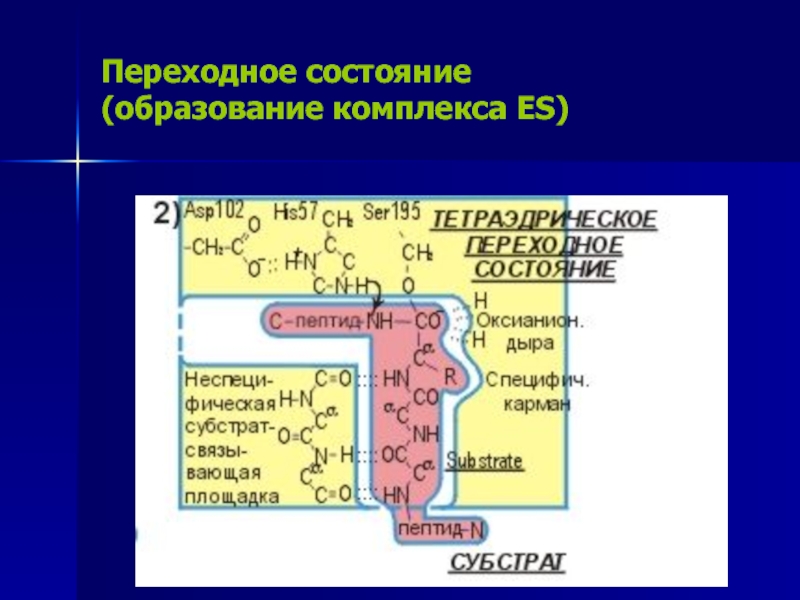
Слайд 15Переходное состояние
(образование комплекса ES)
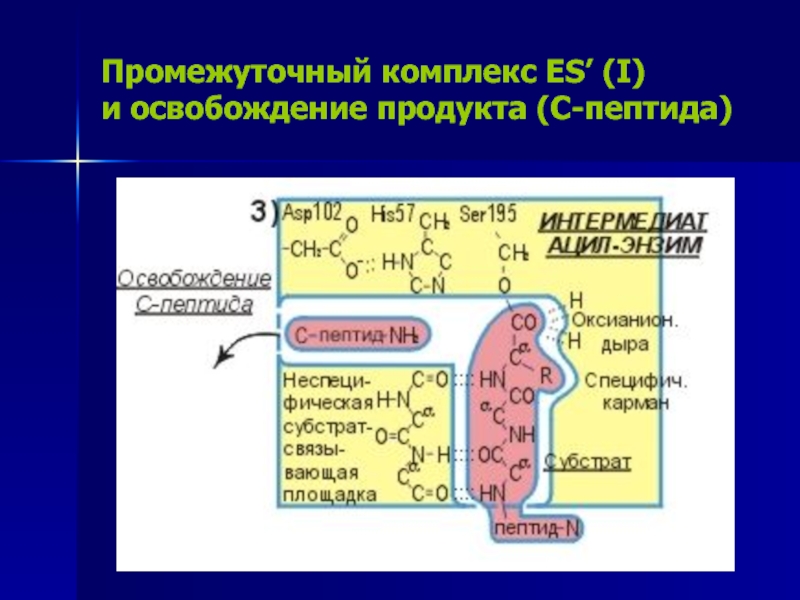
Слайд 16Промежуточный комплекс ES’ (I)
и освобождение продукта (C-пептида)
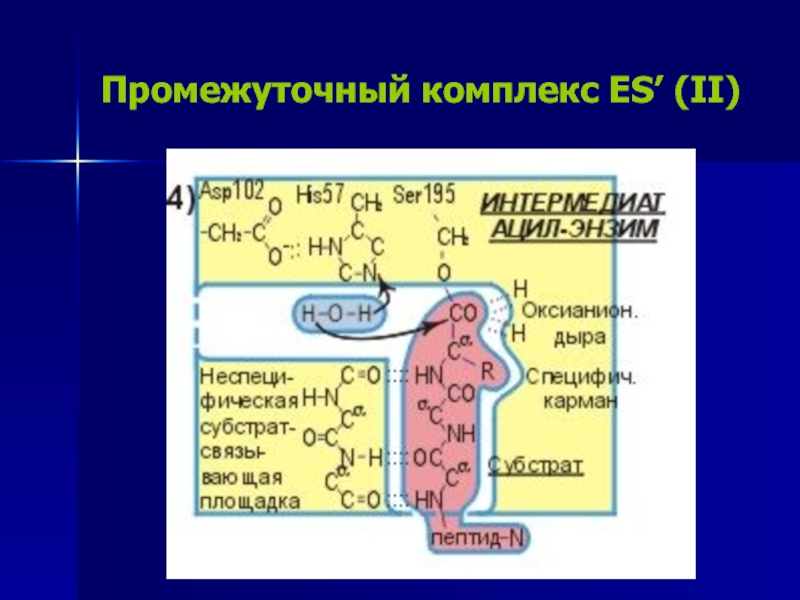
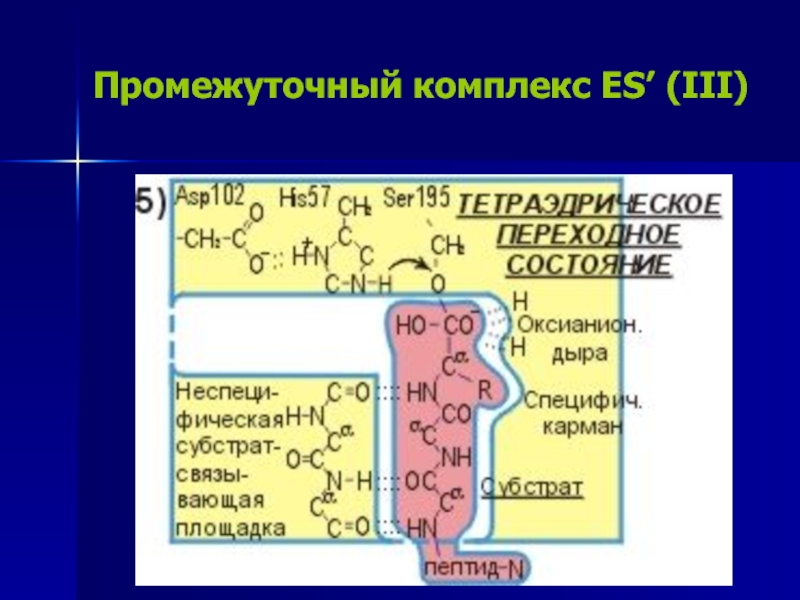
Слайд 18Промежуточный комплекс ES’ (III)
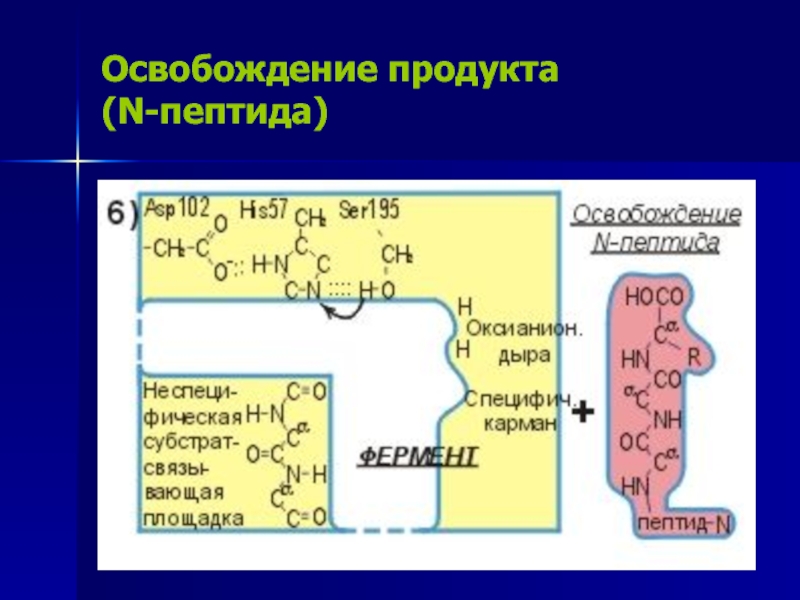
Слайд 19Освобождение продукта
(N-пептида)
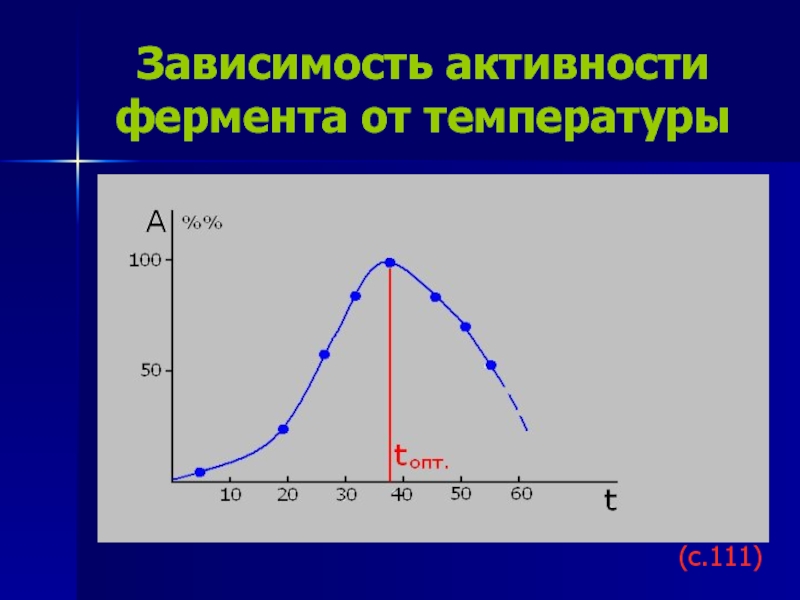
Слайд 20Зависимость активности фермента от температуры
(с.111)
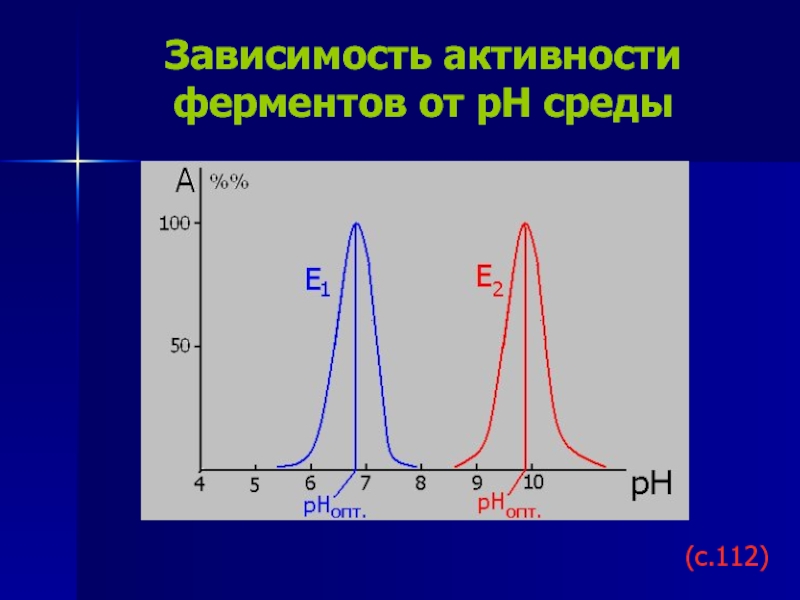
Слайд 21Зависимость активности ферментов от рН среды
(с.112)
Слайд 22Зависимость активности ферментов
от ионного состава среды
Влияние растворенных в
среде электролитов на активность ферментов – двоякое:
Ионная сила раствора оказывает
влияние на коллоидоустойчивость белков-ферментов
Некоторые ионы являются кофакторами ферментов
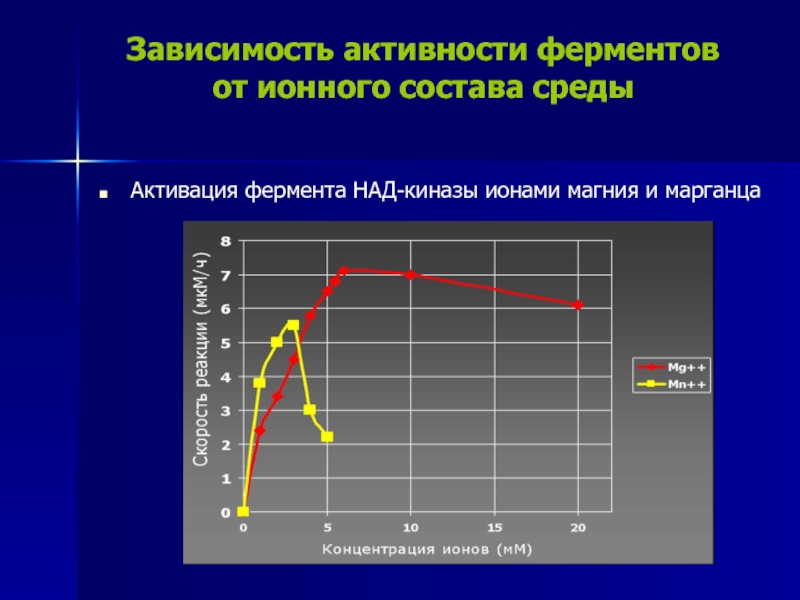
Слайд 23Зависимость активности ферментов
от ионного состава среды
Активация фермента НАД-киназы ионами
магния и марганца
Слайд 24Кофакторы ферментов
Кофакторами ферментов принято называть неорганические ионы, необходимые для выполнения
ферментами своей функции (например, ионы Mg++, Zn++, Mn++, Cu++ и
др.)
Слайд 25Коферменты
Низкомолекулярные небелковые органические соединения, необходимые для выполнения ферментами своих функций
Коферменты
участвуют в реакциях:
переноса электронов
перенос химических групп
Слайд 26Многие коферменты
образуются из витаминов
НАД и НАДФ – из витамина
РР
ТГФК – из фолиевой кислоты (Вс)
HS-КоА – из витамина
B3
Слайд 27Простетические группы
Это небелковые органические соединения, прочно связанные с молекулой
сложного белка.
Некоторые простетические группы сложных белков ферментов обладают коферментными функциями
(гем, ФАД, ФМН)
Слайд 28Активность ферментов
Активностью фермента называют его способность превращать определенное количество субстрата
в единицу времени
Молекулярная активность – количество молекул субстрата, превращенных в
продукт одной молекулой фермента за 1 минуту
Удельная активность – количество молей субстрата, превращенных в единицу времени в пересчете на единицу массы белка (или на единицу объема) исследованного биоматериала
Слайд 29Способы выражения активности ферментов
В системе СИ единица измерения активности (количества)
фермента: 1 Катал=1моль*с-1
1 катал – это такое количество фермента, которое превращает 1 моль субстрата за 1 секунду (=6*107 Юнит).
На практике чаще применяют единицу, называемую Юнит: 1 Юнит=1мкмоль*мин-1 1Юнит – это такое количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту (с.124)
При биохимическом анализе в клинике результаты определения активности ферментов обычно выражают количеством юнит в единице объема исследованного материала (кровь, моча и т.п.) – в системе СИ: количество катал в 1 м3
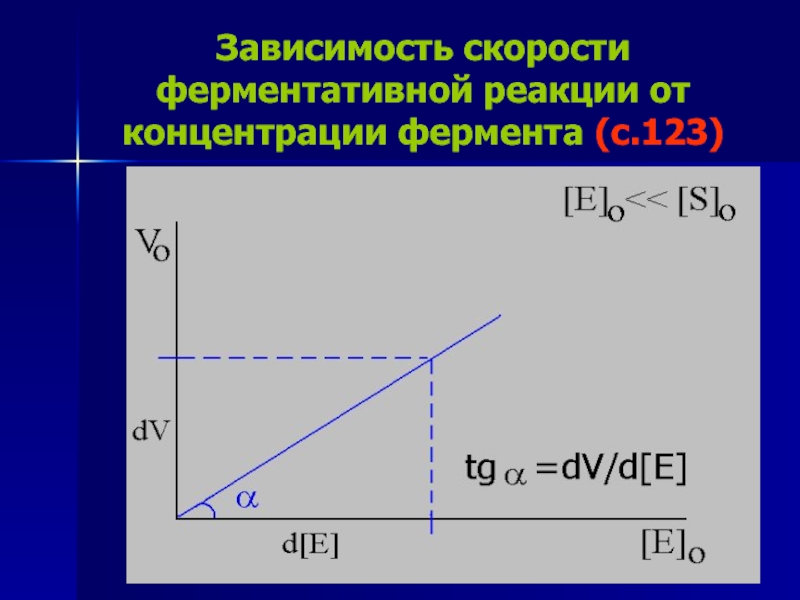
Слайд 30Зависимость скорости ферментативной реакции от концентрации фермента (с.123)
Слайд 31Причины изменения активности ферментов
Изменение скорости синтеза фермента (ускорение или замедление)
Ингибирование
ферментов
Активация ферментов
- аллостерическая активация
- переход неактивной формы фермента в активную
Слайд 32Ингибирование ферментов
Неспецифическое
Специфическое
2.1. Специфическое необратимое
2.2. Специфическое обратимое
2.2.1. Конкурентное
2.2.2. Неконкурентное
Слайд 33Образование активных форм ферментов из неактивных
Ограниченный протеолиз – гидролиз пептидной
связи и переход зимогена в активный фермент
Фосфорилирование – дефосфорилирование
Восстановление атома
S в активном центре тиолового фермента
Диссоциация фермента из комплекса с обратимыми ингибиторами
Слайд 34ИЗОФЕРМЕНТЫ
Изоферментами называют ферменты, катализирующие одну и ту же реакцию, но
отличающиеся по физико-химическим свойствам (pI, Mr)
Слайд 35Примеры использования ферментов в медицине
Обработка нагноившихся раневых поверхностей и полостей,
заполненных гнойным содержимым (протеазы)
Амилаза, протеазы и липаза – компоненты препаратов
для заместительной терапии при нарушении пищеварения
Определение содержания различных веществ в биологических жидкостях
- определение глюкозы энзиматическим глюкозооксидазным методом и т.п.
- иммунологические исследования с использованием ферментной метки методом ELISA* (пероксидаза хрена, щелочная фосфатаза)
Молекулярно-генетические исследования (метод ПЦР, получение рекомбинантных белков)
* ELISA = Enzyme linked immunosorbent assay
Слайд 36Примеры использования ферментов
Производство сыра, вина, пива, уксуса, патоки, хлебопечение
Изготовление
моющих средств с биодобавками
Обработка растительных волокон и древесины
Изготовление полусинтетических анибиотиков
Приготовление
питательных сред для микробиологических исследований
Изготовление биосенсоров, позволяющих проводить количественное определение различных веществ (с высокой чувствительностью)
Слайд 37Кинетика ферментативного катализа
Этапы ферментативного катализа (с.121)
k+1 k+2
E+S ES ES’ E+P
k-1
Слайд 39Уравнение
Михаэлиса-Ментен
(c.124)
























![Ферменты Зависимость V от [S] (c.125) Зависимость V от [S] (c.125)](/img/thumbs/6b8bac46fab704d80b9b3538cc60d948-800x.jpg)