Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фенолы
Содержание
- 1. Фенолы
- 2. НОМЕНКЛАТУРАФенолы называют тривиальными названиями:фенол С6H5OH, крезол H3C
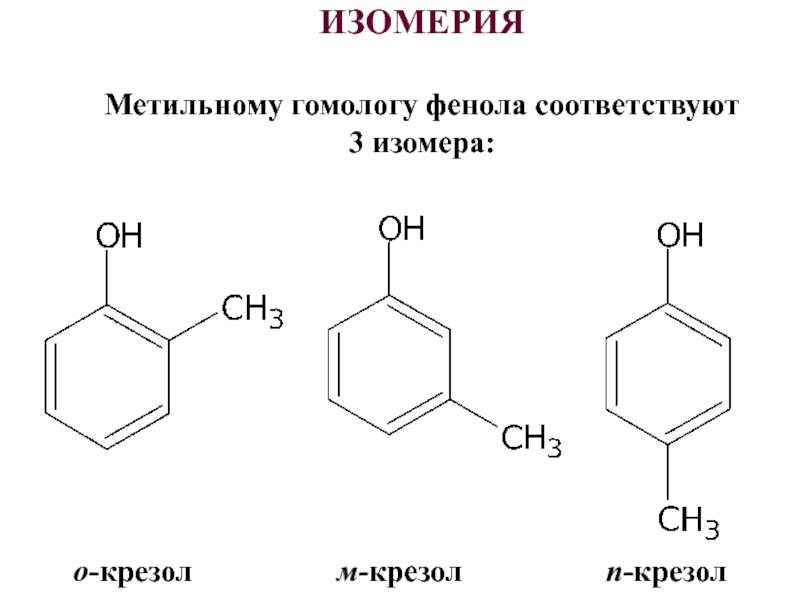
- 3. ИЗОМЕРИЯМетильному гомологу фенола соответствуют 3 изомера:
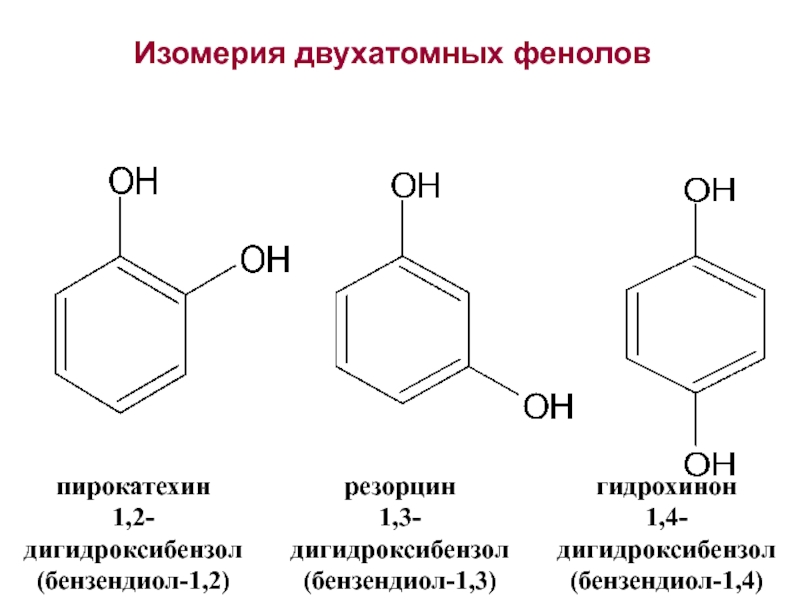
- 4. Изомерия двухатомных фенолов
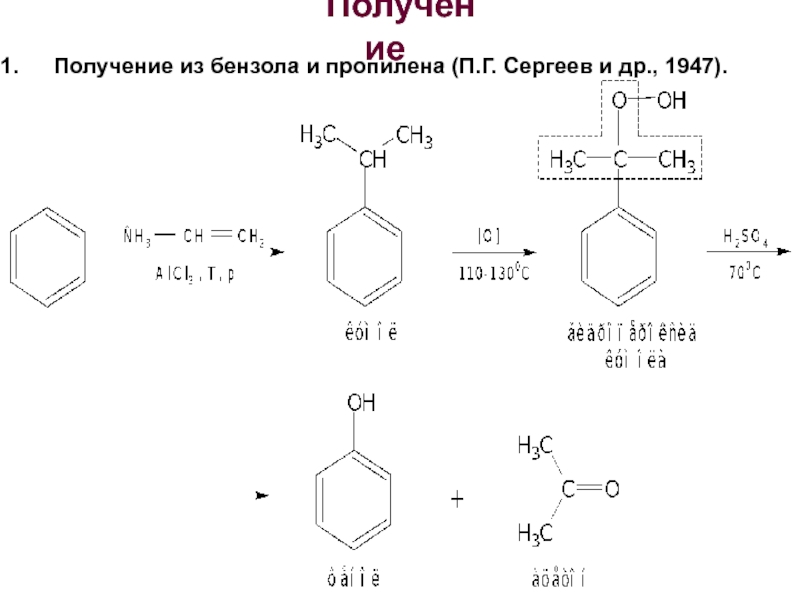
- 5. Получение Получение из бензола и пропилена (П.Г. Сергеев и др., 1947).
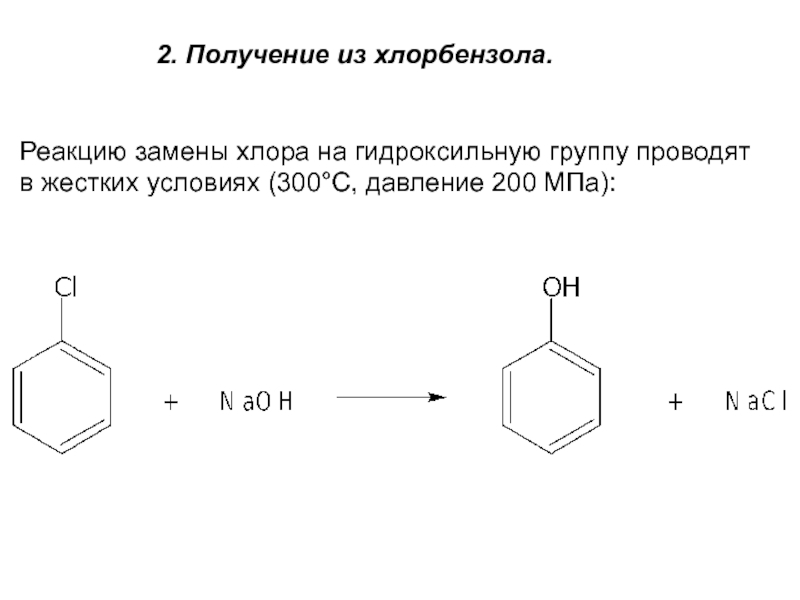
- 6. 2. Получение из хлорбензола.Реакцию замены хлора на
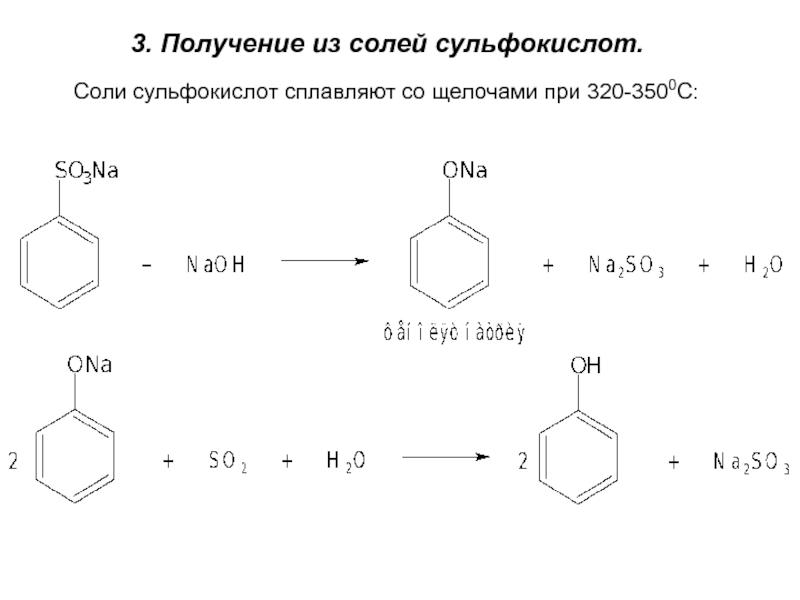
- 7. 3. Получение из солей сульфокислот.Соли сульфокислот сплавляют со щелочами при 320-3500C:
- 8. Физические свойстваФенол – кристаллическое вещество, трудно растворимое
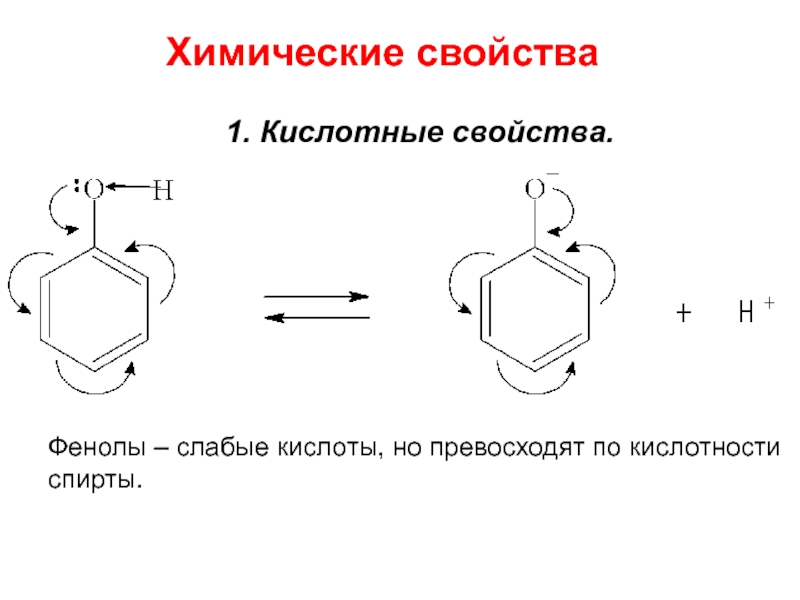
- 9. Химические свойства1. Кислотные свойства.Фенолы – слабые кислоты, но превосходят по кислотности спирты.
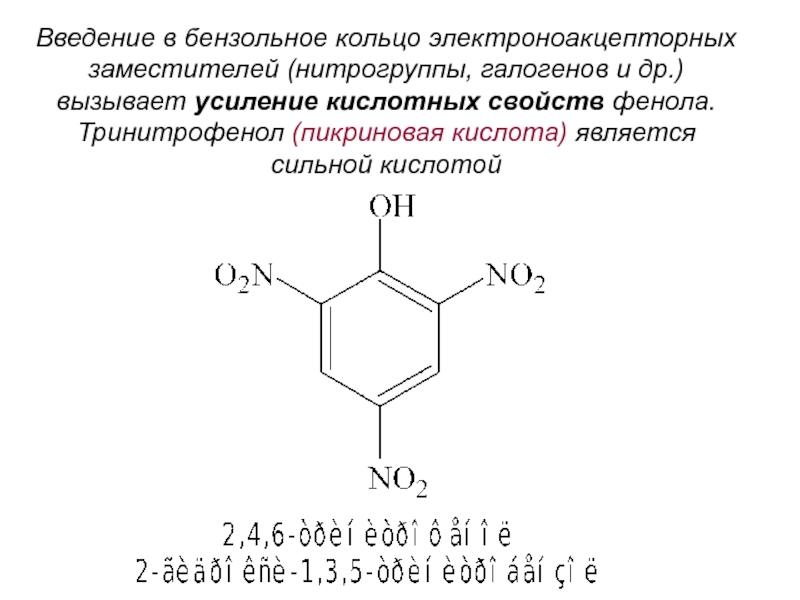
- 10. Введение в бензольное кольцо электроноакцепторных заместителей (нитрогруппы,
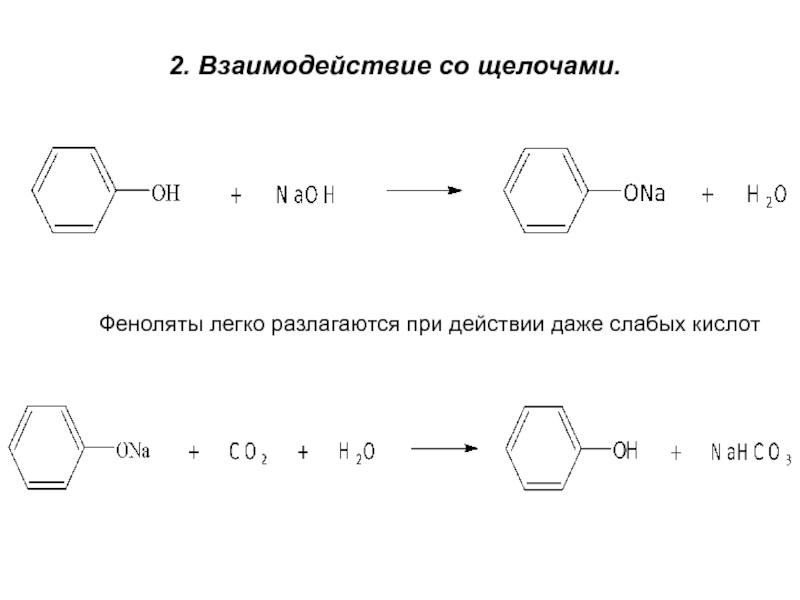
- 11. 2. Взаимодействие со щелочами.Феноляты легко разлагаются при действии даже слабых кислот
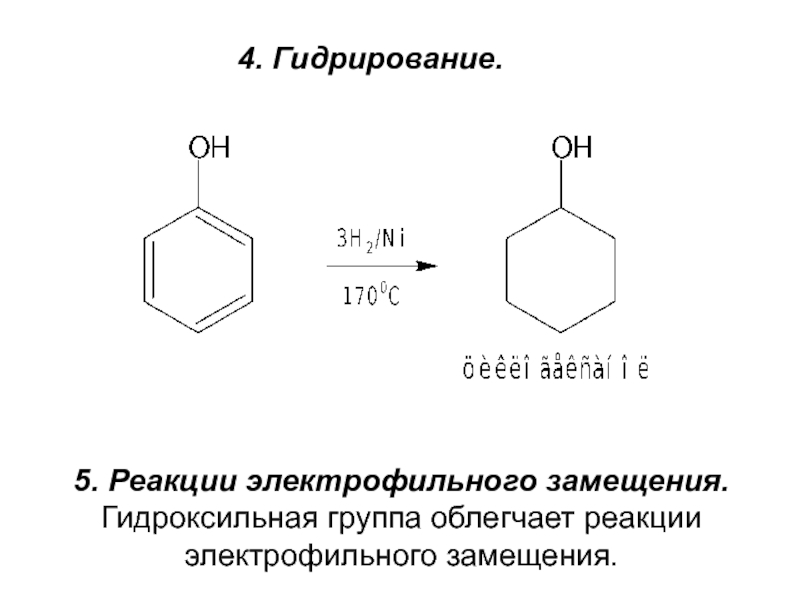
- 12. 4. Гидрирование.5. Реакции электрофильного замещения.Гидроксильная группа облегчает реакции электрофильного замещения.
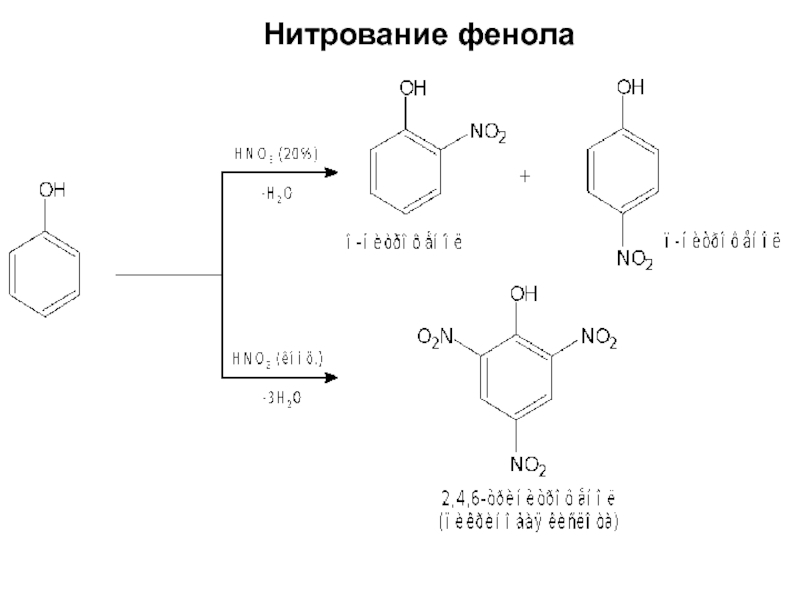
- 13. Нитрование фенола
- 14. Взаимодействие фенола с серной кислотой
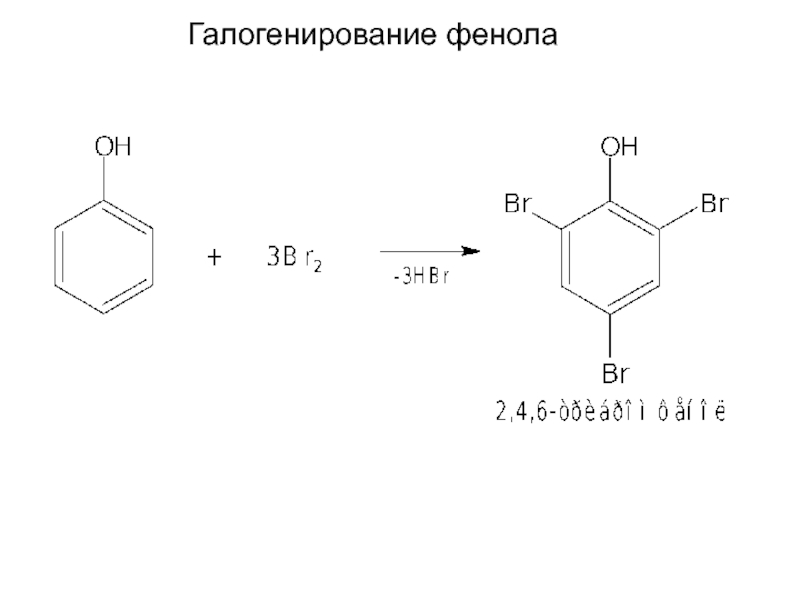
- 15. Галогенирование фенола
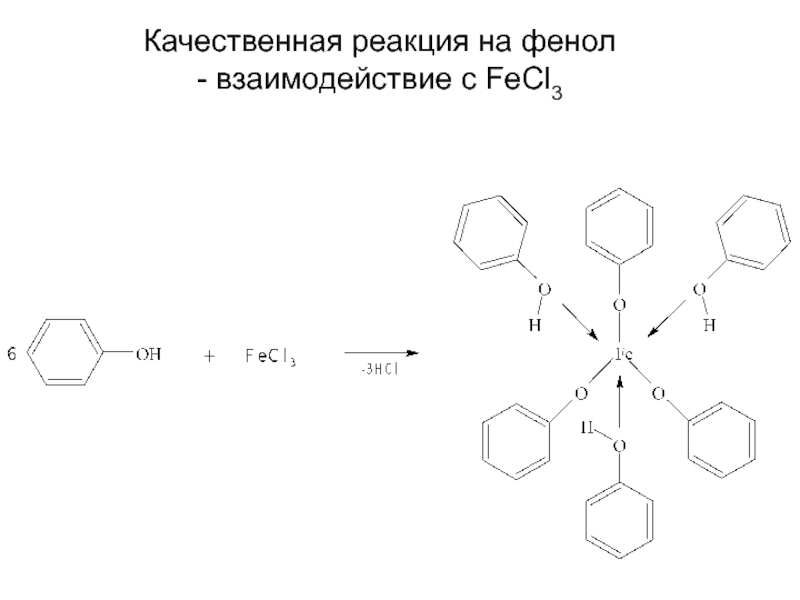
- 16. Качественная реакция на фенол - взаимодействие с FeCl3
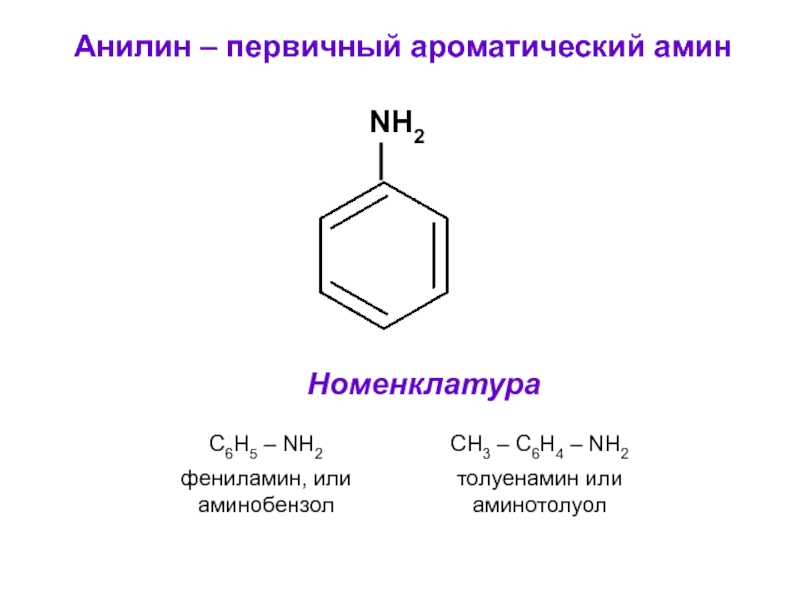
- 17. Анилин – первичный ароматический амин NH2 Номенклатура
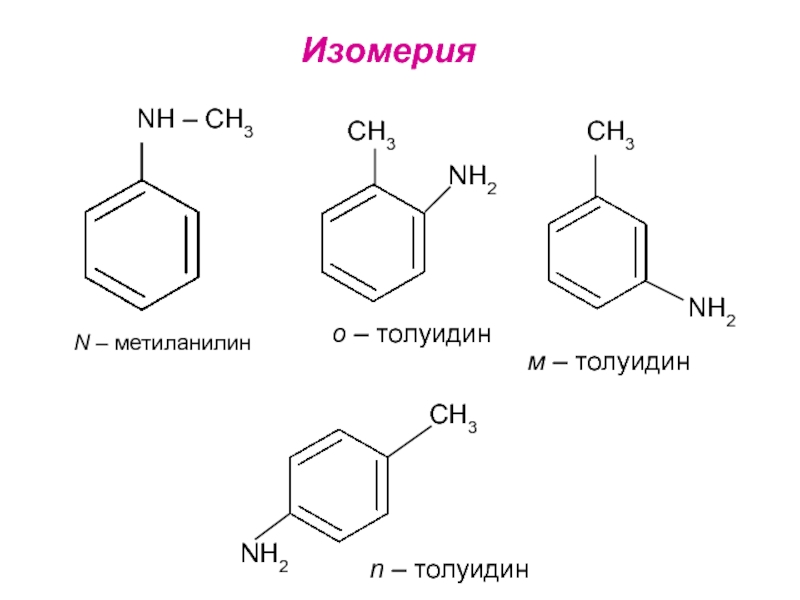
- 18. ИзомерияNH – CH3 N – метиланилин CH3NH2
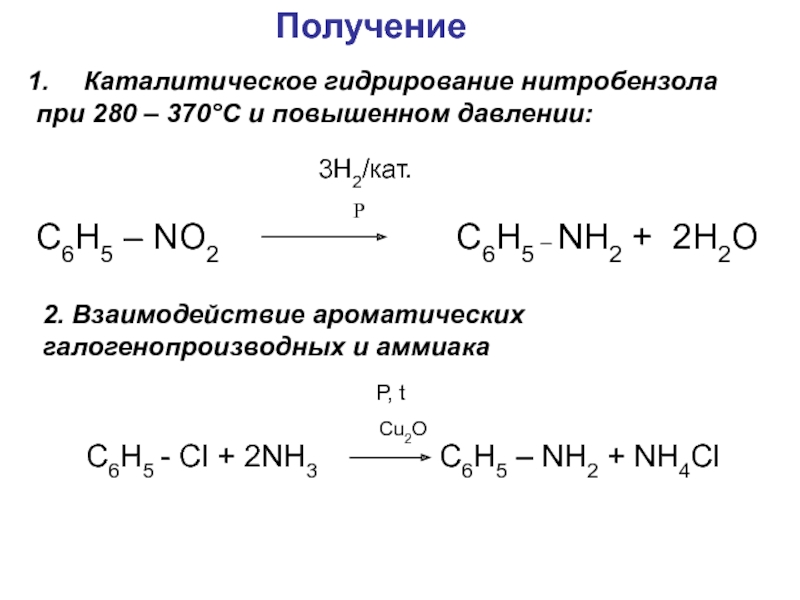
- 19. Получение Каталитическое гидрирование нитробензола при 280 –
- 20. Химические свойства Основность ароматических аминовAlk – NH2
- 21. Образование солей. С6H5 – NH2 + HCl
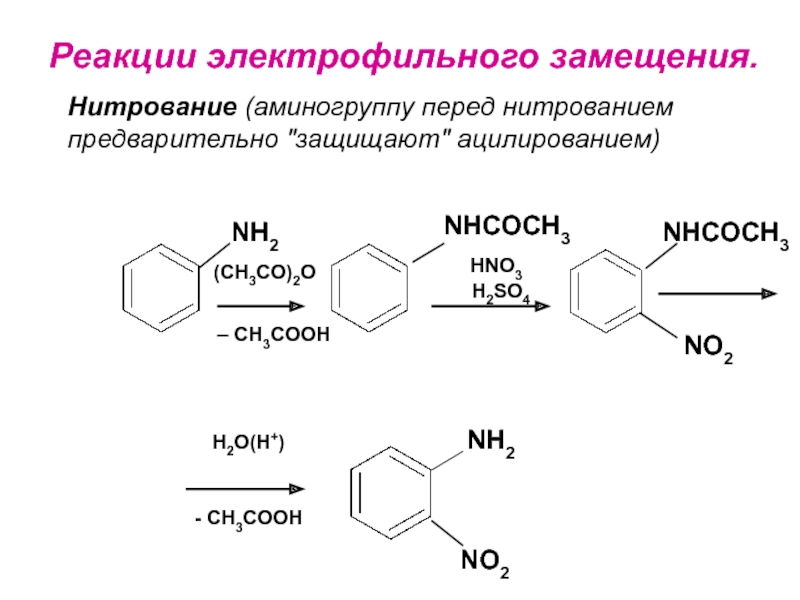
- 22. Реакции электрофильного замещения. Нитрование (аминогруппу перед нитрованием предварительно "защищают" ацилированием) NH2NHCOCH3NHCOCH3NO2(CH3CO)2O– CH3COOHH2SO4HNO3H2O(H+)- CH3COOHNH2NO2
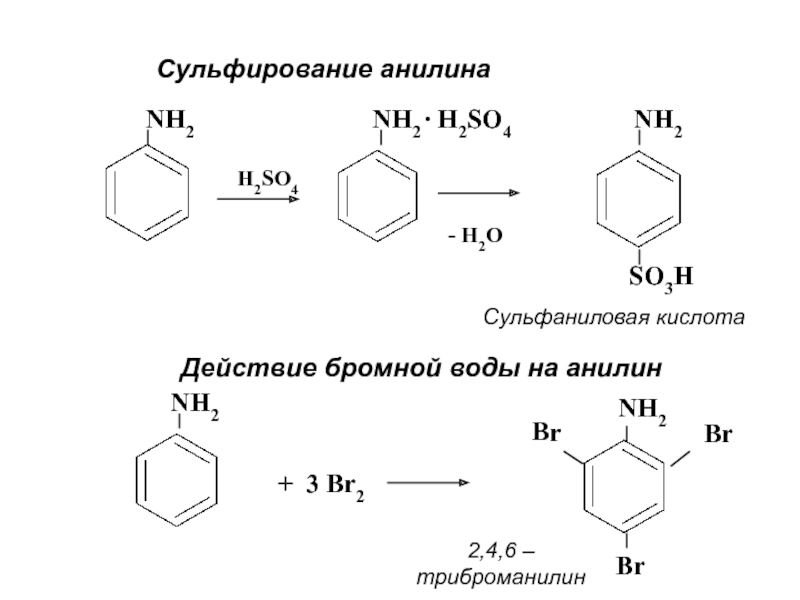
- 23. Cульфирование анилина NH2H2SO4 NH2 ∙ H2SO4- H2ONH2SO3HСульфаниловая
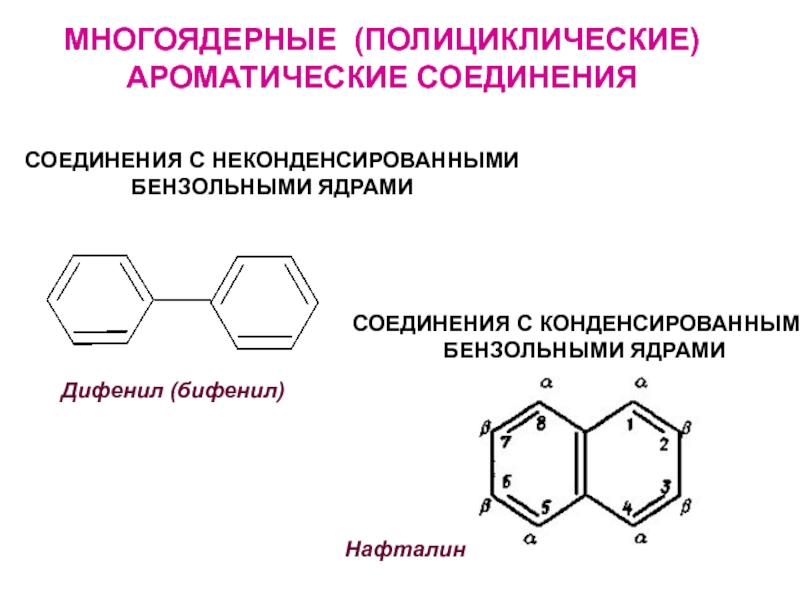
- 24. МНОГОЯДЕРНЫЕ (ПОЛИЦИКЛИЧЕСКИЕ) АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯСОЕДИНЕНИЯ С НЕКОНДЕНСИРОВАННЫМИБЕНЗОЛЬНЫМИ ЯДРАМИДифенил (бифенил) СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИБЕНЗОЛЬНЫМИ ЯДРАМИНафталин
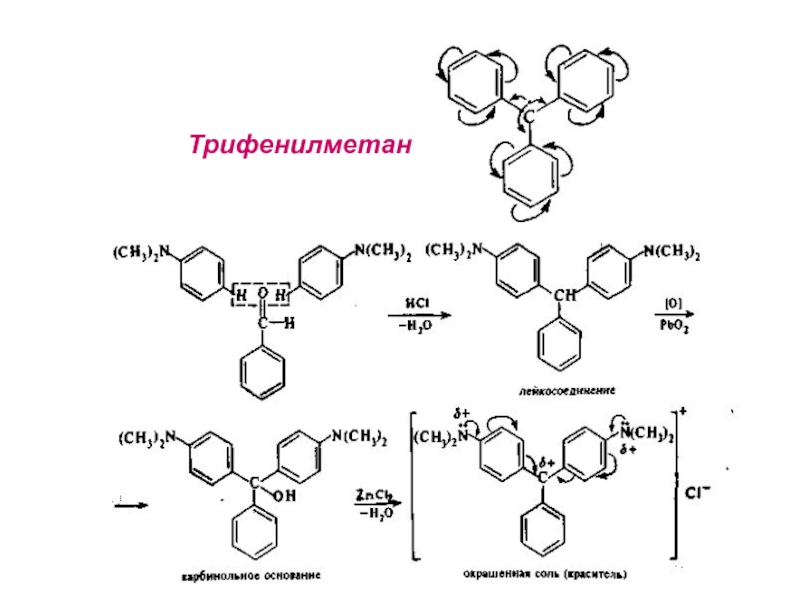
- 25. Трифенилметан
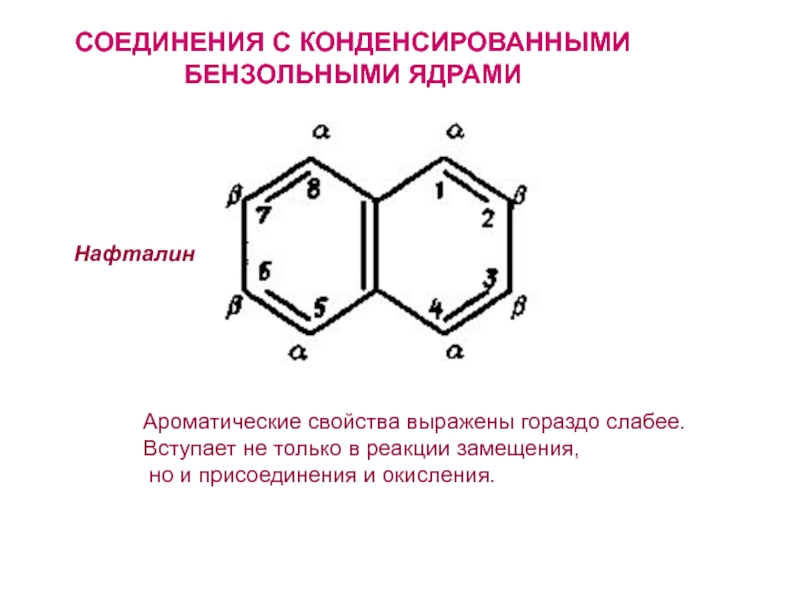
- 26. СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМИБЕНЗОЛЬНЫМИ ЯДРАМИНафталинАроматические свойства выражены гораздо
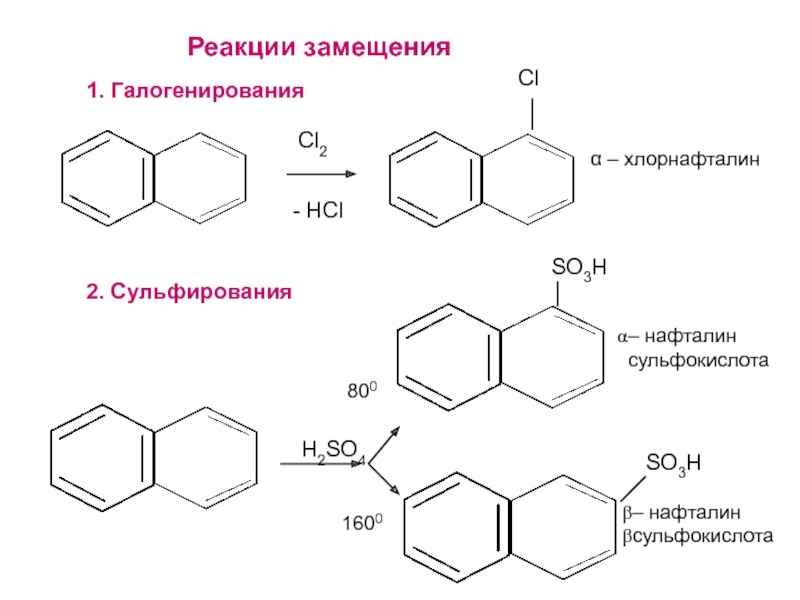
- 27. α – хлорнафталин – нафталинсульфокислота – нафталинсульфокислота Реакции замещения1. Галогенирования 2. Сульфирования - HClCl2ClSO3HSO3HH2SO48001600
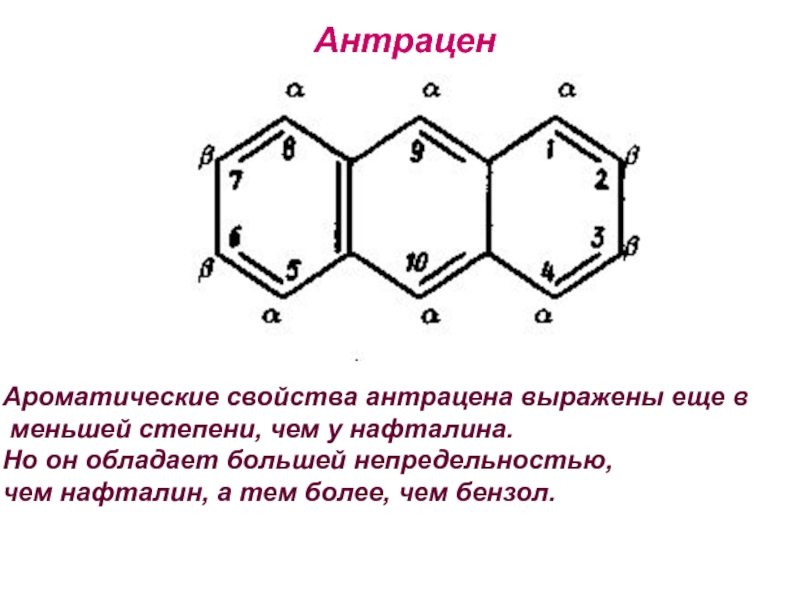
- 28. АнтраценАроматические свойства антрацена выражены еще в меньшей
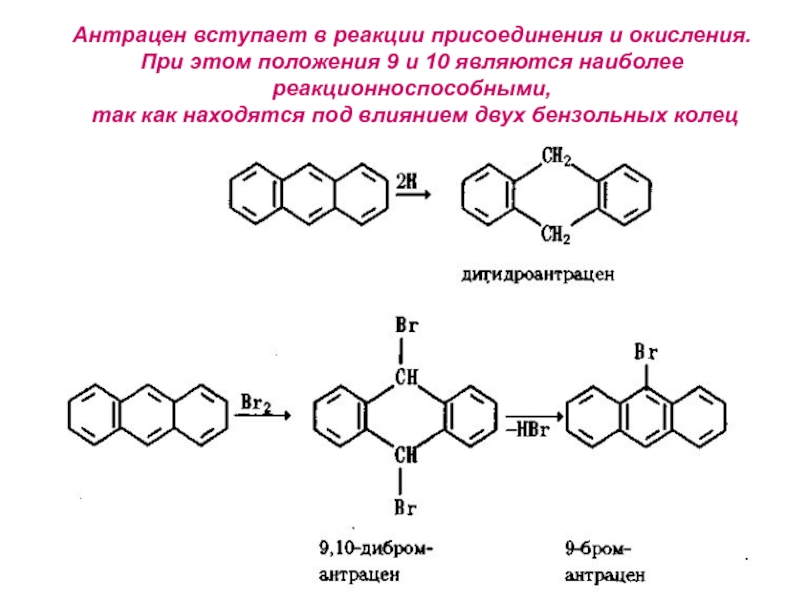
- 29. Антрацен вступает в реакции присоединения и окисления.
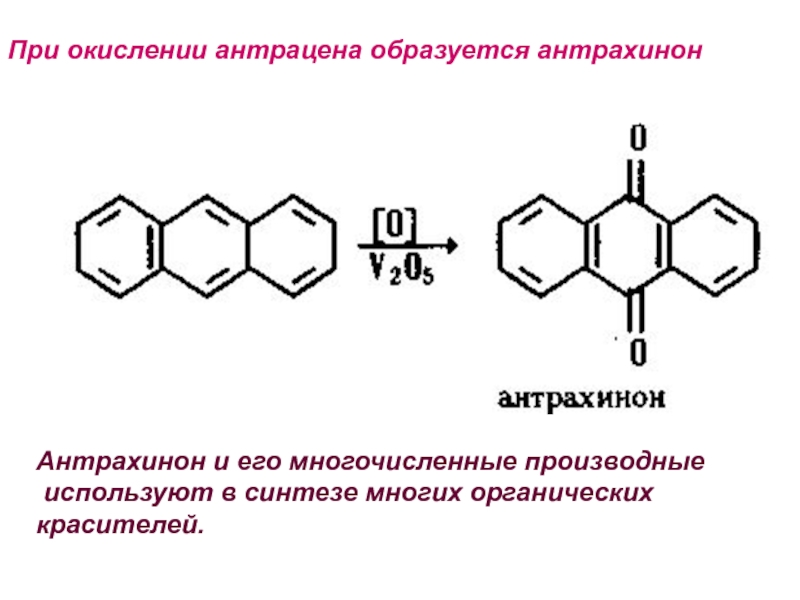
- 30. При окислении антрацена образуется антрахинонАнтрахинон и его многочисленные производные используют в синтезе многих органических красителей.
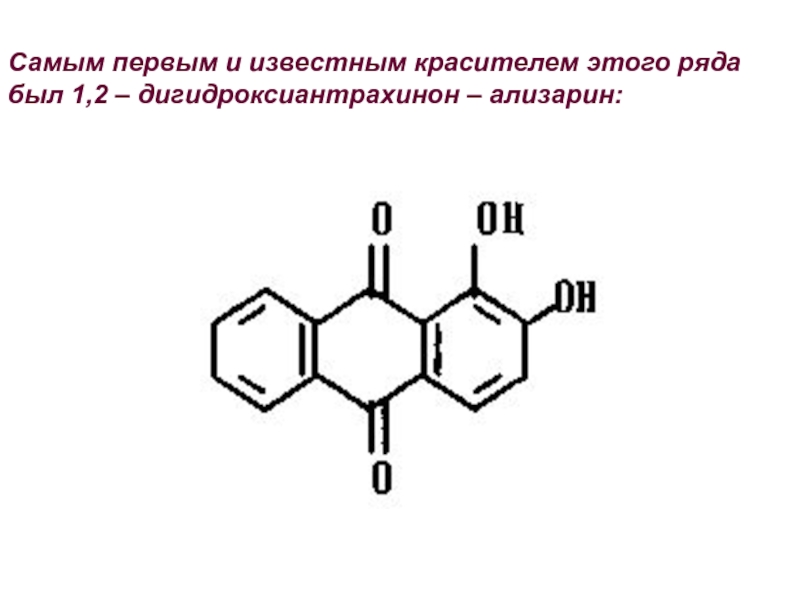
- 31. Самым первым и известным красителем этого ряда был 1,2 – дигидроксиантрахинон – ализарин:
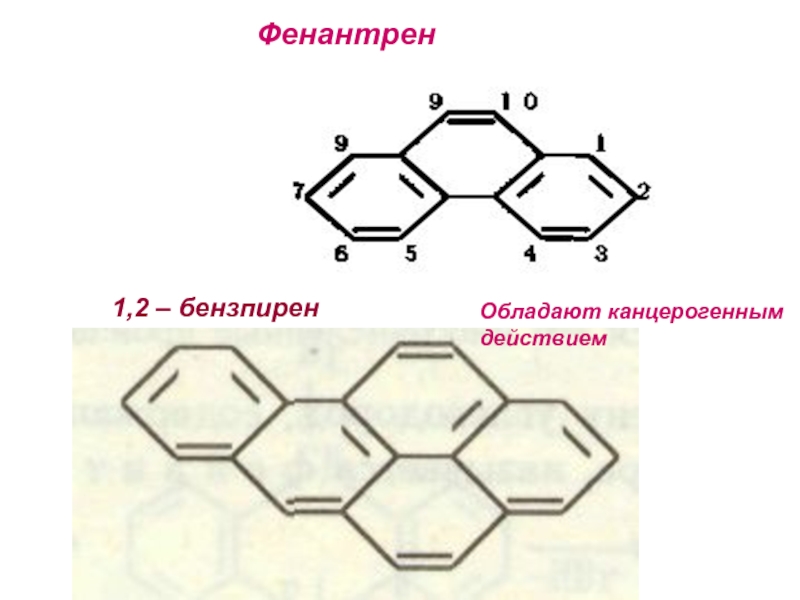
- 32. Фенантрен1,2 – бензпирен Обладают канцерогенным действием
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Фенолы – органические соединения,
содержащие в молекуле гидроксильную группу, связанную
непосредственно с бензольным ядром:
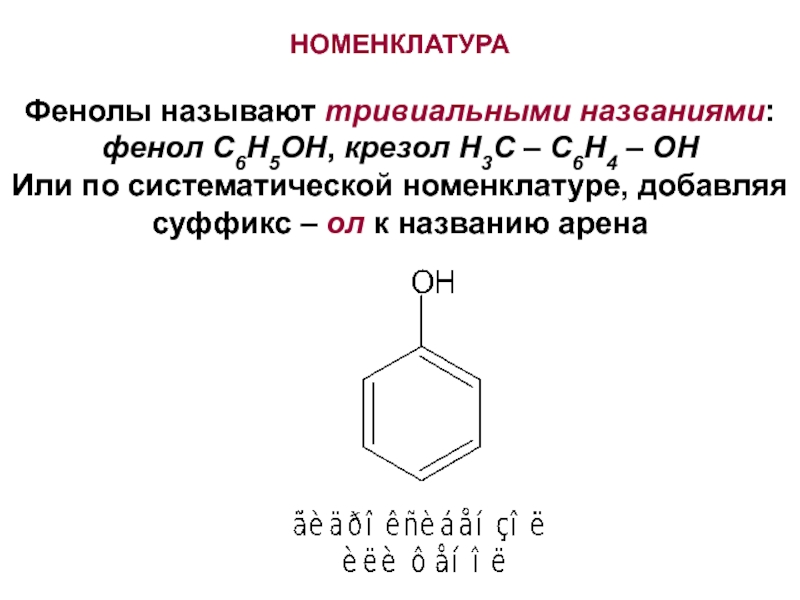
Слайд 2НОМЕНКЛАТУРА
Фенолы называют тривиальными названиями:
фенол С6H5OH, крезол H3C – C6H4 –
OH
Или по систематической номенклатуре, добавляя суффикс – ол к названию
аренаСлайд 62. Получение из хлорбензола.
Реакцию замены хлора на гидроксильную группу проводят
в жестких условиях (300°С, давление 200 МПа):
Слайд 8Физические свойства
Фенол – кристаллическое вещество,
трудно растворимое в воде.
С
увеличением числа гидроксильных групп
растворимость некоторых фенолов в воде
увеличивается.
Фенолы – ядовитые вещества.
Обычный фенол (карболовая кислота)
– сильный антисептик.
Слайд 9Химические свойства
1. Кислотные свойства.
Фенолы – слабые кислоты, но превосходят по
кислотности
спирты.
Слайд 10Введение в бензольное кольцо электроноакцепторных
заместителей (нитрогруппы, галогенов и др.)
вызывает усиление кислотных свойств фенола.
Тринитрофенол (пикриновая кислота) является
сильной
кислотой
Слайд 124. Гидрирование.
5. Реакции электрофильного замещения.
Гидроксильная группа облегчает реакции
электрофильного замещения.
Слайд 18Изомерия
NH – CH3
N – метиланилин
CH3
NH2
о – толуидин
CH3
NH2
м –
толуидин
CH3
NH2
n – толуидин
Слайд 19Получение
Каталитическое гидрирование нитробензола
при 280 – 370°С и
повышенном давлении:
Р
C6H5 – NO2
C6H5 – NH2 + 2H2O3H2/кат.
2. Взаимодействие ароматических
галогенопроизводных и аммиака
C6H5 - Cl + 2NH3
C6H5 – NH2 + NH4Cl
Р, t
Cu2O
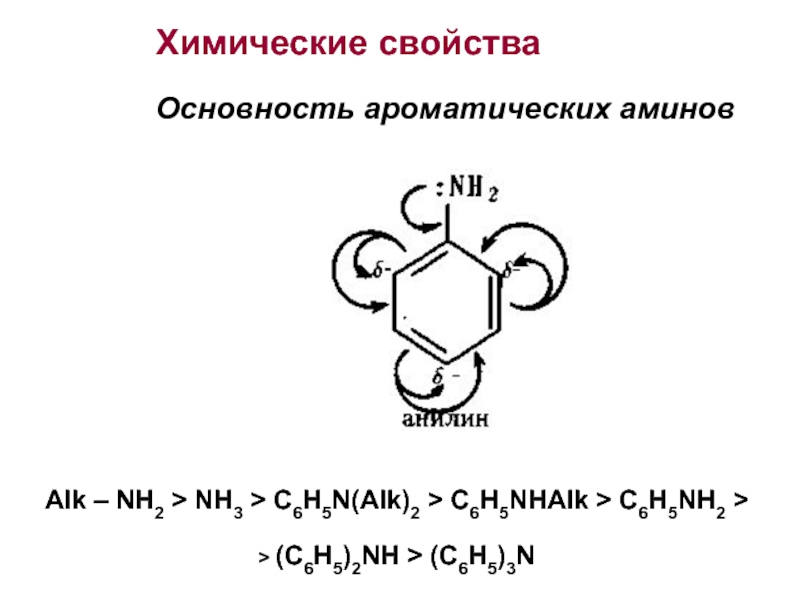
Слайд 20Химические свойства
Основность ароматических аминов
Alk – NH2 > NH3 >
C6H5N(Alk)2 > C6H5NHAlk > C6H5NH2 >
> (C6H5)2NH > (C6H5)3N
Слайд 21Образование солей.
С6H5 – NH2 + HCl → [C6H5 –
NH3]+Cl-
солянокислыйанилин
2. Реакции алкилирования и ацилирования
C6H5 – NH2 + CH3 – I → C6H5 – NH – CH3 + HI
C6H5 – NH2 + ClCOCH3 → C6H5 – NHCOCH3 + HCl



![Фенолы Образование солей. С6H5 – NH2 + HCl → [C6H5 – NH3]+Cl- Образование солей. С6H5 – NH2 + HCl → [C6H5 – NH3]+Cl-](/img/thumbs/94d22f2f80ffa76d392586a5df97f229-800x.jpg)