Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты
Содержание
- 1. Ферменты
- 2. ФерментыФерменты – высокоспецифические белковые катализаторы, присутствующие во
- 3. Номенклатура1. Тривиальная номенклатура(пепсин, трипсин, папаин).2. Рациональная номенклатура.
- 4. Каждый фермент имеет четырехзначный кодовый индекс (шифр)
- 5. Классификация ферментов Оксиредуктазы (окислительно- восстановительные реакции)
- 6. Оксиредуктазы- ферменты, катализирующие реакции окисления-восстановления с участием
- 7. Трансферазы- ферменты, катализирующие перенос функцион. групп и
- 8. Гидролазы- ферменты, катализирующие гидролиз эфирных, сложноэфирных, пептидных
- 9. Лиазы- ферменты, отщепляющие от субстратов определенных групп
- 10. Изомеразы- ферменты, катализирующие пространственные или структурные перестройки
- 11. Лигазы- ферменты, катализирующие реакцию связывания двух субстрат
- 12. Специфичность действия ферментов- это способность
- 13. Изоферменты (изозимы)— это молекулярные формы одного и
- 14. Мультиферменты- ферменты, обладающие способностью одновременно ускорять несколько химических реакций и осуществлять сложные превращения субстрата.
- 15. Активность фермента (Е).Каталитическая активность фермента — это
- 16. Список использованной литературыМарри Р., Греннер Д.,Мейес П.,
- 17. Скачать презентанцию
ФерментыФерменты – высокоспецифические белковые катализаторы, присутствующие во всех живых клетках. Ферменты – это функциональные единицы клеточного метаболизма.
Слайды и текст этой презентации
Слайд 2Ферменты
Ферменты – высокоспецифические белковые катализаторы, присутствующие во всех живых клетках.
Слайд 3Номенклатура
1. Тривиальная номенклатура(пепсин, трипсин, папаин).
2. Рациональная номенклатура.
Название субстрата + окончание –аза. Примеры: амилаза, липаза, протеаза,
уреаза и др.Слайд 4Каждый фермент имеет четырехзначный кодовый индекс (шифр) и систематическое название.
АТР:
гексоза 6 фосфотрансфераза:
2.7.1.1.
2- класс трансферазы
7- подкласс фосфотрансферазы
1- подподкласс фосфотрансферазы
с гидроксильной группой1- порядковый номер показы
Слайд 5
Классификация ферментов
Оксиредуктазы (окислительно- восстановительные реакции)
Трансферазы (перенос функциональных групп)
Гидролазы (гидролиз
с присоединением воды)
Лиазы (добавление к двойным связям или удаление от
них функциональных групп)Изомеразы (внутримолекулярный перенос групп)
Лигазы (связывание двух субстратов с расходом энергии АТФ)
Слайд 6Оксиредуктазы
- ферменты, катализирующие реакции окисления-восстановления с участием двух субстратов, S
и S, :
Sвосст + S,окис = Sокис + S,восст
Катализируют
реакции, в которых участвуют такие группы, как СН-ОН, СН-СН, С=О, СН-NН2 и –СН-NН-.Алкоголь: NAD+ оксидоредуктаза :
Спирт + NAD+ = альдегид или кетон + NADH + H+
Слайд 7Трансферазы
- ферменты, катализирующие перенос функцион. групп и молекул. остатков. (G)
с субстрата S на субстрат S, :
S-G + S, = S,-G + SАцетил-СоА: холин О-ацетилтрансфераза
Ацетил-СоА + Холин = СоА + О-Ацетилхолин
Слайд 8Гидролазы
- ферменты, катализирующие гидролиз эфирных, сложноэфирных, пептидных и гликозильных связей,
связей С-С, С-галоида и Р-N.
Ацилхолин – ацилгидролаза:
Ацилхолин +
Н2О = Холин + КислотаСлайд 9Лиазы
- ферменты, отщепляющие от субстратов определенных групп атомов по негидролитическому
механизму, с образованием двойных связей.
Ферменты, действующие на связи С-С,
С-О, С-N, С-S и С- галоид.L-малат – гидро-лиаза:
L-малат = Фумарат + Н2О
Слайд 10Изомеразы
- ферменты, катализирующие пространственные или структурные перестройки в пределах одной
молекулы.
Все-транс-Ретиналь 11-цис-транс-изомераза:
все-транс-Ретиналь = 11-цис-Ретиналь
Слайд 11Лигазы
- ферменты, катализирующие реакцию связывания двух субстрат с расходом энергии
АТФ.
Ферменты , образующие связи С-О, С-S, С-N и С-С.
L-Глутамат: аммиак
лигаза (ADP) :АТР + L-Глутамат + NH4+ = ADP + Ортофосфат+ L-Глутамин
Слайд 12 Специфичность действия ферментов
- это способность фермента катализировать одну
и только одну специфическую реакцию.
1) Абсолютной специфичностью называют способ-
ность фермента катали- зировать превращение
только единственного
субстрата.
2)Групповая специфичность - катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи(пептидная связь) или химической группы (ОН-группа).
3)Оптическая специфичность (стереоспецифичность)-катализ только одного из стереоизомеров. Пример:D и L-специфичность аминокислот.
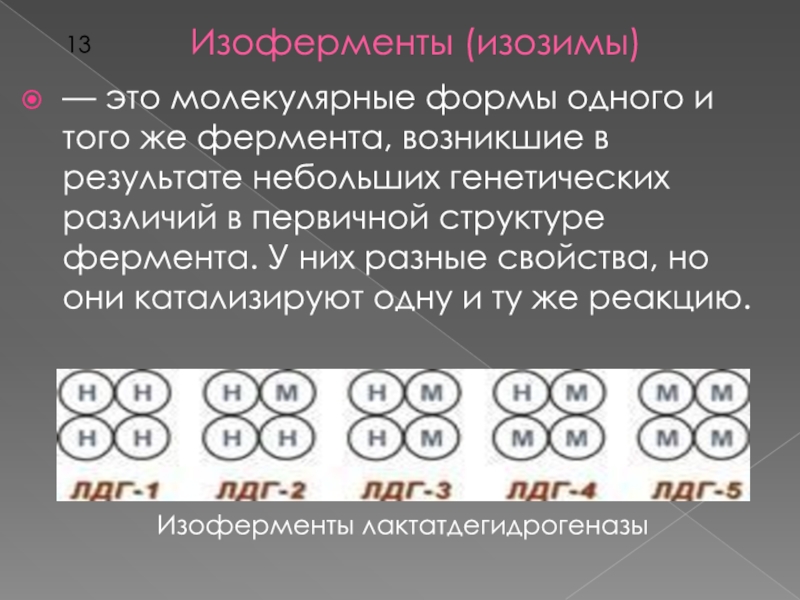
Слайд 13Изоферменты (изозимы)
— это молекулярные формы одного и того же фермента,
возникшие в результате небольших генетических различий в первичной структуре фермента.
У них разные свойства, но они катализируют одну и ту же реакцию.Изоферменты лактатдегидрогеназы
Слайд 14Мультиферменты
- ферменты, обладающие способностью одновременно ускорять несколько химических реакций и
осуществлять сложные превращения субстрата.
Слайд 15Активность фермента (Е).
Каталитическая активность фермента — это способность фермента превращать
большое количество молекул субстрата, в то время как сам он
к концу реакции остается неизменным. Каталитическую активность ферментов выражают в единицах активности.Международная единица активности (E) — это количество фермента, которое катализирует превращение 1 мкмоля субстрата в 1 минуту в оптимальных условиях для данного ф-та (рН, t-ра и др.)
Единица активности в системе СИ (катал) — соответствует количеству фермента, которое катализирует превращение 1 моля субстрата в 1 секунду.
1ед. акт = 1мкМ /мин.
1 катал = 1М/сек
Слайд 16Список использованной литературы
Марри Р., Греннер Д.,Мейес П., Родуэлл В. Биохимия
человека: в 2 т. / Гл. ред.: Л.М. Гинодман -
Т. 1. Пер. с англ.: - М.: Мир, 1993. – 384 с.Филиппович Ю.Б. Основы биохимии: Учб. для хим. и биол. спец. пед. ун-тов и ин-тов. – 4-е издание, перераб. и доп. – М.: изд-во «Агар», 1999,-512 с.
Ленинджер А. Основы биохимии: В 3-х т. Т. 1. Пер. с англ.- М.: Мир, 1985. – 367 с.
Диксон М., Уэбб Э. Ферменты: пер.англ. – М.: Мир, 1982.- т. 1. – 370-375 с.