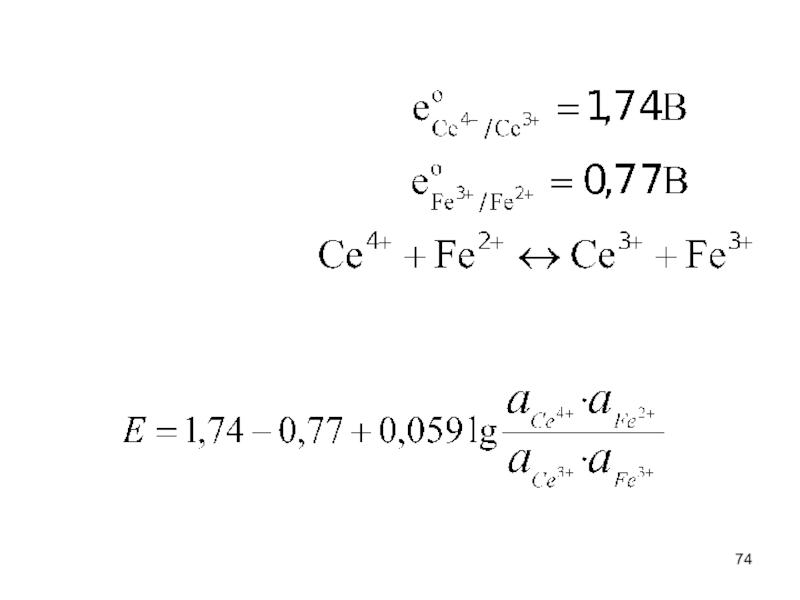Слайд 1
«Электродные потенциалы.
Гальванические элементы. ЭДС.»
Кафедра общей и медицинской химии
Слайд 4(22.09.1791 - 25.08.1867)
Директор лаборатории (1825 г.) и профессор Королевского института
(1827 г.).
Самостоятельно проводил исследования по химии к важнейшим из которых
относятся получение бензола и сжижение хлора.
Майкл Фарадей
Английский физик и химик,
член Лондонского королевского общества
Электролиз
Установил (1833 г.) количественные
законы электролиза.
Слайд 5Электролиз
– окислительно-восстановительный процесс, происходящий на электродах при прохождении постоянного
электрического тока через раствор или расплав электролита
Слайд 6Анод(+) – положительно заряженный электрод,
на аноде окисляются (теряют электроны)
анионы
(АА)!!!!!!! – к Аноду идут Анионы
Катод(-) – отрицательно заряженный
электрод,
на катоде восстанавливаются (присоединяют электроны) катионы металлов и ионы Н+
(ККК) !!!!!! – К Катоду идут Катионы
Слайд 7При электролизе растворов или расплавов различных химических соединений одинаковые количества
электричества выделяют на электродах массы веществ, пропорциональные их химическим эквивалентам
F
= 96485 Кл/моль
F = qe·NA –
количество электричества, переносимое
1 моль электронов (однозарядных ионов).
n- число электронов
Слайд 8Задача
Рассчитать массу хрома полученного электролизом раствора сульфата хрома(III) в течение
100 мин при силе тока 75 А?
Слайд 9Решение
Электролиз раствора сульфата хрома(III) можно представить cледующей схемой:
Cr2(SO4)3 + 4H2O→2Cr
+ H2↑ + 2O2↑ + 3H2SO4
В процессе электролиза катион хрома
принимает три электрона, превращаясь в атом:
Cr3+ +3e → Cr0
Слайд 10Значение электролиза
1. Получение чистых металлов электролизом
Слайд 11Инертный анод
Восстановление на катоде (–)
Окисление на аноде (+)
Инертный катод
Схема электролиза
Слайд 13Электролитическое копирование гравированных пластин
для печатания бумажных денег
2. Гальваническое
осаждение металлов
Слайд 143. Создание химических
источников тока.
а) бытовые батарейки
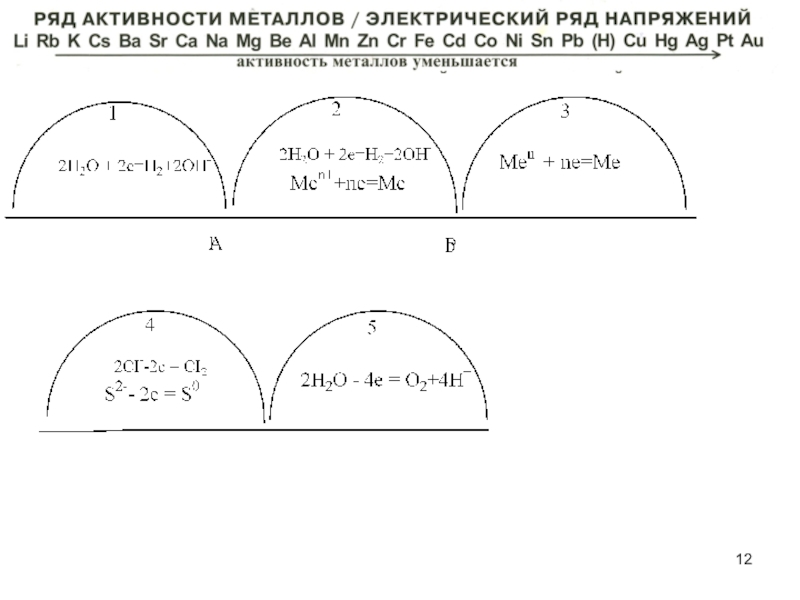
Коррозия
– совокупность самопроизвольных окислительно -восстановительных процессов под воздействием окружающей среды, приводящих к разрушению металла.
Men+-ne→ Me0
Слайд 16а) химическая – взаимодействие металлов с газами
или жидкостями -
неэлектролитами
2Fe+3SO2+3O2
Fe2(SO4)3
Слайд 17б) электрохимическая
(распространена в гораздо большей степени!
ее и обсудим!)
Слайд 18 Металлы и их сплавы неоднородны, поэтому при контакте с
водой на поверхности образуется множество гальванических пар.
Большинство металлов окисляется кислородом
воздуха, образуя
на поверхности оксидные пленки.
Если кристаллическая решетка оксида близка к кристаллической решетке металла, то эта пленка прочная, плотная, хорошо связана с поверхностью и защищает металл от дальнейшего разрушения.
«Повезло» Zn, AI, Cr, Ni, Sn, Pb!
«Не повезло» железу, оксидная пленка которого рыхлая, пористая, легко отделяется от поверхности и не способна защитить его от коррозии !
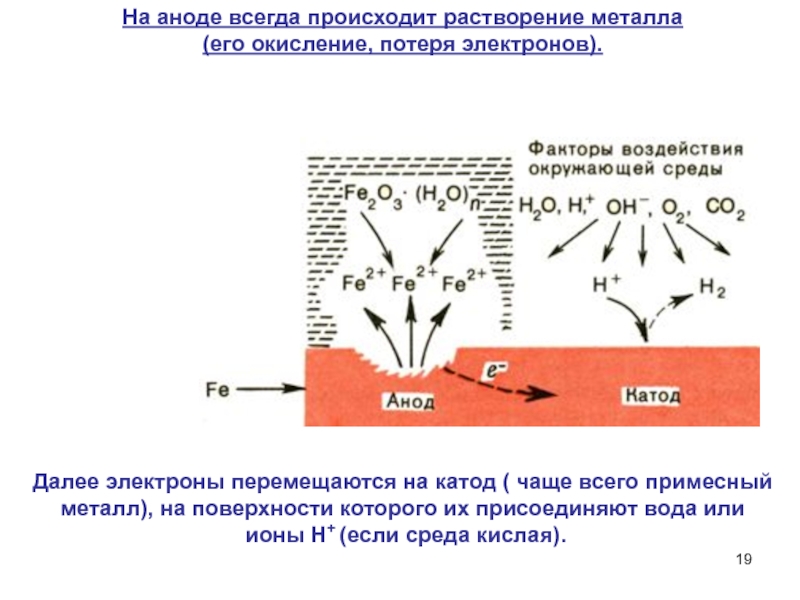
Слайд 19Далее электроны перемещаются на катод ( чаще всего примесный металл),
на поверхности которого их присоединяют вода или
ионы Н+ (если
среда кислая).
На аноде всегда происходит растворение металла
(его окисление, потеря электронов).
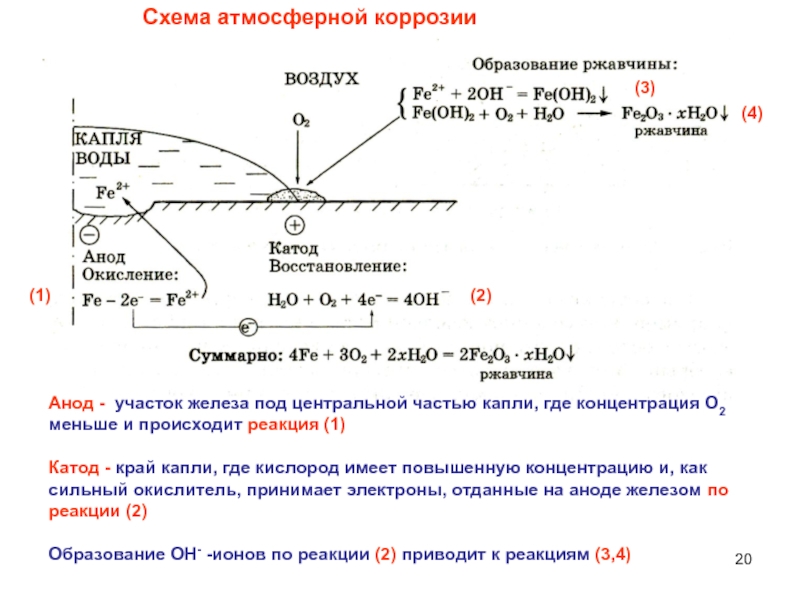
Слайд 20Схема атмосферной коррозии
Анод - участок железа под центральной частью
капли, где концентрация О2 меньше и происходит реакция (1)
Катод -
край капли, где кислород имеет повышенную концентрацию и, как сильный окислитель, принимает электроны, отданные на аноде железом по реакции (2)
Образование ОН- -ионов по реакции (2) приводит к реакциям (3,4)
(1)
(2)
(3)
(4)
Слайд 21 Процесс коррозии резко усиливается из-за наличия микропримесей менее активных,
чем железо металлов, которые начинают выполнять роль катода.
(помним, что активные металлы охотно отдают электроны, поэтому при контакте двух металлов электроны всегда устремляются к менее активному, где и происходит восстановление воды !)
Слайд 231. Защитное покрытие (лаки, краски, пленки, смазки) – блокируется выход
металла в виде ионов и доступ окислителей
2. Использование легированных сплавов
- снижают скорость коррозии в конкретной коррозионно-активной среде.
Слайд 243. Введение ингибиторов коррозии –чаще всего при транспортировке агрессивных жидкостей
по железной дороге или трубопроводам
4. Снижение агрессивности среды – деаэрация
воды (удаление О2) на промышленных предприятиях.
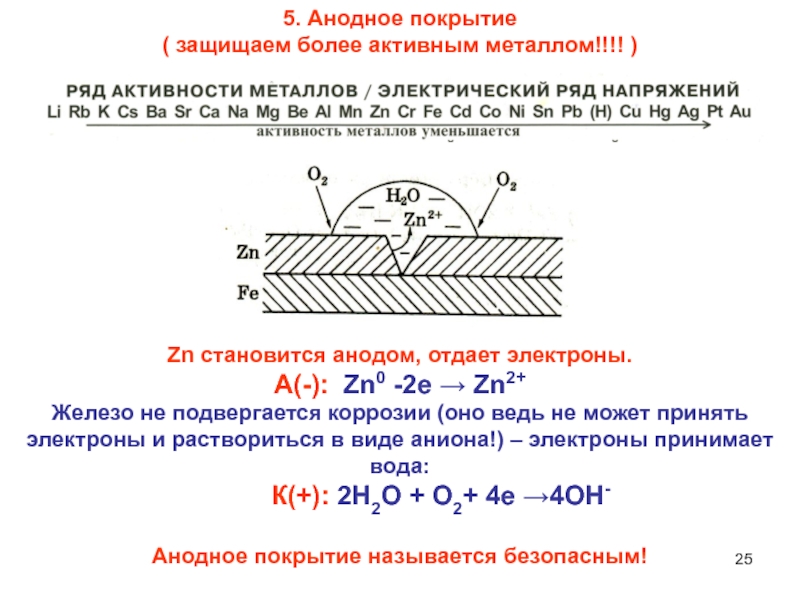
Слайд 255. Анодное покрытие
( защищаем более активным металлом!!!! )
Zn становится
анодом, отдает электроны.
А(-): Zn0 -2е → Zn2+
Железо не подвергается
коррозии (оно ведь не может принять электроны и раствориться в виде аниона!) – электроны принимает вода:
К(+): 2Н2О + О2+ 4е →4ОН-
Анодное покрытие называется безопасным!
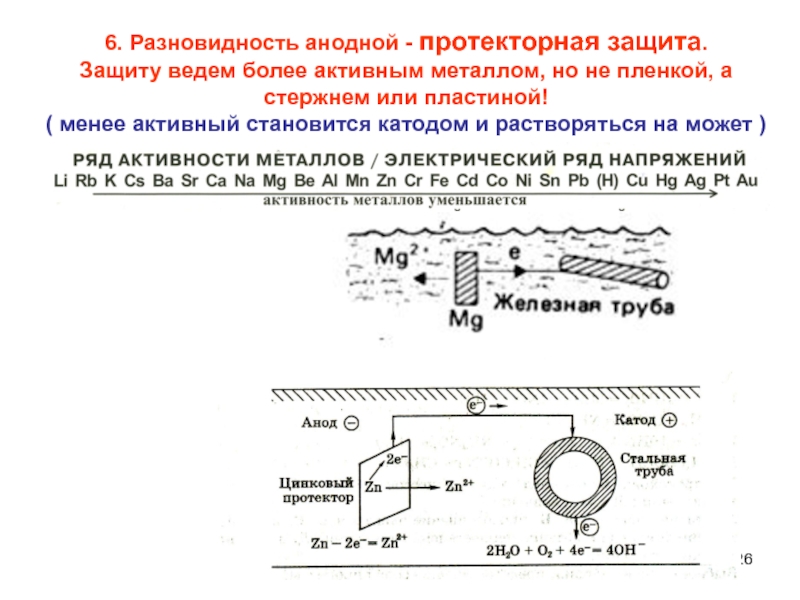
Слайд 266. Разновидность анодной - протекторная защита.
Защиту ведем более активным металлом,
но не пленкой, а стержнем или пластиной!
( менее активный
становится катодом и растворяться на может )
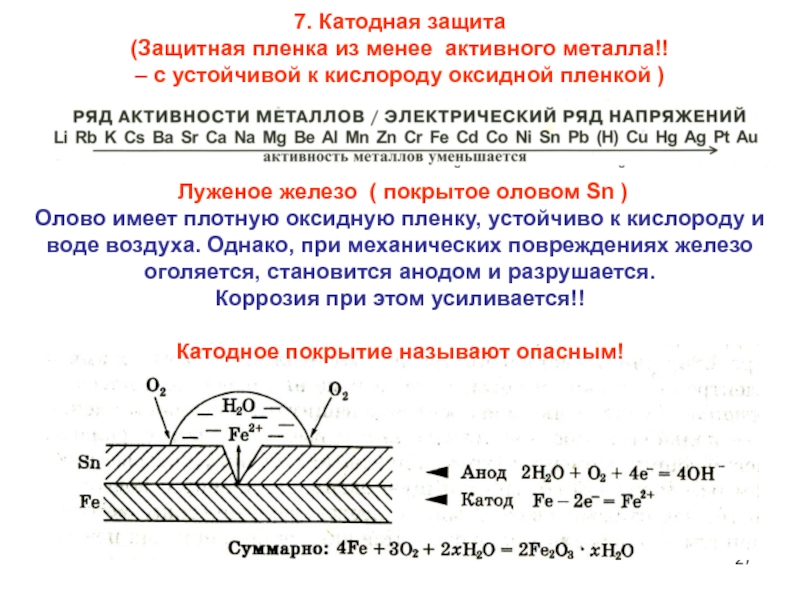
Слайд 277. Катодная защита
(Защитная пленка из менее активного металла!!
– с
устойчивой к кислороду оксидной пленкой )
Луженое железо ( покрытое
оловом Sn )
Олово имеет плотную оксидную пленку, устойчиво к кислороду и воде воздуха. Однако, при механических повреждениях железо оголяется, становится анодом и разрушается.
Коррозия при этом усиливается!!
Катодное покрытие называют опасным!
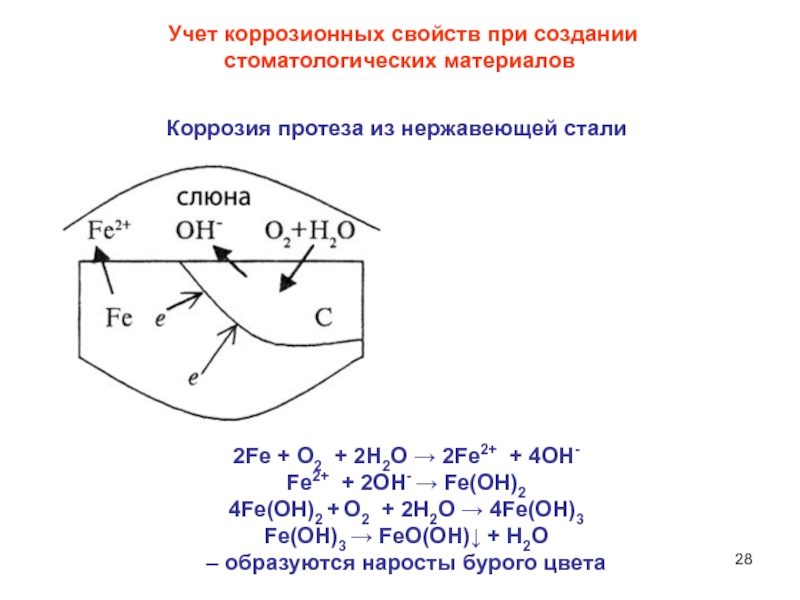
Слайд 28 Учет коррозионных свойств при создании
стоматологических материалов
Коррозия протеза из
нержавеющей стали
2Fe + О2 + 2Н2О → 2Fe2+ + 4ОH-
Fe2+ + 2ОH- → Fe(ОН)2
4Fe(ОН)2 + О2 + 2Н2О → 4Fe(ОН)3
Fe(ОН)3 → FeО(ОН)↓ + Н2O
– образуются наросты бурого цвета
Слайд 29Параллельно протекает реакция
Fe + 2Н2O - 2е→ Fe(ОН)2 + 2Н+
- у больных с протезами из нержавеющей стали появляется кислый
привкус и чувство жжения в полости рта
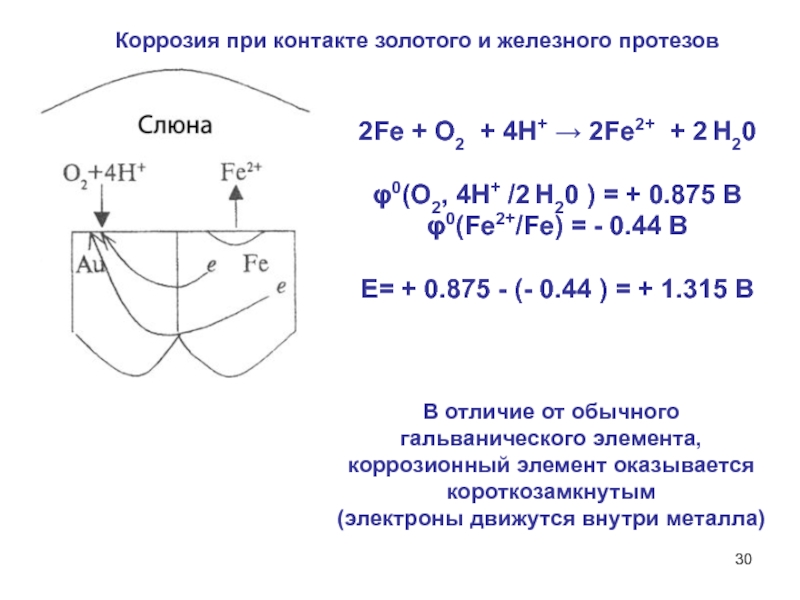
Слайд 30Коррозия при контакте золотого и железного протезов
2Fe + О2 +
4Н+ → 2Fe2+ + 2 Н20
φ0(О2, 4Н+ /2 Н20
) = + 0.875 В
φ0(Fе2+/Fe) = - 0.44 В
Е= + 0.875 - (- 0.44 ) = + 1.315 В
В отличие от обычного гальванического элемента, коррозионный элемент оказывается короткозамкнутым
(электроны движутся внутри металла)
Слайд 31 В 1888-1889 гг. Нернст изучал поведение электролитов
при пропускании электрического тока и открыл фундаментальный закон, известный как
уравнение Нернста.
Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и концентрацией ионов и позволяет предсказать максимальный потенциал, который может быть получен в результате электрохимического взаимодействия.
Нобелевская премия по химии (1920)
«в признание его работ по термодинамике».
Уравнение Нернста.
Слайд 32Возникновение электродных потенциалов.
Электроды I рода.
Электроды I рода –
металл, погруженный в раствор собственной соли.
а) Цинковый электрод (I рода)
Zn0
- 2ē = Zn2+ (раств.)
Zn2+ + 2ē = Zn0 (осажд.)
Zn0 - 2ē ↔ Zn2+
Поскольку а Zn =1,
- граница раздела ж-ж
- граница раздела тв-ж
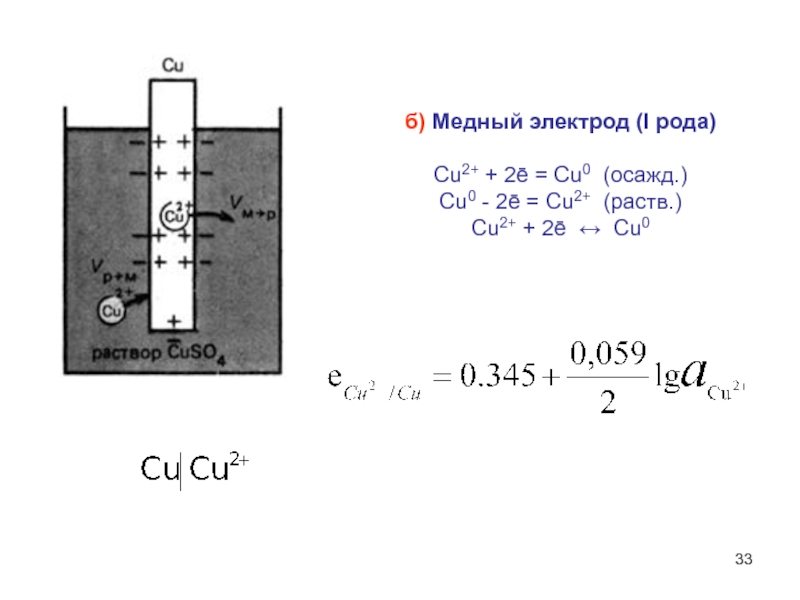
Слайд 33б) Медный электрод (I рода)
Cu2+ + 2ē = Cu0 (осажд.)
Cu0
- 2ē = Cu2+ (раств.)
Cu2+ + 2ē ↔ Cu0
Слайд 34в) Водородный электрод ( 1рода, но… используется
и как электрод сравнения,
и как электрод определения )
2H+ + 2ē = H2
(окис.)
H2 - 2ē = 2H+ (восст.)
2H+ + 2ē ↔ H2
Потенциал стандартного водородного электрода для всех температур условно принят за ноль
Стандартный водородный электрод - электрод, в котором давление водорода - 101 кПа, а активность ионов водорода -1г-ион/л.
(ан+ = 1, рН = 0)
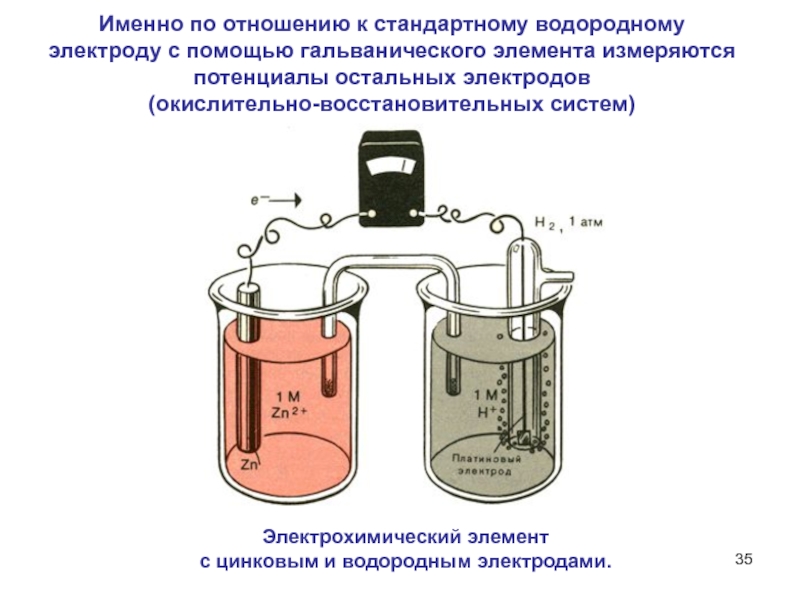
Слайд 35Электрохимический элемент
с цинковым и водородным электродами.
Именно по отношению к
стандартному водородному электроду с помощью гальванического элемента измеряются потенциалы остальных
электродов
(окислительно-восстановительных систем)
Слайд 36Стандартные электродные потенциалы
в водной среде при 198 К.
Слайд 37 Пользуясь значениями ео, можно прогнозировать возможность протекания
и направление окислительно-восстановительной реакции.
F2 + 2e → 2F- е0 = 2.87 В
I2 +2e → 2I- е0 = 0.54 В
F2 + 2I- = I2 + 2F-
F2 + 2KI = I2 + 2KF
Из пары с большим е0 берем окислитель.
Из пары с меньшим е0– берем восстановитель.
Оставшиеся вещества есть продукты реакции.
Направление окислительно – восстановительных реакций
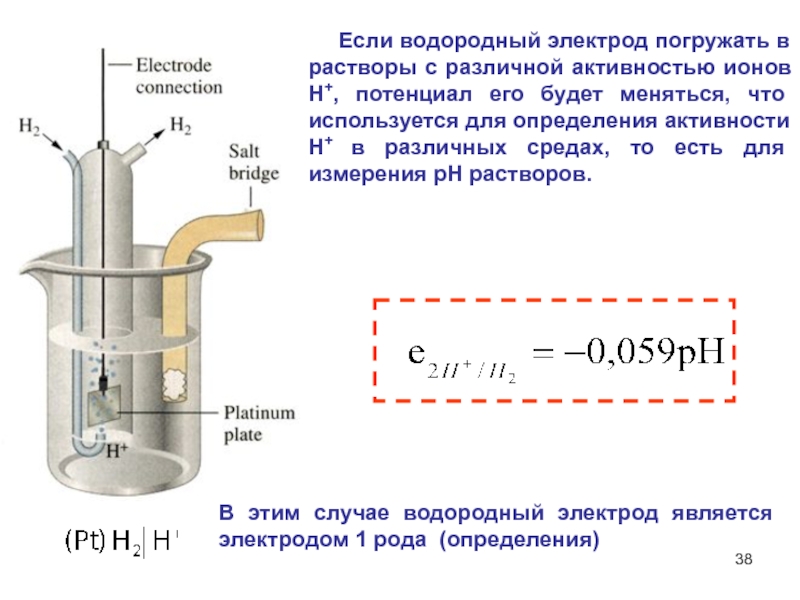
Слайд 38 Если водородный электрод погружать в растворы с различной
активностью ионов Н+, потенциал его будет меняться, что используется для
определения активности Н+ в различных средах, то есть для измерения рН растворов.
В этим случае водородный электрод является электродом 1 рода (определения)
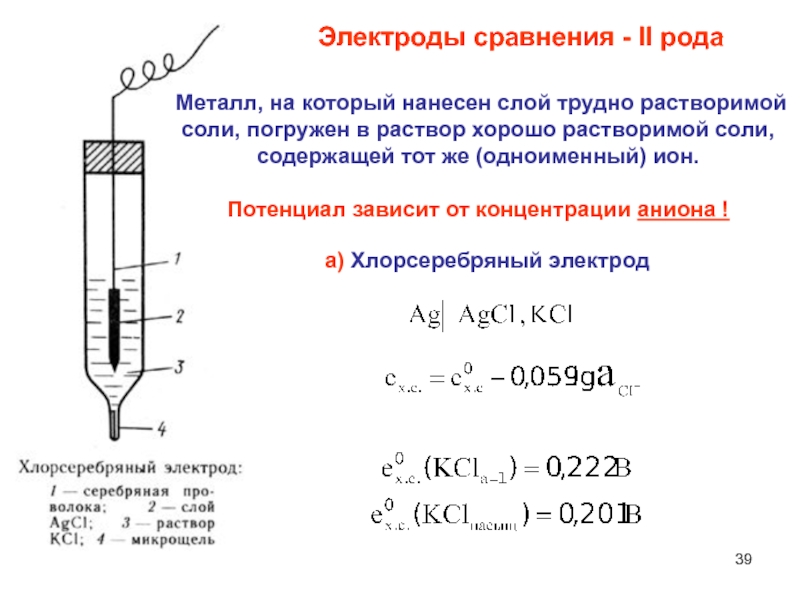
Слайд 39Электроды сравнения - II рода
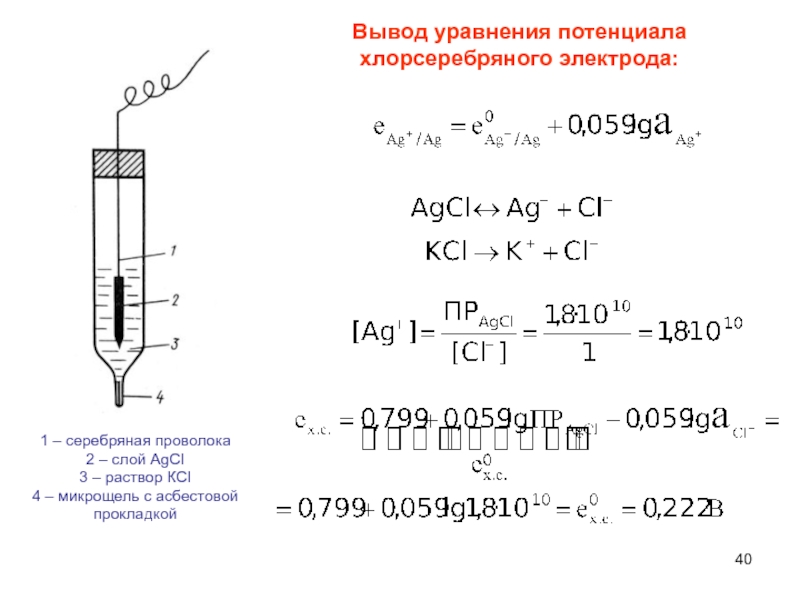
а) Хлорсеребряный электрод
Металл, на который
нанесен слой трудно растворимой
соли, погружен в раствор хорошо растворимой
соли,
содержащей тот же (одноименный) ион.
Потенциал зависит от концентрации аниона !
Слайд 40Вывод уравнения потенциала
хлорсеребряного электрода:
1 – серебряная проволока
2 – слой
АgCI
3 – раствор КCI
4 – микрощель с асбестовой прокладкой
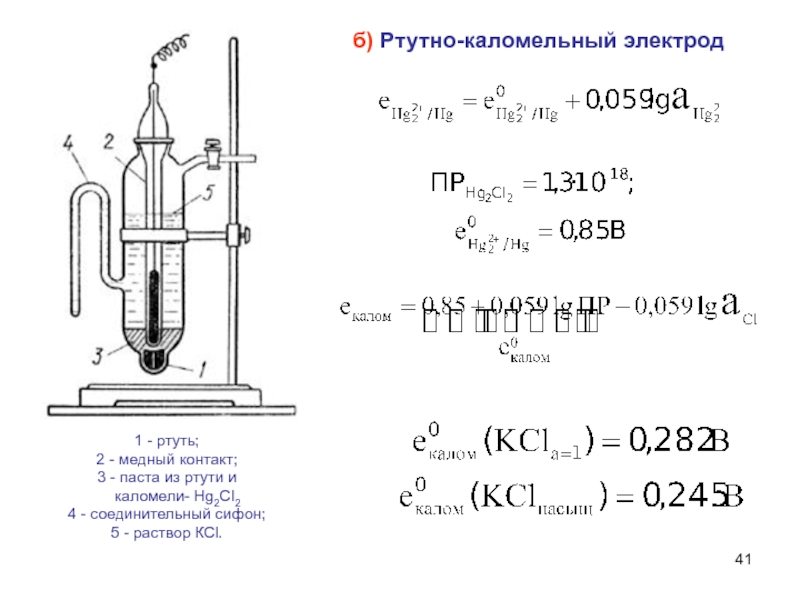
Слайд 41б) Ртутно-каломельный электрод
1 - ртуть;
2 - медный контакт;
3
- паста из ртути и
каломели- Hg2CI2
4
- соединительный сифон;
5 - раствор КСl.
Слайд 42Альтернативная конструкция ртутно-каломельного электрода
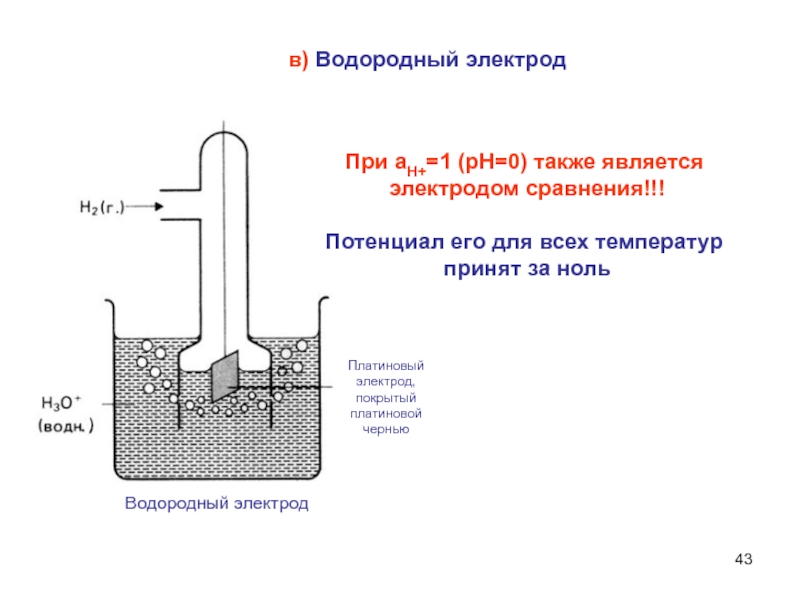
Слайд 43в) Водородный электрод
При аН+=1 (рН=0) также является
электродом сравнения!!!
Потенциал его
для всех температур
принят за ноль
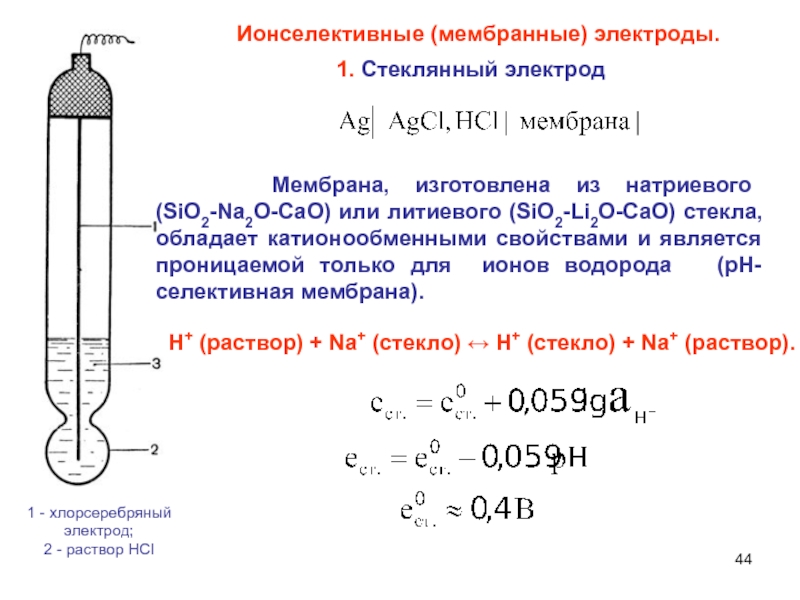
Слайд 44 Ионселективные (мембранные) электроды.
1 - хлорсеребряный электрод;
2 - раствор HCI
1.
Стеклянный электрод
Н+ (раствор) + Na+ (стекло) ↔ Н+ (стекло) +
Na+ (раствop).
Мембрана, изготовлена из натриевого (SiO2-Na2O-CaO) или литиевого (SiO2-Li2O-CaO) стекла, обладает катионообменными свойствами и является проницаемой только для ионов водорода (рН-селективная мембрана).
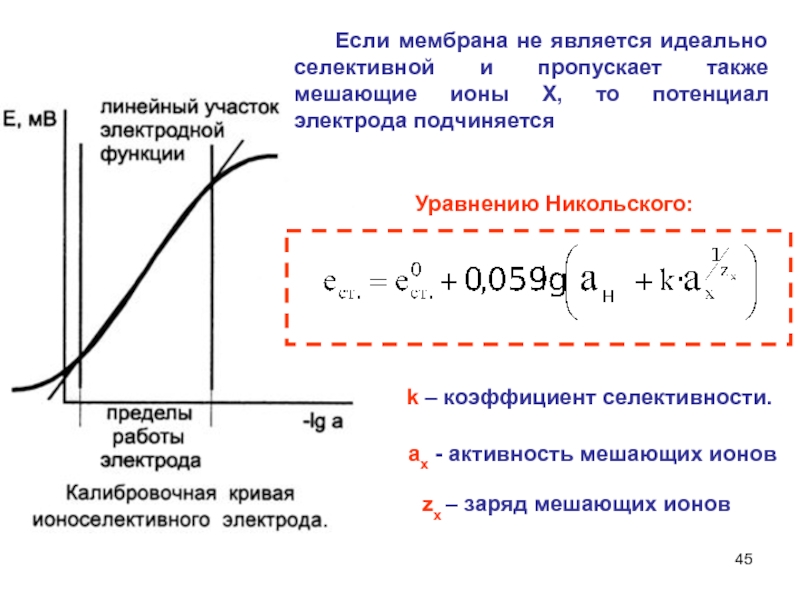
Слайд 45 Если мембрана не является идеально селективной и
пропускает также мешающие ионы Х, то потенциал электрода подчиняется
k –
коэффициент селективности.
аx - активность мешающих ионов
zx – заряд мешающих ионов
Уравнению Никольского:
Слайд 46
Советский физико-химик и радиохимик, академик.
Окончил Ленинградский
университет в 1925 году.
НИКОЛЬСКИЙ
Борис Петрович
(14.10.1900 – 4.01.1990)
Слайд 47
С 1925 года работал в ЛГУ, одновременно
с 1946 – в Радиевом институте.
Предложил (1932–1937) ионообменную теорию
стеклянного электрода.
Разработал (1932) потенциометрический метод титрования.
Провел (1965–1967) физико-химические исследования окислительно-восстановительной системы ферроцен – катион феррициния (компонент твердого ракетного топлива)
Выполнил цикл работ в области прикладной и теоретической радиохимии.
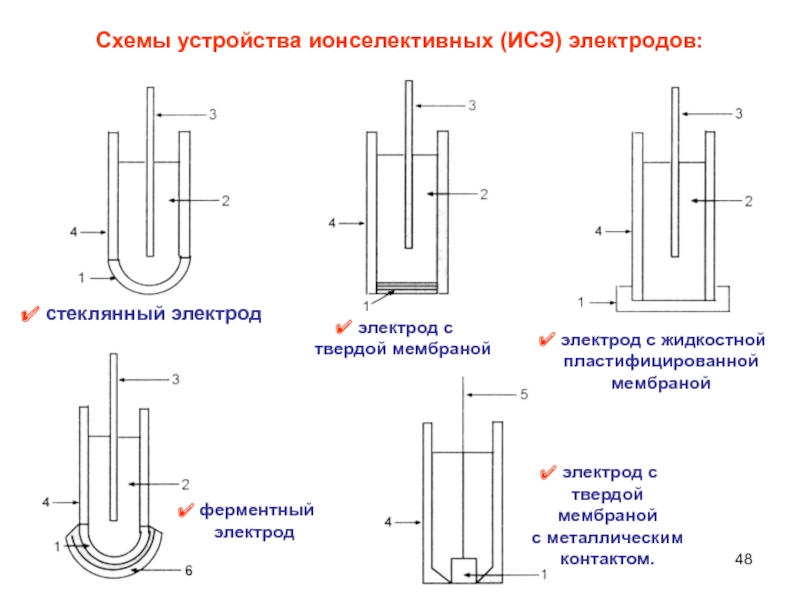
Слайд 48Схемы устройства ионселективных (ИСЭ) электродов:
электрод с
твердой мембраной
с
металлическим
контактом.
стеклянный электрод
электрод с
твердой мембраной
электрод с
жидкостной пластифицированной мембраной
ферментный
электрод
Слайд 49Обладают селективностью к катионам Cu2+, Mg2+, Mn2+, NH4+, анионам NO3–,
СО32–, SO42-.
Наиболее важными для решения экологических
проблем являются электроды, селективные к поверхностно-активным веществам (определение загрязнений моющими средствами) и к ацетилхолину (определение загрязнений фосфорорганическими ядохимикатами).
Механическая непрочность пористых мембран, неизбежное попадание органической фазы в анализируемый раствор затрудняют применение ИСЭ с жидкими мембранами в биомедицинских исследованиях.
электрод с жидкостной пластифицированной мембраной
2. Жидкостные ионселективные (ИСЭ) электроды
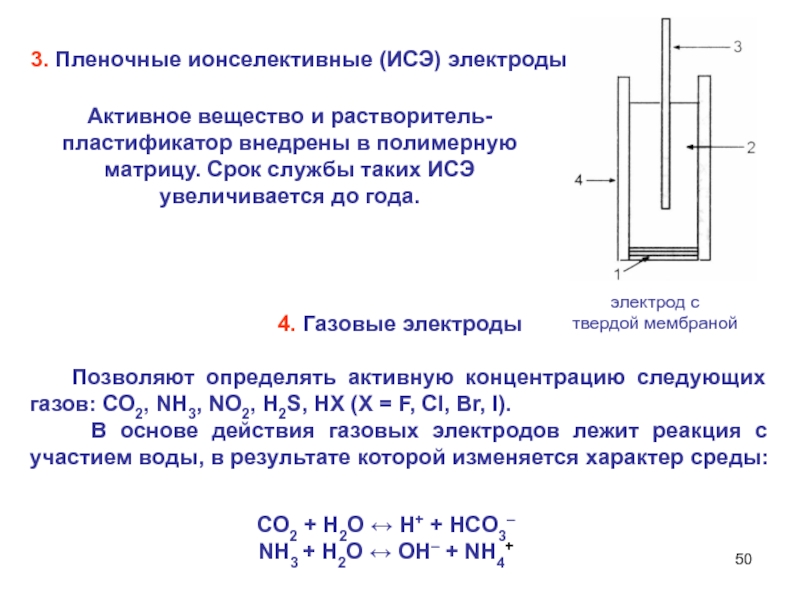
Слайд 503. Пленочные ионселективные (ИСЭ) электроды
4. Газовые электроды
Позволяют определять активную концентрацию следующих газов: СО2, NH3, NO2, H2S,
HX (X = F, Cl, Br, I).
В основе действия газовых электродов лежит реакция с участием воды, в результате которой изменяется характер среды:
СО2 + Н2О ↔ Н+ + HCO3–
NH3 + H2O ↔ OH– + NH4+
Активное вещество и растворитель-пластификатор внедрены в полимерную матрицу. Срок службы таких ИСЭ увеличивается до года.
электрод с
твердой мембраной
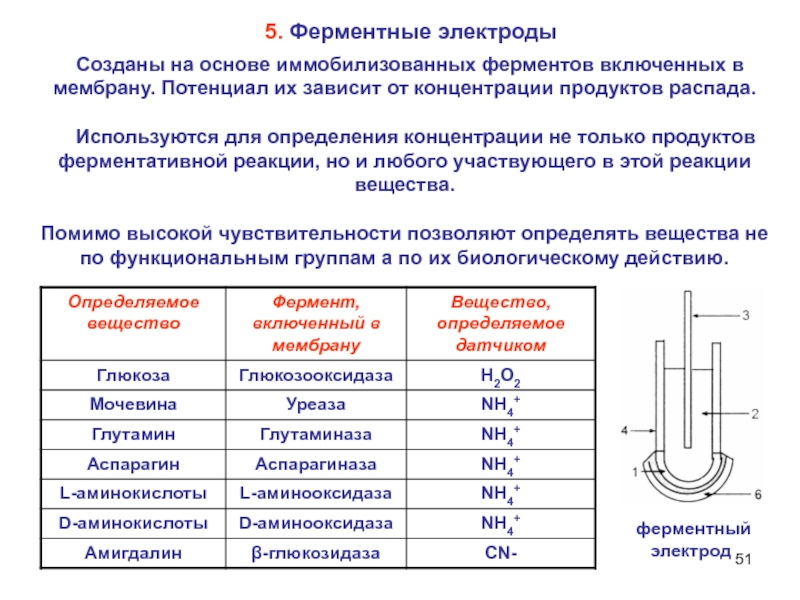
Слайд 51 Созданы на основе иммобилизованных ферментов включенных в мембрану. Потенциал
их зависит от концентрации продуктов распада.
Используются для определения
концентрации не только продуктов ферментативной реакции, но и любого участвующего в этой реакции вещества.
Помимо высокой чувствительности позволяют определять вещества не по функциональным группам а по их биологическому действию.
5. Ферментные электроды
ферментный
электрод
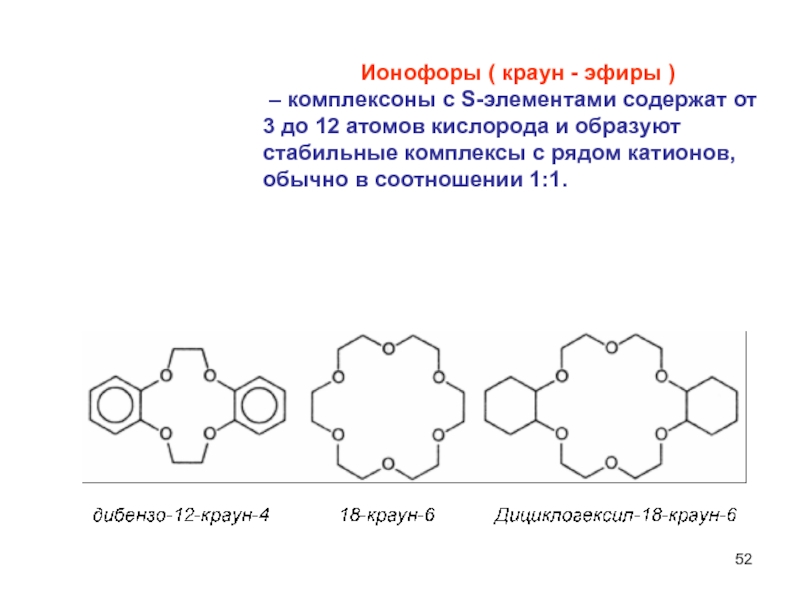
Слайд 52 Ионофоры ( краун - эфиры )
– комплексоны
с S-элементами содержат от 3 до 12 атомов кислорода и
образуют стабильные комплексы с рядом катионов, обычно в соотношении 1:1.
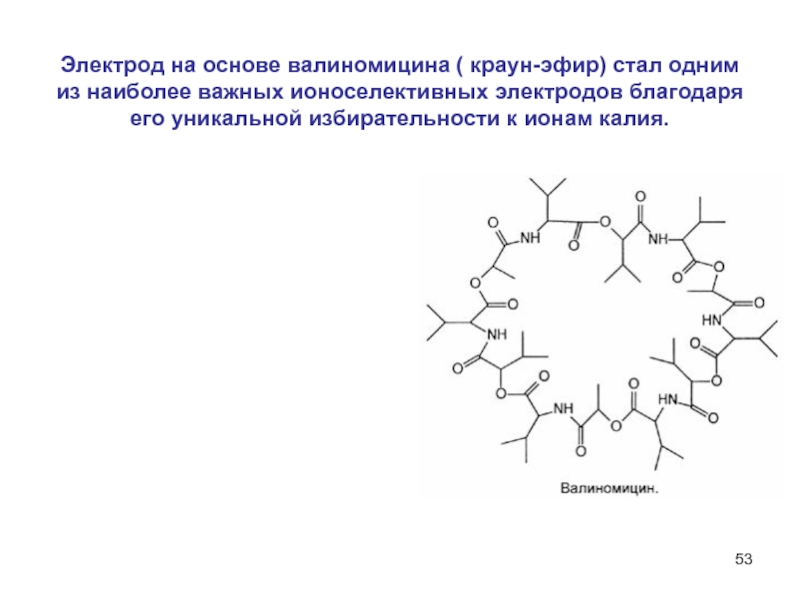
Слайд 53Электрод на основе валиномицина ( краун-эфир) стал одним из наиболее
важных ионоселективных электродов благодаря его уникальной избирательности к ионам калия.
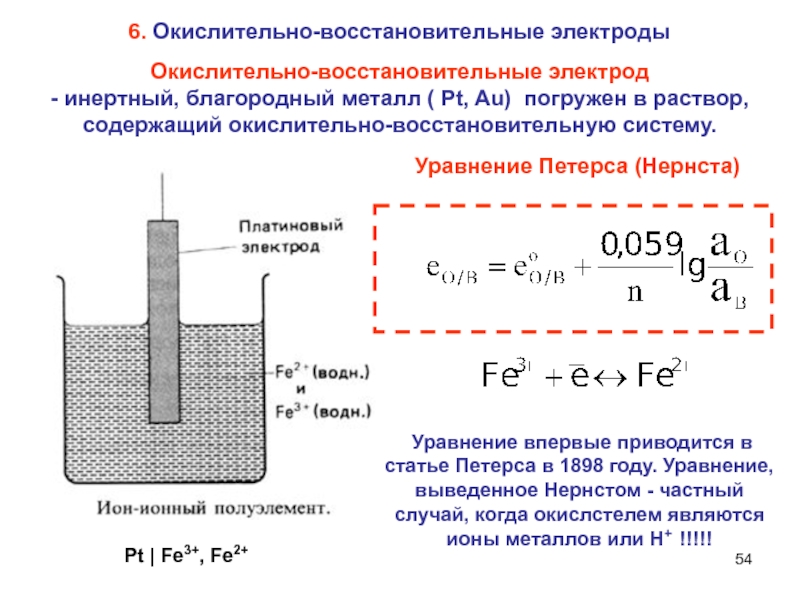
Слайд 54Окислительно-восстановительные электрод
- инертный, благородный металл ( Pt, Au) погружен в
раствор, содержащий окислительно-восстановительную систему.
Уравнение Петерса (Нернста)
Pt | Fe3+, Fe2+
6. Окислительно-восстановительные
электроды
Уравнение впервые приводится в статье Петерса в 1898 году. Уравнение, выведенное Нернстом - частный случай, когда окислстелем являются ионы металлов или Н+ !!!!!
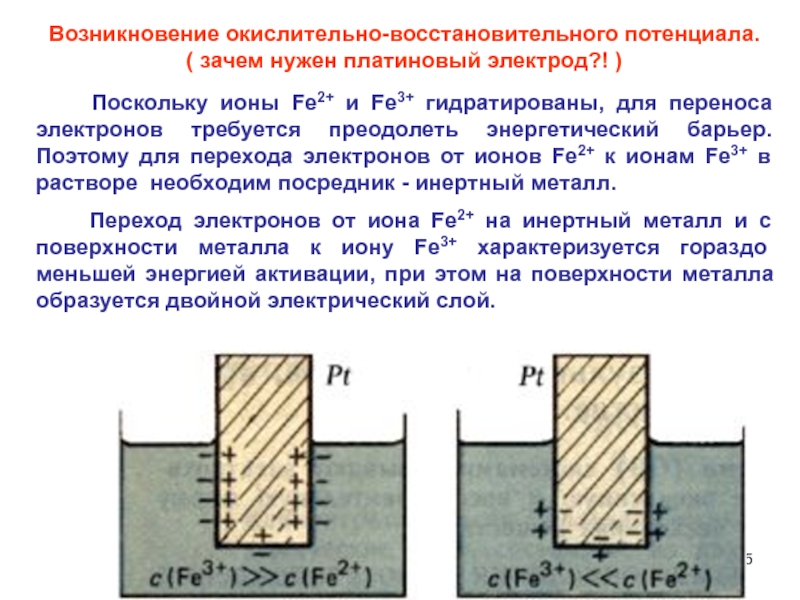
Слайд 55Возникновение окислительно-восстановительного потенциала.
( зачем нужен платиновый электрод?! )
Поскольку ионы Fe2+ и Fe3+ гидратированы, для переноса электронов требуется
преодолеть энергетический барьер. Поэтому для перехода электронов от ионов Fe2+ к ионам Fe3+ в растворе необходим посредник - инертный металл.
Переход электронов от иона Fe2+ на инертный металл и с поверхности металла к иону Fe3+ характеризуется гораздо меньшей энергией активации, при этом на поверхности металла образуется двойной электрический слой.
Слайд 56Если в окислительно-восстановительное уравнение входят ионы водорода, то потенциал данной
системы зависит также от рН раствора:
В сильнокислых средах окислительная
способность таких систем резко возрастает !
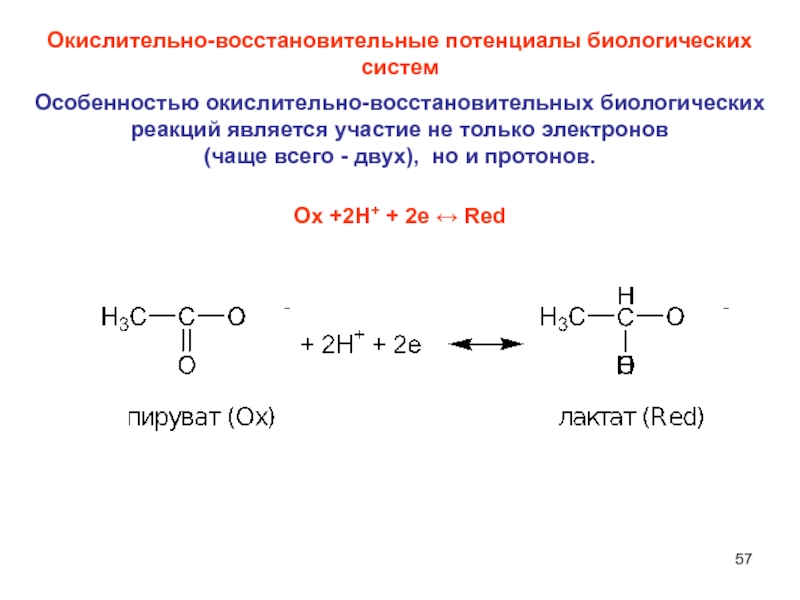
Слайд 57Окислительно-восстановительные потенциалы биологических систем
Особенностью окислительно-восстановительных биологических реакций является участие не
только электронов
(чаще всего - двух), но и протонов.
Oх +2H+
+ 2e ↔ Red
Слайд 58Так как большинство физиологических жидкостей
имеют значение рН, близкое к
7, для биологических систем вводится нормальный восстановительный потенциал при рН=7
Уравнение
Нернста ( Петерса ) принимает вид:
где
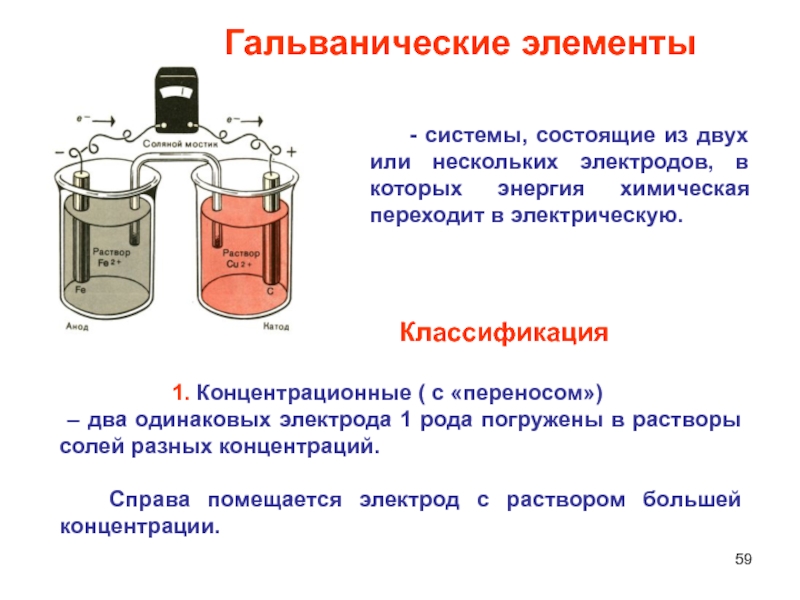
Слайд 59 - системы, состоящие из двух или нескольких
электродов, в которых энергия химическая переходит в электрическую.
1. Концентрационные (
c «переносом»)
– два одинаковых электрода 1 рода погружены в растворы солей разных концентраций.
Справа помещается электрод с раствором большей концентрации.
Гальванические элементы
Классификация
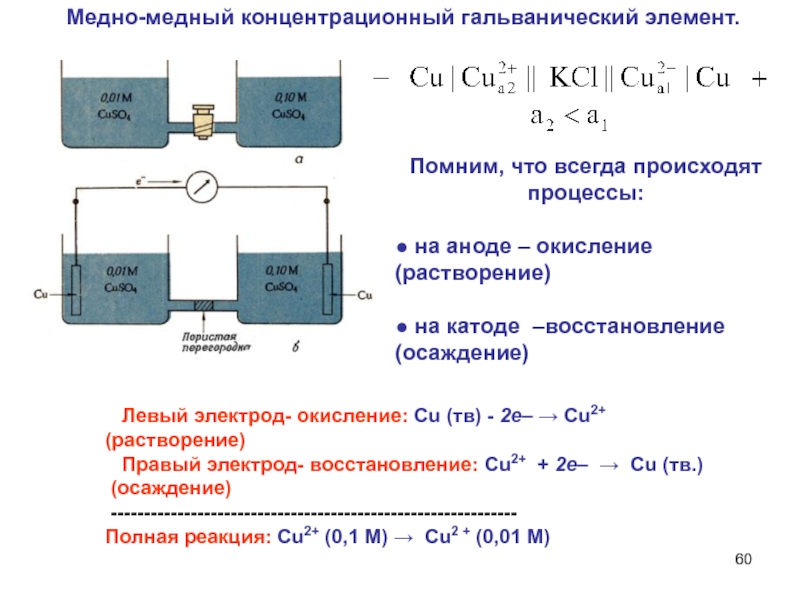
Слайд 60 Медно-медный концентрационный гальванический элемент.
Левый электрод- окисление: Сu
(тв) - 2е– → Сu2+ (растворение)
Правый электрод-
восстановление: Сu2+ + 2е– → Сu (тв.)
(осаждение)
-------------------------------------------------------------
Полная реакция: Сu2+ (0,1 М) → Сu2 + (0,01 М)
Помним, что всегда происходят процессы:
● на аноде – окисление (растворение)
● на катоде –восстановление (осаждение)
Слайд 61Расчет ЭДС для концентрационных гальванических элементов
Е= е1 - е2
Ток в цепи прекращается,
когда концентрации (активности) становятся одинаковыми
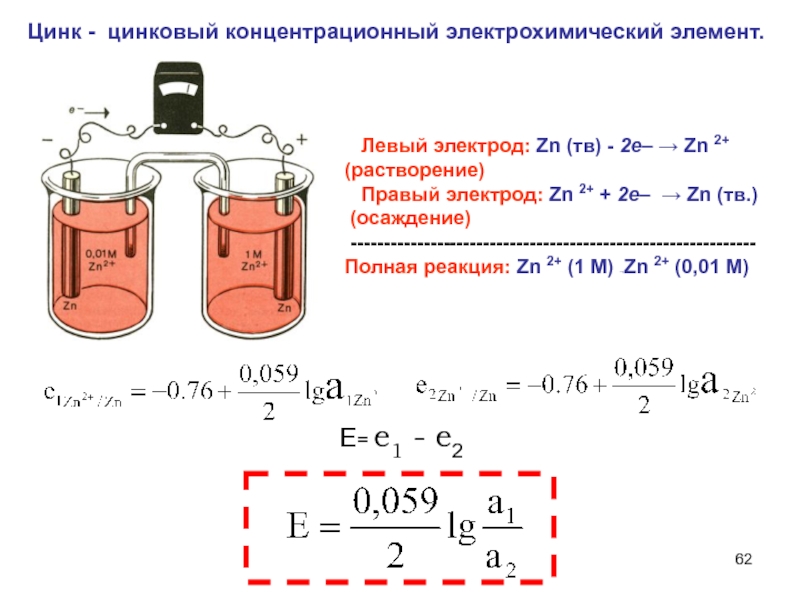
Слайд 62 Цинк - цинковый концентрационный электрохимический элемент.
Е= е1 - е2
Левый электрод: Zn (тв) - 2е– → Zn 2+ (растворение)
Правый электрод: Zn 2+ + 2е– → Zn (тв.)
(осаждение)
-------------------------------------------------------------
Полная реакция: Zn 2+ (1 М) →Zn 2+ (0,01 М)
Слайд 63Медно–цинковый гальванический элемент
- граница раздела тв-ж
- граница раздела
ж-ж
2. Биметаллические гальванические элементы
- два разных металлических электрода погружены
в растворы собственных солей
Слайд 64Расчет ЭДС в биметаллических гальванических элементах
При разных активностях:
Слайд 65
3. Гальванические элементы без переноса
Правила составления:
Справа помещаем электрод с большим е0;
Для электрода определения пишем
уравнение Нернста, для электрода сравнения – цифру;
ЭДС – разность потенциалов правого и левого электродов
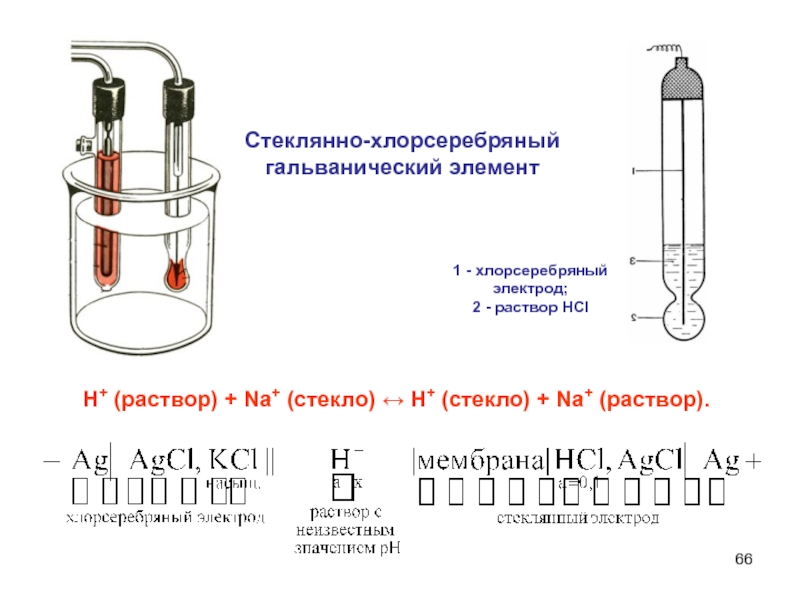
Слайд 66Стеклянно-хлорсеребряный
гальванический элемент
Н+ (раствор) + Na+ (стекло) ↔ Н+ (стекло) +
Na+ (раствop).
1 - хлорсеребряный электрод;
2 - раствор HCI
Слайд 67Расчет ЭДС
для стеклянно-хлорсеребряного гальванического элемента
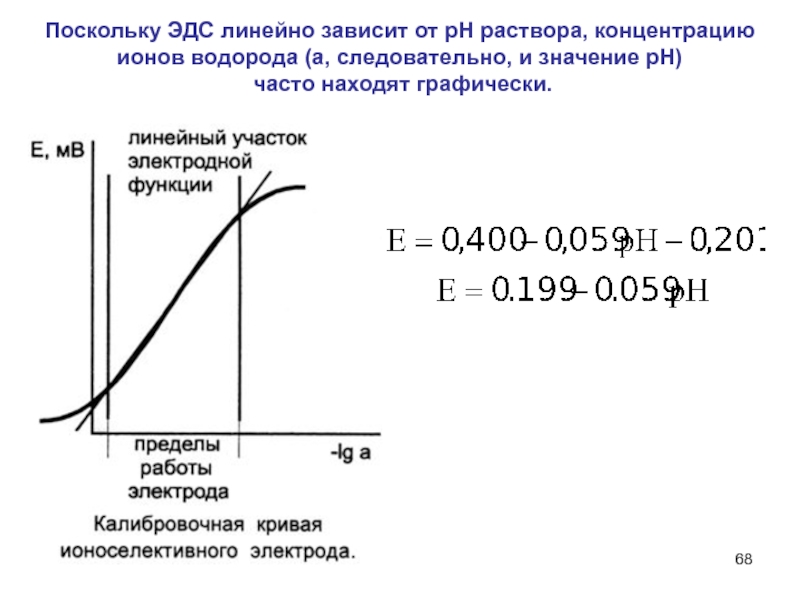
Слайд 68Поскольку ЭДС линейно зависит от рН раствора, концентрацию ионов водорода
(а, следовательно, и значение рН)
часто находят графически.
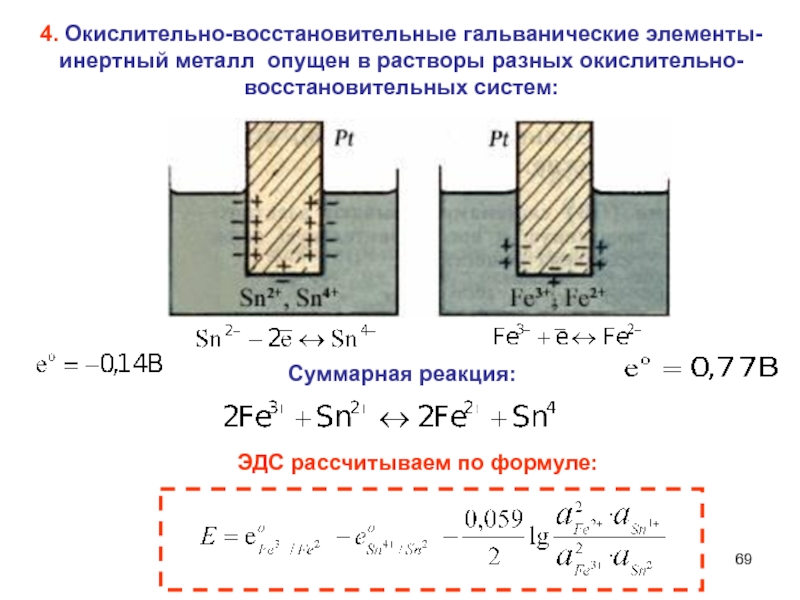
Слайд 694. Окислительно-восстановительные гальванические элементы-
инертный металл опущен в
растворы разных окислительно-восстановительных систем:
Суммарная реакция:
ЭДС рассчитываем по формуле:
Слайд 70Использование ЭДС в потенциометрическом титровании
Потенциометрическое титрование имеет
ряд преимуществ перед титрованием с индикатором:
возможность титрования мутных и
окрашенных биологических жидкостей,
легкость автоматизации анализа,
высокая точность определения
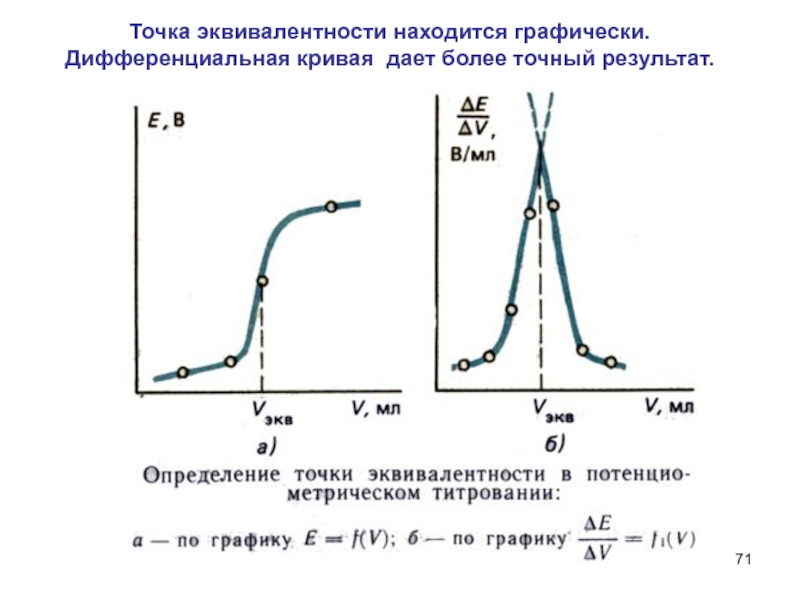
Слайд 71Точка эквивалентности находится графически.
Дифференциальная кривая дает более точный результат.
Слайд 72рН – метрическое
- используются стеклянный и хлорсеребряный электроды
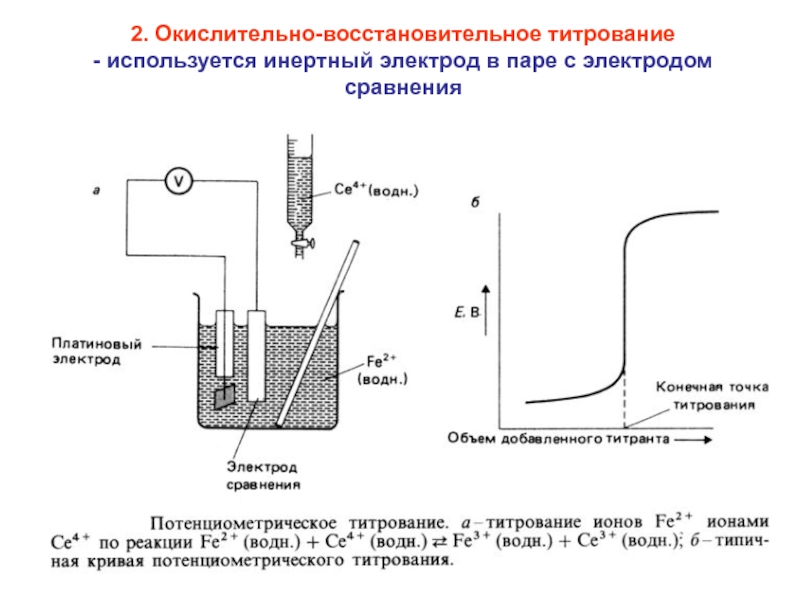
Слайд 732. Окислительно-восстановительное титрование
- используется инертный электрод в паре с электродом
сравнения
Слайд 751. Прогноз совместимости лекарственных препаратов (иодид калия и нитрит натрия,
перманганат калия и тиосульфат натрия – несовместимые пары);
2. Нахождение компромиссного
потенциала мышечных тканей
при диагностике ишемической
болезни (норма - 170-220 мВ,
снижение до 160 мВ - при болезни);
3. Использование сильных окислителей
в качестве антисептических,
противомикробных и дезинфицирующих
средств ( йод, перманганат калия, перекись
водорода, соли меди, серебра ).
Значение окислительно-восстановительных процессов
в организме
Слайд 76 Тиосульфат натрия Na2S2O3 – универсальный антидот!!!
а) При
отравлении тяжелыми металлами образуются трудно растворимые и поэтому практически неядовитые
сульфиты:
Рb(СН3СОО)2 + Na2S2O3 + Н2О → PbS + Na2SO4 + 2СН3СООН
б) При отравлении синильной кислотой или цианидами тиосульфат превращает эти токсичные вещества в менее ядовитые роданистые соединения,:
HCN+ Na2S2O3 → NaCNS + NaHSO3;
KCN+ Na2S2O3 → KCNS+ Na2SO3.
4. Разрушение токсических веществ,
образующихся в ходе метаболизма
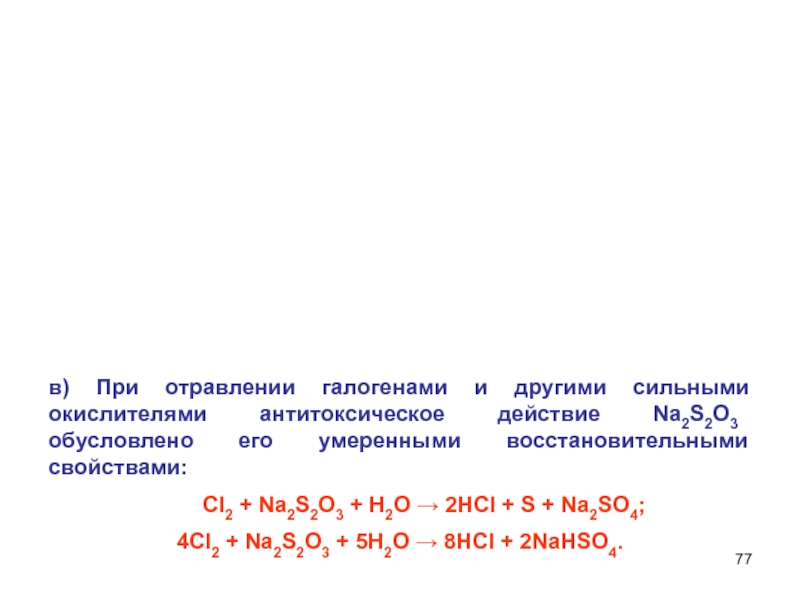
Слайд 77в) При отравлении галогенами и другими сильными окислителями антитоксическое действие
Na2S2O3 обусловлено его умеренными восстановительными свойствами:
Сl2 + Na2S2O3 + Н2О → 2НСl + S + Na2SO4;
4Cl2 + Na2S2O3 + 5Н2О → 8HCl + 2NaHSO4.
Слайд 78 5. Расчет потенциалов в схеме дыхательной цепи
В
основе процесса дыхания лежит экзэргоническая окислительно-восстановительная реакция
О2(г) + 4Н+ + 4е– → 2Н2О(ж).
При рН 7,0
° = 0,815 В,
ΔG298 = – 457,52 кДж
на 1 моль О2.
В биологических системах данная реакция никогда не осуществляется непосредственно, а реализуется через целый ряд промежуточных превращений, каждое из них требует участия определенного фермента.
Слайд 79ФАД – флавинадениндинуклеотид
НАД – никотинамидадениннуклеотид
КоQ – кофермент Q
Слайд 80Значение ионометрии
1. Контроль водно-электролитного баланса и кислотно-щелочного
состояния организма и его отдельных органов
Слайд 812. Определение состава лекарственных препаратов, ферментов, физиологических растворов, продуктов питания,
почв, природных вод, атмосферы.
Слайд 82 3. Определение кислотности желудочного сока
путем введения в желудок больного капсулы с двумя миниатюрными электродами-стеклянного
и хлорсеребряного
Слайд 834. Непрерывный контроль кислотности во время хирургических операций.
Слайд 845. Диагностика ряда кожных заболеваний
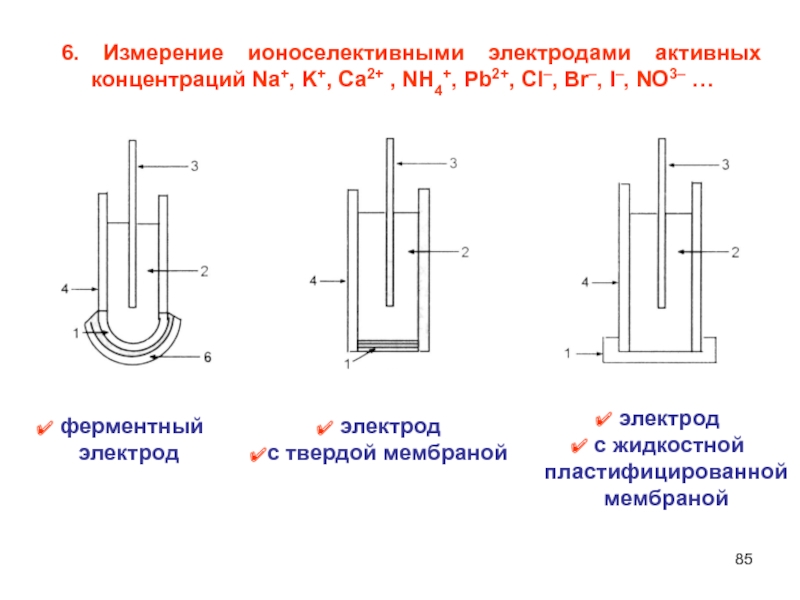
Слайд 856. Измерение ионоселективными электродами активных концентраций Na+, K+, Ca2+ ,
NH4+, Pb2+, Сl–, Br–, I–, NO3– …
ферментный
электрод
электрод
с
жидкостной пластифицированной мембраной
электрод
с твердой мембраной
Слайд 867. Расчет Кр реакций и ∆G по значениям ЭДС
Слайд 87Оптимальные диапазоны рН
для выращивания :
Картофель
- 4.8–5.7
Рожь
- 5.0-6.0
Репа - 5.8-6.8
Ячмень - 7.0-7.5
Сахарная свекла - 7.0-7.5
Пшеница - 6.5-7.5
8. Контроль за рН почв