Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Химическая кинетика и катализ. Кафедра общей и медицинской химии
Содержание
- 1. 1 Химическая кинетика и катализ. Кафедра общей и медицинской химии
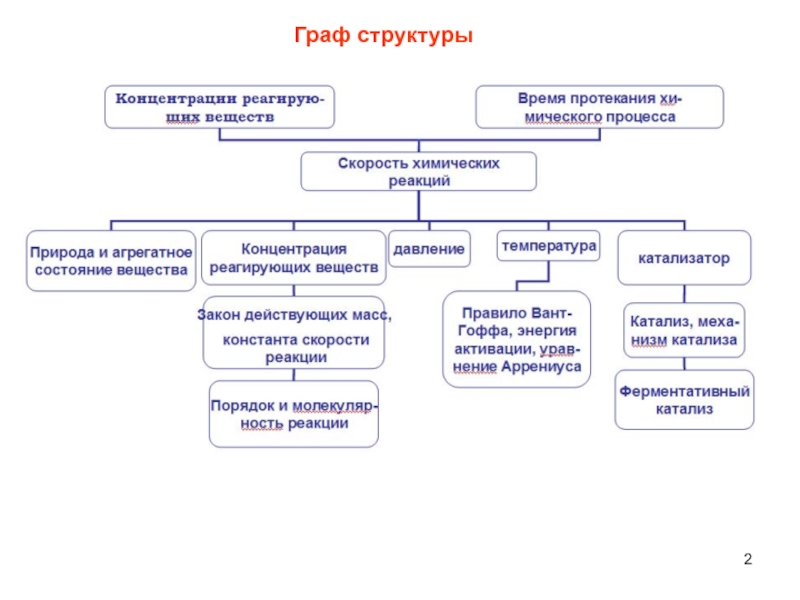
- 2. Граф структуры
- 3. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ Химическая
- 4. Скорость реакции пропорциональна числу актов взаимодействия частиц
- 5. Средняя скорость не отражает
- 6. Классификация химических реакций по числу стадий.
- 7. Скорость реакции в целом определяется лимитирующей (самой
- 8. Сопряженные – идущие через общую промежуточную стадию.Классификация
- 9. Цепные – стадии превращения
- 10. ВАЖНЕЙШИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИЙприрода реагентовконцентрация реагентовтемпературадавлениекатализатор
- 11. ВЛИЯНИЕ ПРИРОДЫ РЕАГЕНТОВСкорость химической реакции зависит от
- 12. ВЛИЯНИЕ КОНЦЕНТРАЦИЙ РЕАГЕНТОВ Необходимым условием
- 13. где a, b, d, f – коэффициенты;
- 14. Константа скорости химической реакции k численно равна
- 15. В реакциях нулевого порядка скорость реакции не
- 16. Концентрации твердых и жидких
- 17. ВЛИЯНИЕ ТЕМПЕРАТУРЫПравило (закон) Вант-Гоффа При повышении температуры
- 18. Уравнение Вант-Гоффагде v2 и v1 – скорости
- 19. Энергия активации ЕA – минимальная энергия, которую
- 20. Слайд 20
- 21. Уравнение Аррениуса где ЕA – энергия активации;
- 22. Графический способ нахождения EA и A из
- 23. ВЛИЯНИЕ ДАВЛЕНИЯУравнение Клапейрона-Менделеевагде p
- 24. Катализаторы – вещества, увеличивающие скорость химических реакций,
- 25. Катализатор вновь готов к работеМеханизм гомогенного катализа
- 26. Схематическое изображение стадий гетерогенного катализа при гидрировании этена.
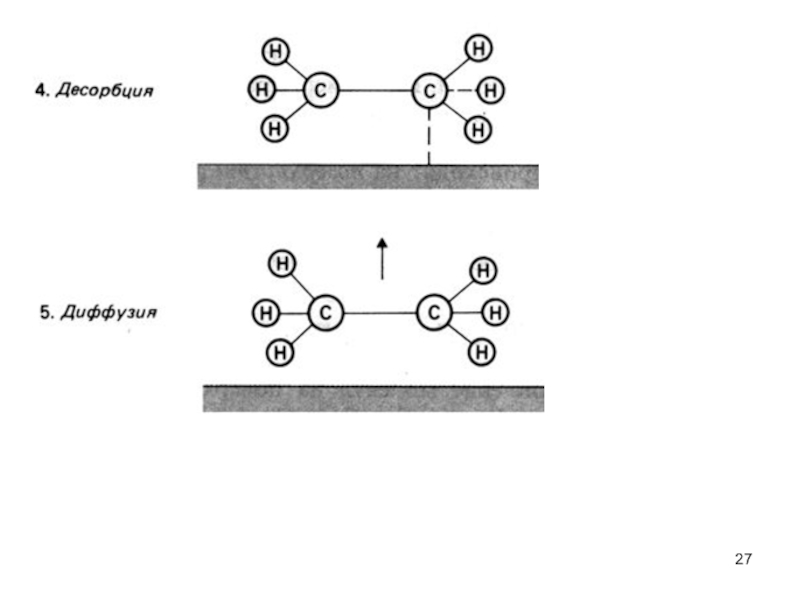
- 27. Слайд 27
- 28. Ферменты (энзимы) – белковые молекулы, которые катализируют
- 29. Карманы специфичности трипсина (а), хемотрипсина (б) и
- 30. Механизм высокой специфичности ферментов а) Немецкий химик
- 31. Влияние кислотности среды на активность ферментовУ каждого
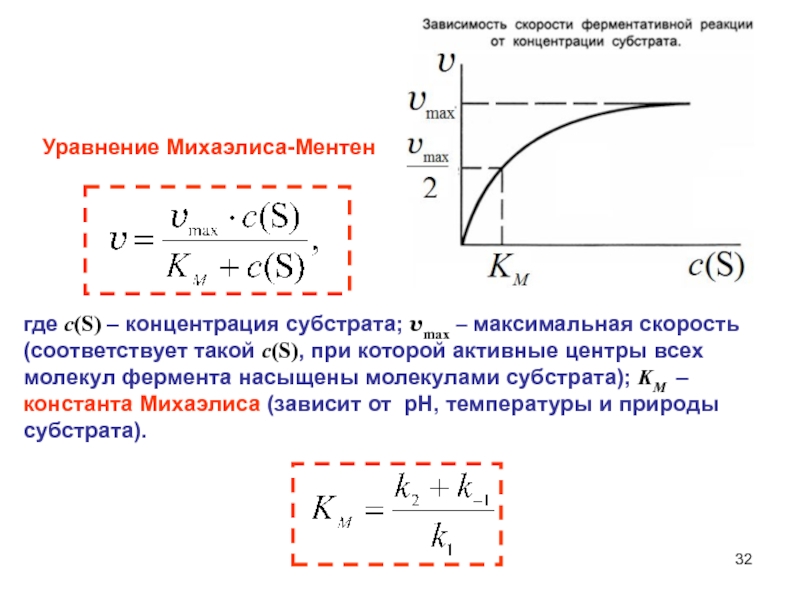
- 32. Уравнение Михаэлиса-Ментенгде c(S) – концентрация субстрата; vmax
- 33. Физический смысл константы МихаэлисаОна численно равна концентрации
- 34. Графическое определение КМ и vmaxНеустойчивость ферментов к
- 35. Значение ферментов и ферментативных реакцийПрименение ферментов в
- 36. Определение дозировки лекарственных препаратов и интервалов их
- 37. Кафедра общей и медицинской химии«Химическое равновесие»
- 38. Слайд 38
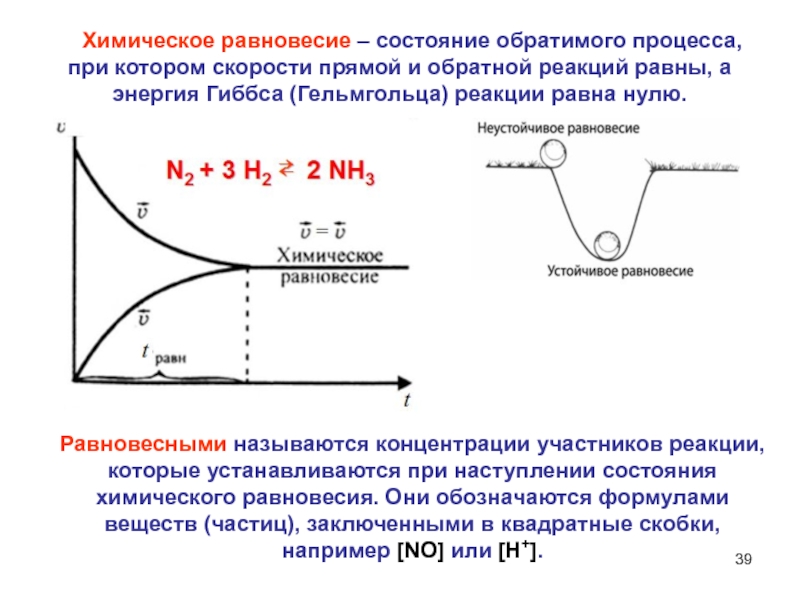
- 39. Химическое равновесие – состояние обратимого
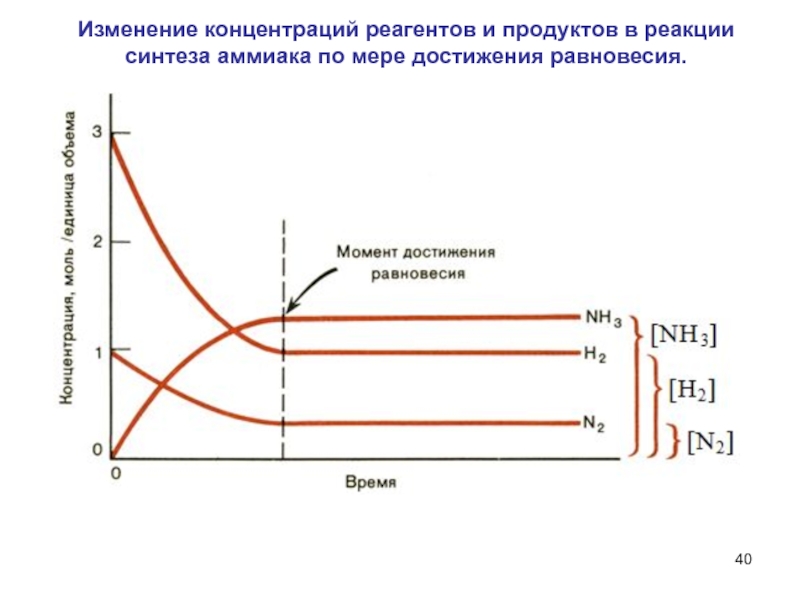
- 40. Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия.
- 41. Количественной характеристикой состояния равновесия является константа равновесия
- 42. Концентрации твердых и жидких (не растворённых!) веществ
- 43. Если считать, что прямая и обратная реакции
- 44. Состоянию равновесия соответствует определенное значение константы, т.
- 45. Принцип Ле Шателье Если на
- 46. прямая реакция – экзотермическая, обратная – эндотермическая,
- 47. Если реагент добавляют в реакционную систему (повышают
- 48. Рассмотрим добавление в эту систему жидкой воды,
- 49. Другими словами, после разбавления концентрации продуктов растут,
- 50. В обеих частях уравнения суммы коэффициентов при
- 51. Спасибо за внимание!
- 52. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
Химическая кинетика – учение
о скоростях химических реакций и зависимости их от различных факторов.
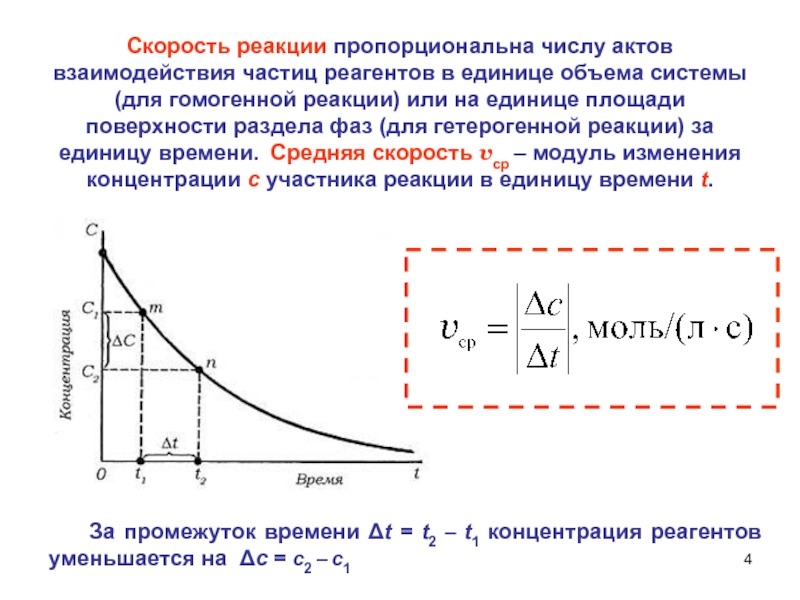
Главная задача химической кинетики – управление химическим процессом.Слайд 4Скорость реакции пропорциональна числу актов взаимодействия частиц реагентов в единице
объема системы (для гомогенной реакции) или на единице площади поверхности
раздела фаз (для гетерогенной реакции) за единицу времени. Средняя скорость vср – модуль изменения концентрации c участника реакции в единицу времени t. За промежуток времени Δt = t2 – t1 концентрация реагентов уменьшается на Δс = с2 – с1
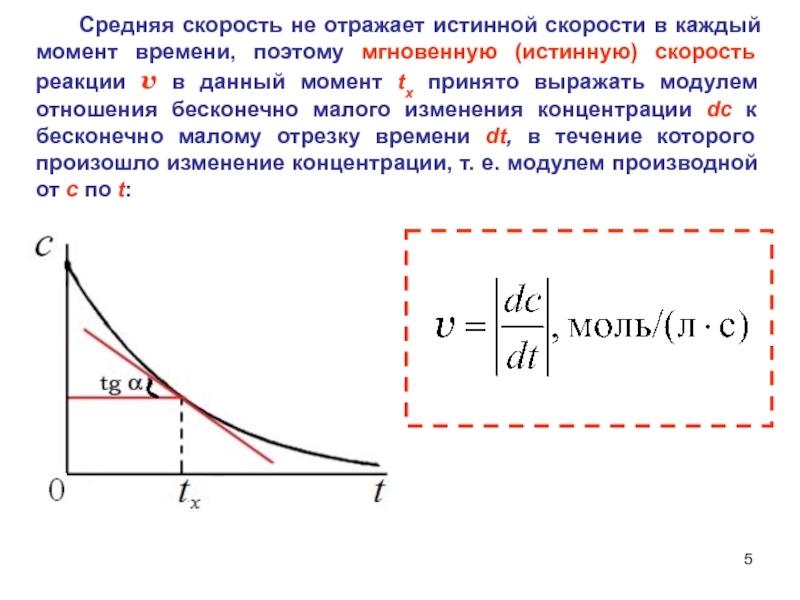
Слайд 5 Средняя скорость не отражает истинной скорости в
каждый момент времени, поэтому мгновенную (истинную) скорость реакции v в
данный момент tx принято выражать модулем отношения бесконечно малого изменения концентрации dc к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации, т. е. модулем производной от c по t:Слайд 6Классификация химических реакций по числу стадий.
Элементарная стадия
реакции – превращение одной (распад или изомеризация) или нескольких
столкнувшихся частиц реагентов (молекул, атомов, ионов) в частицы продуктов. Реакции, протекающие в одну элементарную стадию – простые, в две и более – сложные. Простые по молекулярности (общему числу частиц реагентов, участвующих в одной элементарной стадии) делятся на: Бимолекулярные – две частицы реагентов
Мономолекулярные – одна частица реагента
Тримолекулярные – три частицы реагентов
Слайд 7Скорость реакции в целом определяется лимитирующей (самой медленной) стадией реакции.
В приведенном примере таковой является стадия, описываемая уравнением а).
Подавляющее большинство
реакций является сложными и протекает через две и более элементарных стадий.Сложная реакция, уравнение которой
протекает через две элементарные стадии, уравнения которых
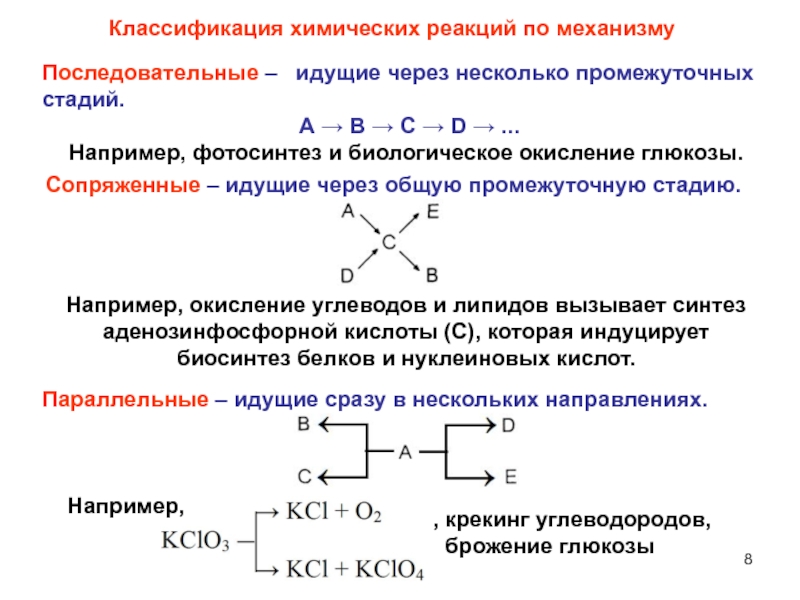
Слайд 8Сопряженные – идущие через общую промежуточную стадию.
Классификация химических реакций по
механизму
Последовательные – идущие через несколько промежуточных стадий.
А
В С D ... Например, фотосинтез и биологическое окисление глюкозы.
Например, окисление углеводов и липидов вызывает синтез аденозинфосфорной кислоты (С), которая индуцирует биосинтез белков и нуклеиновых кислот.
Параллельные – идущие сразу в нескольких направлениях.
Например,
, крекинг углеводородов,
брожение глюкозы
Слайд 9 Цепные – стадии превращения реагентов в продукты
многократно повторяются.
Свободные радикалы – частицы с неспаренными электронами.
Радиоактивное, ультрафиолетовое и лазерное облучение, шум, вибрация, способствуют накоплению свободных радикалов в организме. Свободно-радикальное окисление в организме приводит к патологическим биопроцессам – канцерогенезу, лучевой болезни. Слайд 10ВАЖНЕЙШИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИЙ
природа реагентов
концентрация реагентов
температура
давление
катализатор
Слайд 11ВЛИЯНИЕ ПРИРОДЫ РЕАГЕНТОВ
Скорость химической реакции зависит от природы реагентов. Например,
F2 реагирует с H2 значительно быстрее, чем I2. Гомогенные реакции
в газовой фазе между радикалами и в растворах между ионами протекают быстро, между молекулами – медленнее, гетерогенные реакции – ещё медленнее.Влияние природы реагентов на скорость проявляется через константу скорости и энергию активации реакции.
Слайд 12ВЛИЯНИЕ КОНЦЕНТРАЦИЙ РЕАГЕНТОВ
Необходимым условием химического взаимодействия является
столкновение частиц реагентов. Чем больше концентрации реагентов, тем больше их
частиц в единице реакционного объема, и тем чаще эти частицы сталкиваются. Т. о., с ростом концентраций реагентов скорость реакции должна возрастать.Зависимость скорости от концентраций количественно описывает закон действующих масс (ЗДМ) для скорости реакции:
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению текущих (неравновесных) концентраций реагентов, возведенных в некоторые степени, показатели которых определяются экспериментально, и называются частными порядками по данным реагентам.
Слайд 13где a, b, d, f – коэффициенты; A, B, D,
F – формулы участников;
кинетическое уравнение имеет следующий вид:
где k –
константа скорости, (л/моль)(n–1)/с; c(A) и c(B) – концентрации соответствующих реагентов, моль/л; nA и nB – частные порядки по соответствующим реагентам;
n = nA + nB – общий порядок реакции.
Математическое выражение ЗДМ, т. е. уравнение зависимости скорости реакции от концентраций реагентов, называется кинетическим уравнением реакции.
Вместо c(A) и c(B) иногда используют обозначения
[A] и [B] соответственно, но это нежелательно, т. к. приводит к смешению текущих и равновесных концентраций.
Слайд 14Константа скорости химической реакции k численно равна скорости химической реакции
v при концентрациях всех реагентов c, равных 1 моль/л и
зависит от:природы реакции
температуры
катализатора
k не зависит от концентрации реагентов!
Стехиометрическое уравнение реакции описывает процесс в целом, но не отражает механизма.
Слайд 15В реакциях нулевого порядка скорость реакции не зависит от концентраций
реагентов.
В реакциях первого порядка скорость реакции линейно зависит от концентрации
реагента.У сложных реакций молекулярности нет, а порядок реакции в общем виде не совпадает с суммой коэффициентов в левой части уравнения.
Частные порядки по реагентам и общий порядок сложной реакции могут быть нулевыми и дробными.
По графику зависимости скорости от концентрации можно судить о величине частного порядка.
Слайд 16 Концентрации твердых и жидких (не растворённых!) веществ
не входят в кинетические уравнения гетерогенных реакций, так как они
(концентрации) постоянны и учитываются величинами констант скорости.Чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена их измельчением, а растворимых веществ – и растворением.
Слайд 17ВЛИЯНИЕ ТЕМПЕРАТУРЫ
Правило (закон) Вант-Гоффа
При повышении температуры на 10 °С
(10 K) скорость большинства химических реакций возрастает в (температурный
коэффициент скорости) раз.Столкновение частиц реагентов необходимо, но не достаточно для химического взаимодействия. Частицы могут столкнуться и разлететься без изменения своей природы (неэффективное столкновение), а могут образовать частицы другой природы (эффективное столкновение). Характер столкновения зависит от соотношения между суммарной кинетической энергией столкнувшихся частиц и потенциальной энергией отталкивания («прочности» частиц). Частицы, кинетическая энергия которых не меньше потенциальной энергии отталкивания, называются активными.
С ростом температуры растет доля активных частиц, увеличивается доля эффективных столкновений и возрастает скорость реакции.
Слайд 18Уравнение Вант-Гоффа
где v2 и v1 – скорости реакции при температурах
T2 и T1 соответственно; Δt1 и Δt2 – времена реакции
при температурах T1 и T2 соответственно.Температурный коэффициент скорости у большинства реакций находится в интервале = 2 – 4, но для биохимических реакций = 7 – 9, поэтому небольшие колебания температуры тела сильно влияют на самочувствие человека.
Например, если повысить температуру на 100 °С (100 K), то скорость реакции, температурный коэффициент которой равен 2, увеличится в:
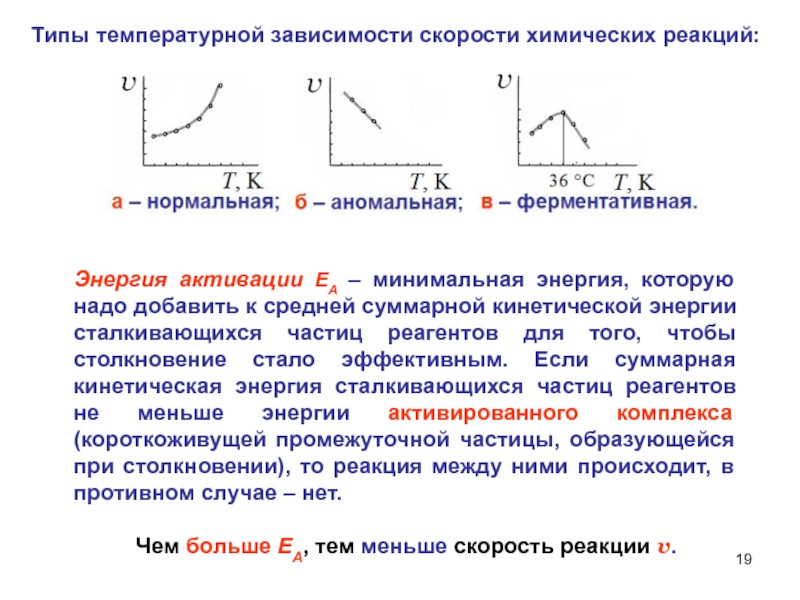
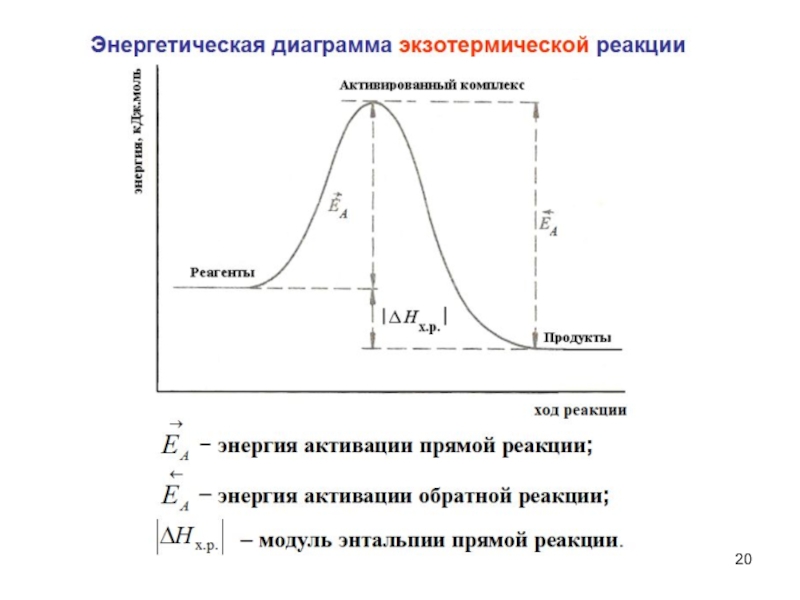
Слайд 19Энергия активации ЕA – минимальная энергия, которую надо добавить к
средней суммарной кинетической энергии сталкивающихся частиц реагентов для того, чтобы
столкновение стало эффективным. Если суммарная кинетическая энергия сталкивающихся частиц реагентов не меньше энергии активированного комплекса (короткоживущей промежуточной частицы, образующейся при столкновении), то реакция между ними происходит, в противном случае – нет.Чем больше ЕA, тем меньше скорость реакции v.
Типы температурной зависимости скорости химических реакций:
Слайд 21Уравнение Аррениуса
где ЕA – энергия активации; k – константа
скорости реакции;
R = 8,31 Дж/(моль·К) – универсальная газовая постоянная;
T –
температура, К; А – предэкспоненциальный множитель (равен константе скорости при Т → ∞, или при нулевой ЕA).
Слайд 22Графический способ нахождения EA и A из уравнения Аррениуса
Аналитический способ
нахождения EA из уравнения Аррениуса
где k2 и k1 – константы
скорости реакции при температурах T2 и T1 соответственно.Слайд 23
ВЛИЯНИЕ ДАВЛЕНИЯ
Уравнение Клапейрона-Менделеева
где p – давление; V
– объем; n – количество вещества.
Из ЗДМ и уравнения Клапейрона-Менделеева
вытекает закон общего давления:
скорость реакции, среди реагентов которой имеются газообразные вещества, при постоянной температуре прямо пропорциональна общему давлению системы, возведенному в степень суммы частных порядков по всем газообразным реагентам.
Например, при повышении давления в 4 раза скорость газофазной (все участники – газы) реакции общего 3-го порядка (n = 3) вырастет в
Слайд 24Катализаторы – вещества, увеличивающие скорость химических реакций, но не расходующиеся
в них.
Ингибиторы – вещества, замедляющие скорость химических реакций.
ВЛИЯНИЕ КАТАЛИЗАТОРОВ
Роль
катализатора – понижение энергии активации за счет создания нового пути протекания реакции. Катализаторы и ферменты изменяют скорости и
прямой и обратной реакций, но не смещают равновесие!!!
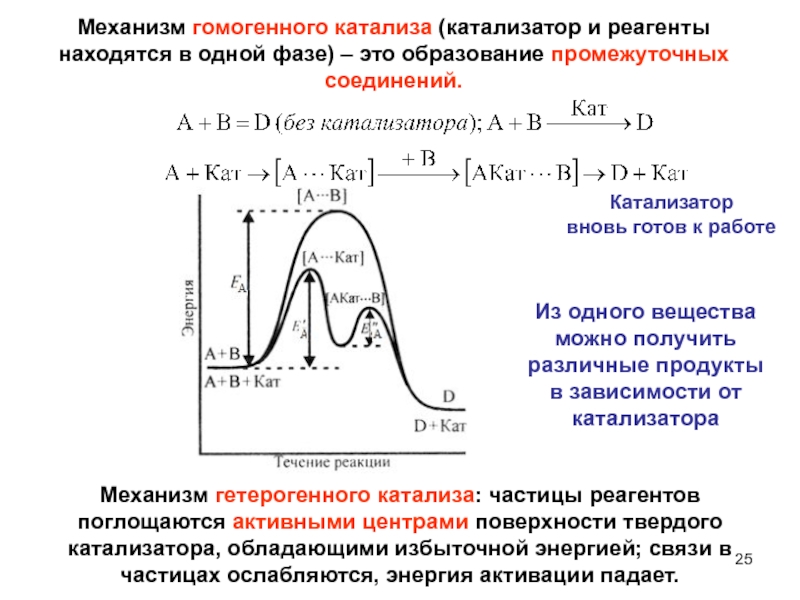
Слайд 25Катализатор
вновь готов к работе
Механизм гомогенного катализа (катализатор и реагенты
находятся в одной фазе) – это образование промежуточных соединений.
Из одного
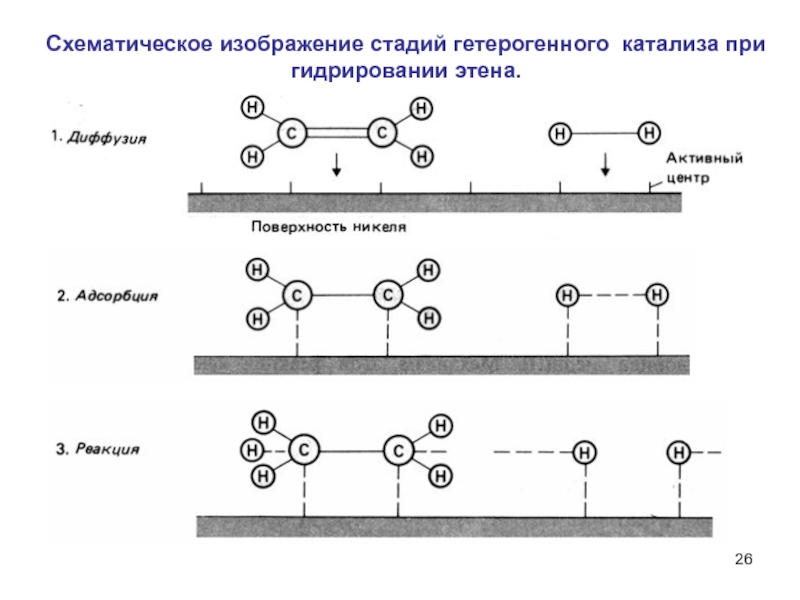
вещества можно получить различные продукты в зависимости от катализатораМеханизм гетерогенного катализа: частицы реагентов поглощаются активными центрами поверхности твердого катализатора, обладающими избыточной энергией; связи в частицах ослабляются, энергия активации падает.
Слайд 28Ферменты (энзимы) – белковые молекулы, которые катализируют химические реакции в
живых системах
Отличия от химического катализа:
Высокая каталитическая активность, в миллионы раз
превосходящая активность химических катализаторов.Например, 1 г пепсина расщепляет 50 кг яичного белка;
1 г кристаллического ренина свертывает 72 т молока.
2. Высокая химическая специфичность, каждый фермент действует лишь на строго определенную реакцию или группу реакций, протекающих в организме.
Например, уреаза катализирует только гидролиз мочевины; пепсин расщепляет только белки.
Ферментативный катализ
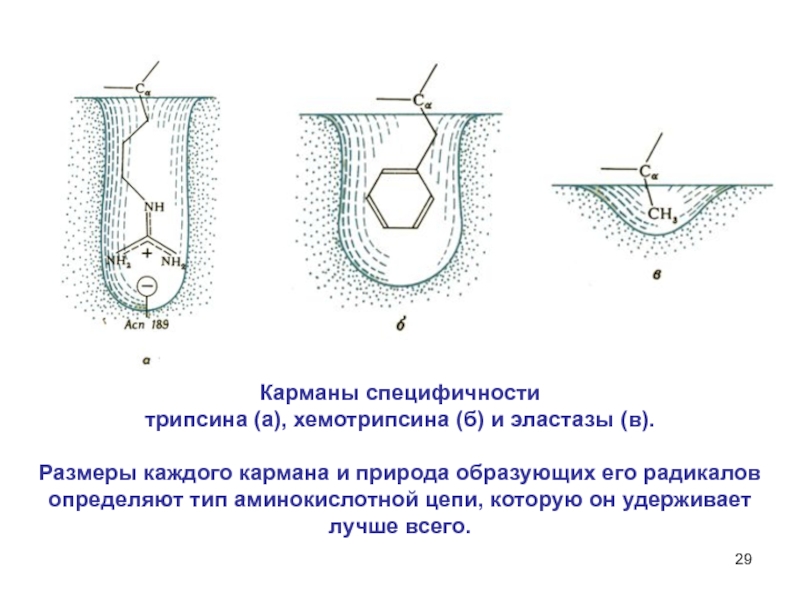
Слайд 29Карманы специфичности
трипсина (а), хемотрипсина (б) и эластазы (в).
Размеры
каждого кармана и природа образующих его радикалов определяют тип аминокислотной
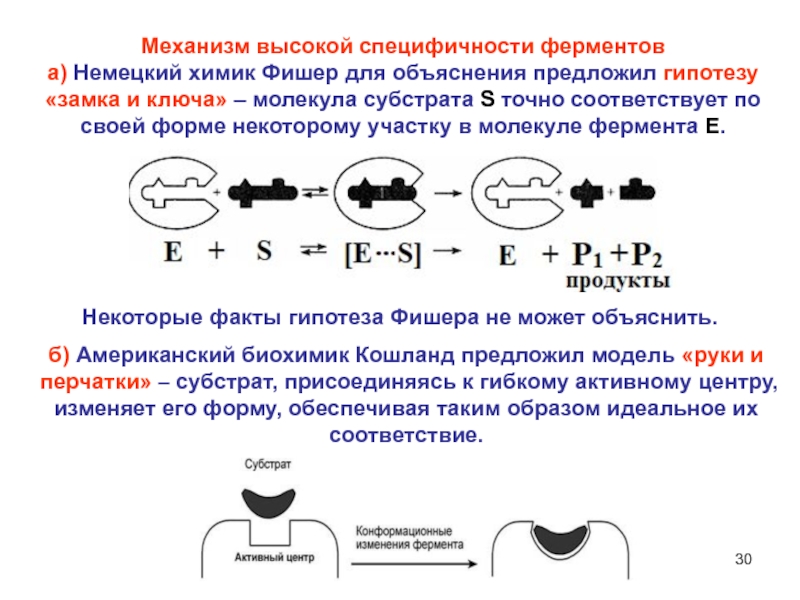
цепи, которую он удерживает лучше всего.Слайд 30Механизм высокой специфичности ферментов
а) Немецкий химик Фишер для объяснения
предложил гипотезу «замка и ключа» – молекула субстрата S точно
соответствует по своей форме некоторому участку в молекуле фермента E.Некоторые факты гипотеза Фишера не может объяснить.
б) Американский биохимик Кошланд предложил модель «руки и перчатки» – субстрат, присоединяясь к гибкому активному центру, изменяет его форму, обеспечивая таким образом идеальное их соответствие.
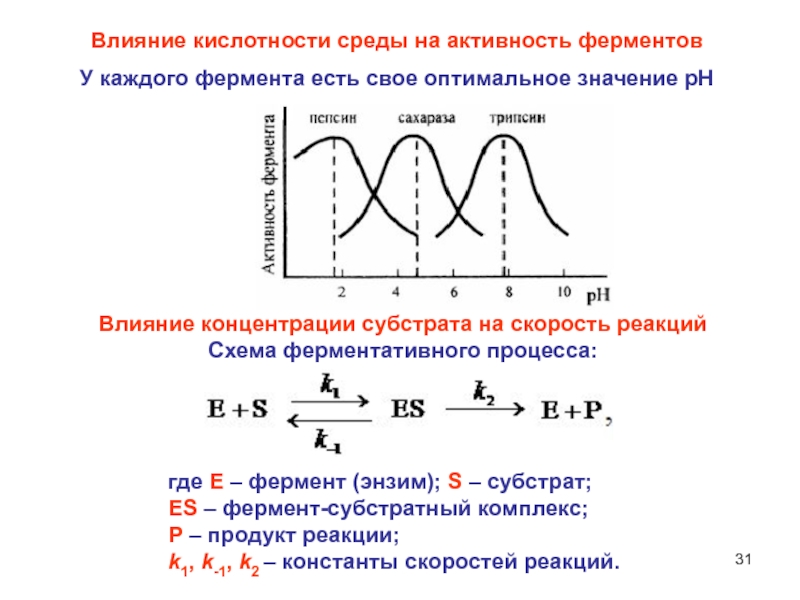
Слайд 31Влияние кислотности среды на активность ферментов
У каждого фермента есть свое
оптимальное значение рН
Влияние концентрации субстрата на скорость реакций
Схема ферментативного процесса:
где
Е – фермент (энзим); S – субстрат; ES – фермент-субстратный комплекс;
P – продукт реакции;
k1, k-1, k2 – константы скоростей реакций.
Слайд 32Уравнение Михаэлиса-Ментен
где c(S) – концентрация субстрата; vmax – максимальная скорость
(соответствует такой c(S), при которой активные центры всех молекул фермента
насыщены молекулами субстрата); KM – константа Михаэлиса (зависит от рН, температуры и природы субстрата).Слайд 33Физический смысл константы Михаэлиса
Она численно равна концентрации субстрата c(S), при
которой
Чем она меньше, тем больше сродство фермента к субстрату.
При k1
>> k-1 KM минимальна, скорость реакции максимальна, достигается высокое сродство.Сравнивая значения КM, можно определить, какой тип молекул наиболее прочно связывается с ферментом.
Эффективность ферментативного действия определяется числом оборотов фермента – максимальным количеством частиц субстрата, которое одна молекула фермента превращает в продукт в единицу времени.
Например, для карбоангидразы число оборотов составляет около 6·105 с –1, т. е. одна молекула фермента за 1 с превращает примерно 6·105 молекул CO2
в гидрокарбонат-ионы.
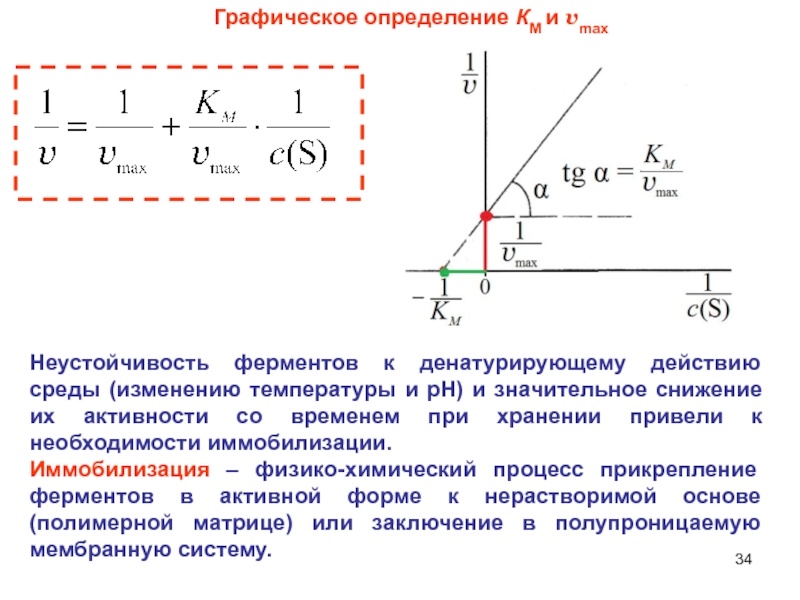
Слайд 34Графическое определение КМ и vmax
Неустойчивость ферментов к денатурирующему действию среды
(изменению температуры и рН) и значительное снижение их активности со
временем при хранении привели к необходимости иммобилизации.Иммобилизация – физико-химический процесс прикрепление ферментов в активной форме к нерастворимой основе (полимерной матрице) или заключение в полупроницаемую мембранную систему.
Слайд 35Значение ферментов и ферментативных реакций
Применение ферментов в качестве лекарственных препаратов;
Разработка
методов диагностики с помощью ферментов;
Производство антибиотиков;
Синтез гидрокси- и аминокислот, гидролиз
крахмала;Изготовление кисломолочных продуктов, сыра, алкогольных напитков, обработка фруктов и овощей;
Использование иммобилизованных ферментов для аналитических целей и в методах очистки биологических жидкостей.
М – полимерная часть матрицы; Ф – основная часть молекулы фермента.
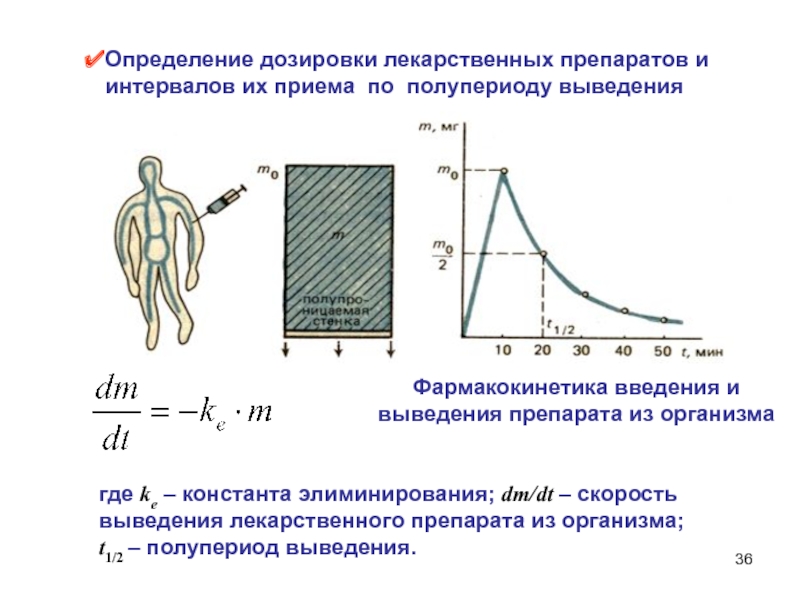
Слайд 36Определение дозировки лекарственных препаратов и
интервалов их приема по полупериоду
выведения
Фармакокинетика введения и выведения препарата из организма
где kе – константа
элиминирования; dm/dt – скорость выведения лекарственного препарата из организма; t1/2 – полупериод выведения.
Слайд 39 Химическое равновесие – состояние обратимого процесса, при котором
скорости прямой и обратной реакций равны, а энергия Гиббса (Гельмгольца)
реакции равна нулю.Равновесными называются концентрации участников реакции, которые устанавливаются при наступлении состояния химического равновесия. Они обозначаются формулами веществ (частиц), заключенными в квадратные скобки, например [NO] или [H+].
Слайд 40Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по
мере достижения равновесия.
Слайд 41Количественной характеристикой состояния равновесия является константа равновесия – постоянная при
данной температуре для данной реакции величина, связывающая между собой равновесные
концентрации участников реакции. Она зависит только от природы реакции и от температуры.Если значение константы равновесия << 1, то продуктов намного меньше, чем реагентов, т. е. степень превращения близка к 0. Если значение константы >> 1, то степень превращения близка к 1. Наконец, если значение константы близко к 1, то это означает, что количества реагентов и продуктов сопоставимы между собой.
Закон действующих масс (ЗДМ) для равновесия:
отношение произведения равновесных концентраций (парциальных давлений, мольных долей) продуктов, возведенных в степени, показатели которых равны их стехиометрическим коэффициентам в уравнении реакции, к такому же произведению равновесных концентраций (парциальных давлений, мольных долей) реагентов, есть постоянная при данной температуре величина, называемая константой равновесия.
Слайд 42Концентрации твердых и жидких (не растворённых!) веществ не входят в
выражение констант равновесия гетерогенных реакций, вместо них при необходимости ставят
единицу:Слайд 43Если считать, что прямая и обратная реакции являются простыми, то
выражение константы равновесия может быть выведено из кинетических уравнений обеих
реакций и условия их равенства при равновесии. Однако, т. к. большинство реакций является сложными, то для них этот вывод осуществляется из термодинамических соотношений. уравнение изотермы выглядит так:
где с(…) – текущие концентрации. При равновесии
∆Aх.р. = 0, а с(…) = […], откуда
Слайд 44Состоянию равновесия соответствует определенное значение константы, т. е. соотношение равновесных
концентраций. В одном состоянии может быть много положений равновесия, каждому
из которых соответствует совокупность конкретных значений равновесных количеств вещества всех газообразных и растворенных участников реакции.Смещение химического равновесия – переход из одного положения равновесия в другое.
Если после смещения равновесия продуктов стало больше, чем в исходном положении, то произошло смещение равновесия в сторону продуктов реакции (вправо), а если стало больше реагентов, то говорят о смещении равновесия в сторону реагентов (влево).
Если смещение равновесия вызвано изменением количества вещества одного из участников реакции, то судить о направлении смещения можно только по изменению количеств остальных участников.
Слайд 45Принцип Ле Шателье
Если на систему, находящуюся в
состоянии равновесия, оказывается внешнее воздействие, то равновесие смещается (или может
сместиться) в таком направлении, чтобы свести к минимуму влияние этого воздействия.1. Влияние изменения температуры на смещение равновесия.
Если температуру повышают, то равновесие сместится в сторону продуктов эндотермической реакции. Если температуру понижают, то равновесие сместится в сторону продуктов экзотермической реакции. Равновесие атермической реакции изменение температуры не смещает. Эти положения вытекают из термодинамических соотношений:
Слайд 46прямая реакция – экзотермическая, обратная – эндотермическая, повышение температуры смещает
равновесие влево, а понижение – вправо.
прямая реакция – эндотермическая,
обратная – экзотермическая, повышение температуры смещает равновесие вправо, а понижение – влево. реакция – атермическая, изменение температуры
не смещает равновесие.
2. Влияние изменения концентраций (точнее, количеств вещества) на смещение равновесия.
Изменение количества вещества участника реакции смещает равновесие только при условии, что этот участник является газообразным или находится в растворе.
Слайд 47Если реагент добавляют в реакционную систему (повышают его концентрацию), то
равновесие смещается вправо. Если же его отводят из реакционной системы
(понижают концентрацию), то равновесие смещается влево.Если продукт добавляют в реакционную систему (повышают его концентрацию), то равновесие смещается влево. Если же его отводят из реакционной системы (понижают концентрацию), то равновесие смещается вправо.
Изменение количеств твердых и жидких (не растворителей!) веществ не смещает равновесие.
Слайд 48Рассмотрим добавление в эту систему жидкой воды, являющейся не только
участником (реагентом), но и растворителем (разбавление). Концентрация воды при этом
практически не изменяется, влияние этого фактора сказывается через изменение концентраций остальных участников. Пусть начальная концентрация катиона аммония равна 1 моль/л, тогда к моменту достижения равновесия его прореагирует x моль/л:Разбавим раствор в 2 раза, тогда
т. е. произведение концентраций, стоящих в числителе Kc, сразу после разбавления уменьшится в 22 = 4 раза, а концентрация, стоящая в знаменателе, уменьшится только в 2 раза. Для сохранения Kc неизменным, произведение концентраций, стоящих в числителе, должно после разбавления вырасти в 2 раза, или каждая из концентраций должна увеличиться в √2 раз
Слайд 49Другими словами, после разбавления концентрации продуктов растут, что эквивалентно смещению
равновесия вправо, т. е. добавление воды (разбавление) смещает равновесие этой
реакции в сторону продуктов.3. Влияние изменения давления на смещение равновесия.
Изменение общего давления (за счет изменения объема системы) смещает равновесие только тех реакций, в которых участвуют газы, и при этом Δn ≠ 0.
Если общее давление системы повышают (уменьшают ее объем), то равновесие сместится в сторону мéньшей суммы коэффициентов при формулах газов, а если понижают, то в сторону бóльшей.
Слайд 50В обеих частях уравнения суммы коэффициентов при формулах газов одинаковы
и равны 4, поэтому изменение общего давления не смещает равновесие.
Если
же суммы коэффициентов при формулах газов в обеих частях уравнения одинаковы и Δn = 0 (в частности, в реакциях, протекающих без участия газов), то изменение общего давления не смещает равновесие.где p(…) – равновесные парциальные давления.
При повышении давления (уменьшении объема) в 2 раза числитель Kp вырастет в 22 = 4 раза, а знаменатель – в 2·23 = 16 раз. Для сохранения значения Kp неизменным числитель в процессе смещения равновесия должен вырасти, а знаменатель – уменьшиться, равновесие сместится вправо, в сторону мéньшей суммы коэффициентов при формулах газов (2 < 1 + 3 = 4).