Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Кислотно-основные (протолитические) равновесия Кислотно-основные реакции –
Содержание
- 1. 1 Кислотно-основные (протолитические) равновесия Кислотно-основные реакции –
- 2. Протолитическая теория Брёнстеда-ЛоуриКислоты – вещества, способные отдавать
- 3. Амфолиты – вещества, способные как отдавать, так
- 4. Некоторые кислоты, основания и амфолиты
- 5. Все вещества могут проявить свои кислотно-основные свойства
- 6. Автопротолиз. Константа автопротолиза
- 7. Большинство растворителей являются амфолитами. Реакция, в которой
- 8. SH + SH
- 9. Константа автопротолиза водыH2O + H2O
- 10. Сила кислот и основанийСпособность кислоты отдавать протон,
- 11. Реакция взаимодействия слабой кислоты с растворителем:HA
- 12. Реакция взаимодействия слабого основания с растворителем:B
- 13. Связь между константой кислотности и константой основности
- 14. A– + SH
- 15. Произведение константы кислотности кислоты на константу основности
- 16. Расчет рН сильной кислоты
- 17. Расчет рН
- 18. Расчет рН слабой кислоты
- 19. Слайд 19
- 20. Расчет рН слабого основания
- 21. Слайд 21
- 22. Связь между константой диссоциации и степенью диссоциации
- 23. Слайд 23
- 24. Расчет рН многоосновных кислотH2A
- 25. Слайд 25
- 26. H2SO4 H+ +
- 27. Вычислить рН 0,01 М раствора азотной кислоты.Решение.Определяем,
- 28. В 300 мл раствора растворили 0,12 г
- 29. Вычислить рН 0,5% раствора бензойной кислоты.pH =
- 30. Рассчитайте концентрацию ацетат-иона в 0,02 М растворе уксусной кислоты.Решение. Кк-ты = 1,74·10–5
- 31. Рассчитайте степень диссоциации муравьиной кислоты в 1%
- 32. рН 0,5 М раствора гидразина равна 10,89.Вычислите
- 33. При какой концентрации бензойная кислота ионизирована на
- 34. Миндальная кислота в 1,5% растворе ионизирована на
- 35. Рассчитайте концентрацию H+, HSO4–, SO42– в 0,1
- 36. K2 к-ты= 1,2·10–2[SO42– ] = x =
- 37. Вычислить концентрации H+ и OH– в растворе
- 38. Скачать презентанцию
Протолитическая теория Брёнстеда-ЛоуриКислоты – вещества, способные отдавать протон и переходить в сопряженное основание.CH3COOH CH3COO– + H+ кислота
Слайды и текст этой презентации
Слайд 1
Кислотно-основные (протолитические)
равновесия
Кислотно-основные реакции – это реакции, связанные с переносом протона
(реакции нейтрализации, диссоциации, гидролиза)
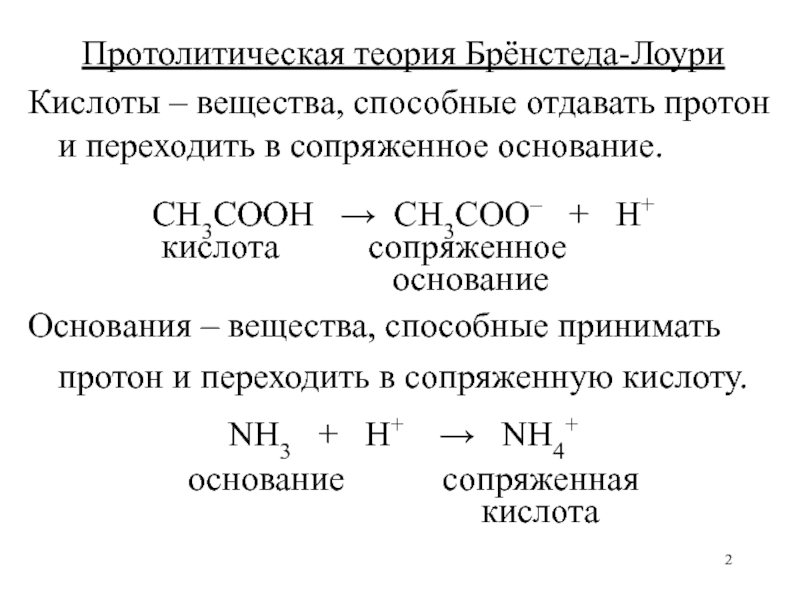
Слайд 2Протолитическая теория Брёнстеда-Лоури
Кислоты – вещества, способные отдавать протон и переходить
в сопряженное основание.
CH3COOH CH3COO– + H+
кислота сопряженное основание
Основания – вещества, способные принимать протон и переходить в сопряженную кислоту.
NH3 + H+ NH4+
основание сопряженная
кислота
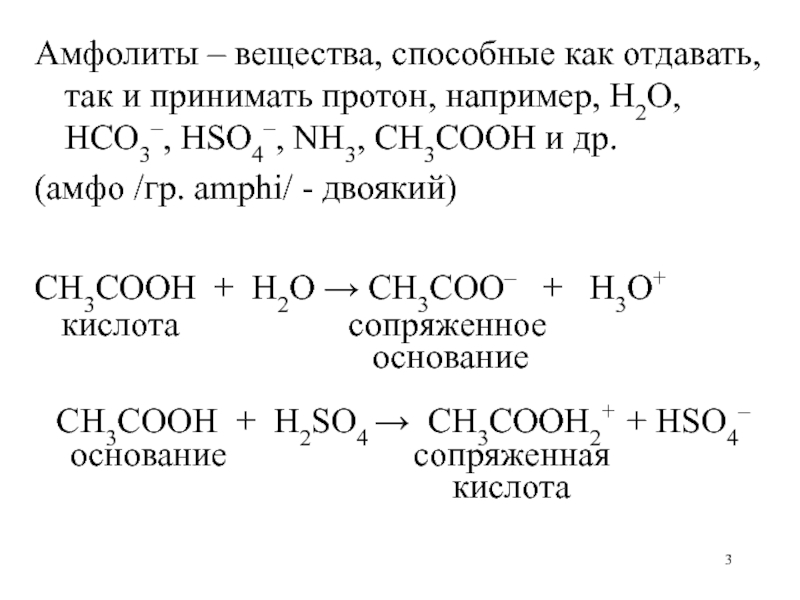
Слайд 3Амфолиты – вещества, способные как отдавать, так и принимать протон,
например, H2O, HCO3–, HSO4–, NH3, CH3COOH и др.
(амфо /гр. amphi/
- двоякий)CH3COOH + H2O CH3COO– + H3O+
кислота сопряженное
основание
CH3COOH + H2SO4 CH3COOH2+ + HSO4–
основание сопряженная
кислота
Слайд 5Все вещества могут проявить свои кислотно-основные свойства лишь в протолитической
реакции:
HA + B BH+
+ A– к-та 1 осн-е 2 к-та 2 осн-е 1
Одним из компонентов протолитической реакции является растворитель.
Слайд 7Большинство растворителей являются амфолитами. Реакция, в которой одна молекула растворителя
проявляет свой ства кислоты, а другая – основания, называется автопротолизом.
Автопротолиз
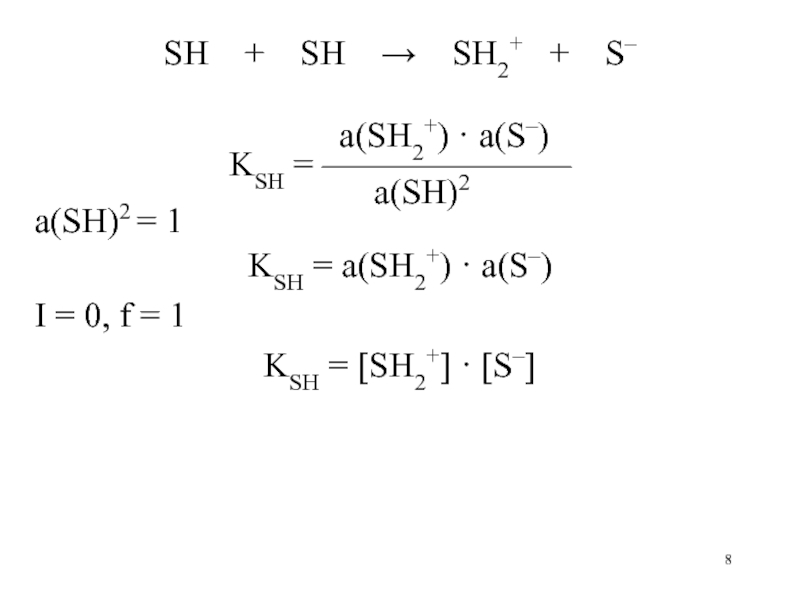
– это взаимодействие между молекулами растворителяSH + SH SH2+ + S–
ион ион
лиония лиата
Слайд 8SH + SH SH2+
+ S–
a(SH2+) ·
a(S–)KSH = ———————
a(SH)2
a(SH)2 = 1
KSH = a(SH2+) · a(S–)
I = 0, f = 1
KSH = [SH2+] · [S–]
Слайд 9Константа автопротолиза воды
H2O + H2O
H3O+ + OH–
KW = a(H3O+) · a(OH–)
I
= 0, f = 1KW = [H3O+] · [OH–]
KW = [H+] · [OH–]
t = 25 oC KW = 1·10–14
[H+] · [OH–] = 1·10–14
pH + pOH = 14
Слайд 10
Сила кислот и оснований
Способность кислоты отдавать протон, а основания принимать
его (т.е. силу кислот и оснований) можно охарактери-зовать константами равновесия,
которые называют константой кислотности и константой основностиСлайд 11Реакция взаимодействия слабой кислоты с растворителем:
HA + SH
SH2+ + A–
[SH2+] · [A–]KaHA,SH = ———————
[HA]
Чем сильнее способность растворителя прини-мать протон (т.е. чем сильнее выражены ос-новные свойства растворителя), тем больше
[SH2+], тем больше KaHA,SH и тем больше сила кислоты.
Сила кислоты зависит от растворителя.
Слайд 12Реакция взаимодействия слабого основания с растворителем:
B + SH
BH+ + S–
[BH +] · [S–]KbB,SH = ———————
[B]
Чем сильнее способность растворителя отдавать протон (т.е. чем сильнее выражены кислотные свойства растворителя), тем больше [S–], тем больше KbB,SH и тем больше сила основания.
Сила основания зависит от растворителя.
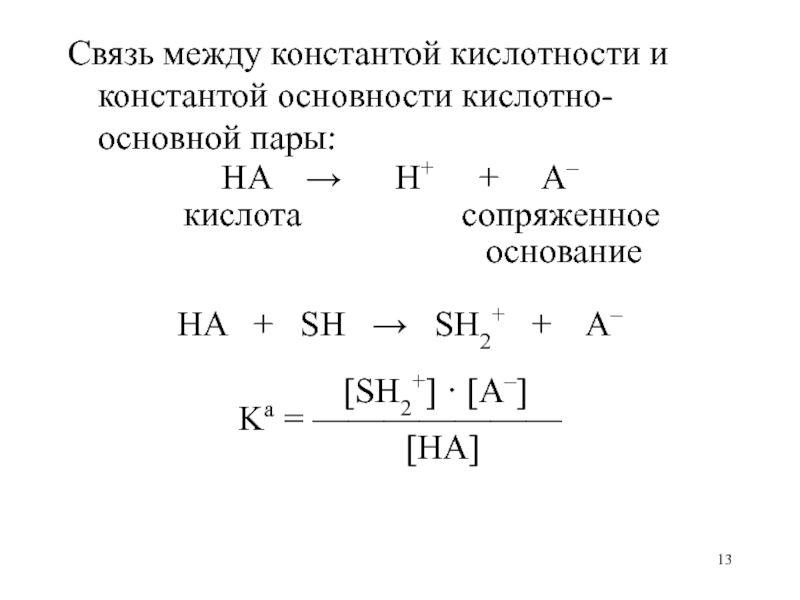
Слайд 13Связь между константой кислотности и константой основности кислотно-основной пары:
HA
H+ + A–
кислота сопряженное
основание
HA + SH SH2+ + A–
[SH2+] · [A–]
Ka = ———————
[HA]
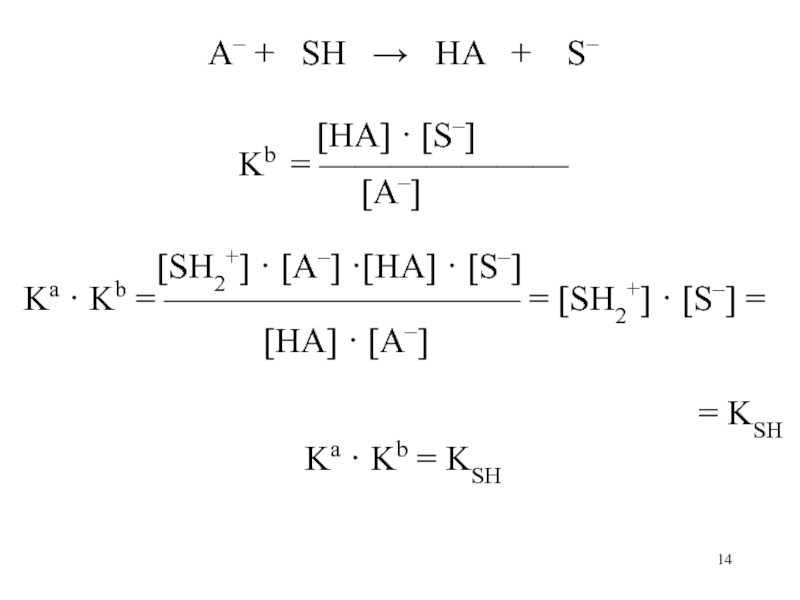
Слайд 14A– + SH HA +
S–
[HA] · [S–]Kb = ———————
[A–]
[SH2+] · [A–] ·[HA] · [S–]
Ka · Kb = —————————— = [SH2+] · [S–] =
[HA] · [A–]
= KSH
Ka · Kb = KSH
Слайд 15
Произведение константы кислотности кислоты на константу основности сопряженного с кислотой
основания для данной кислотно-основной пары, при данной температуре, есть величина
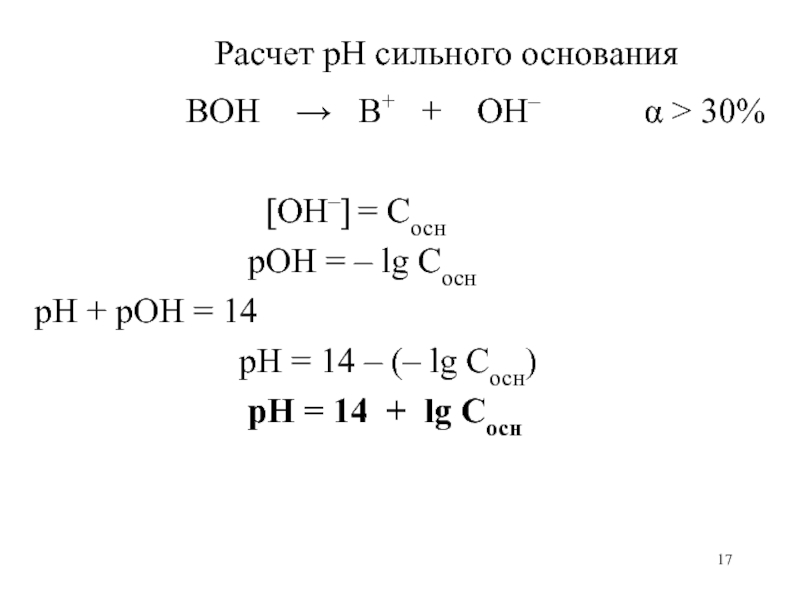
постоянная и равна константе автопротолиза растворителя, в которой находится данная кислотно-основная пара.Слайд 17 Расчет рН сильного основания
BOH
B+ + OH– > 30%[OH–] = Cосн
рОН = – lg Cосн
pH + pOH = 14
рН = 14 – (– lg Cосн)
рН = 14 + lg Cосн
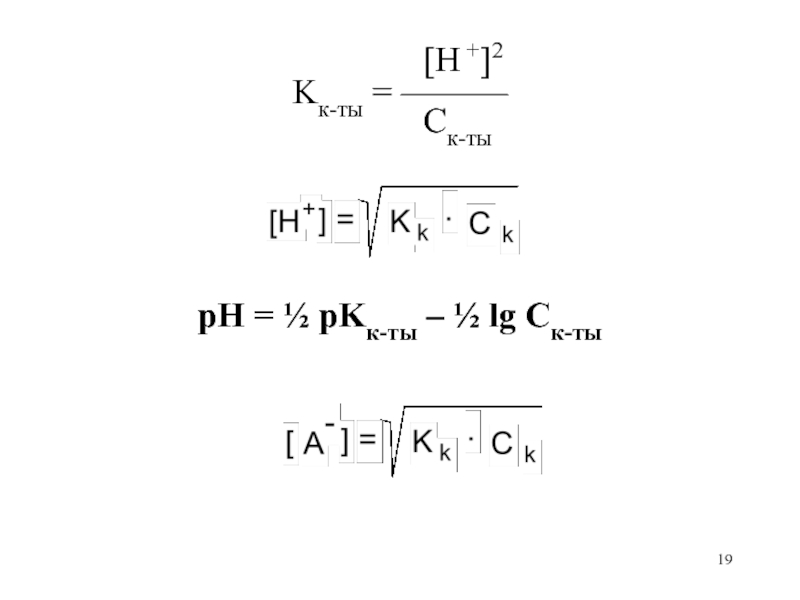
Слайд 18Расчет рН слабой кислоты
HA H+ + A–
< 3%[H +] · [A–]
Kк-ты = ——————
[HA]
[H+] = [A–]
[HA] = Cк-ты – [H +] Cк-ты
Слайд 20Расчет рН слабого основания
BOH B+ + OH–
< 3%[B +] · [OH–]
Kосн = ——————
[BOH]
[B+] = [OH–]
[BOH] = Cосн – [OH –] Cосн
Слайд 22Связь между константой диссоциации и степенью диссоциации слабой кислоты
HA
H+ + A– < 3%[H +] · [A–]
Kк-ты = —————
[HA]
[H+] = Cк-ты
[A–] = Cк-ты
[HA] = Cк-ты – Cк-ты = Cк-ты (1 – )
Слайд 23
[H +]
· [A–] ( Cк-ты)2
Kк-ты = ————— = —————— [HA] Cк-ты (1 – )
2
Kк-ты = Cк-ты ———
1 –
< 3%
Kк-ты = Cк-ты 2
Слайд 24Расчет рН многоосновных кислот
H2A H+ +
HA–
[H +] · [HA–]K1 к-ты = —————
[H2A]
HA– H+ + A2–
[H +] · [A2–]
K2 к-ты = —————
[HA–]
Слайд 25
K1 к-ты
Если
——— > 104 - расчет рН
K2 к-тыведется по I ступени
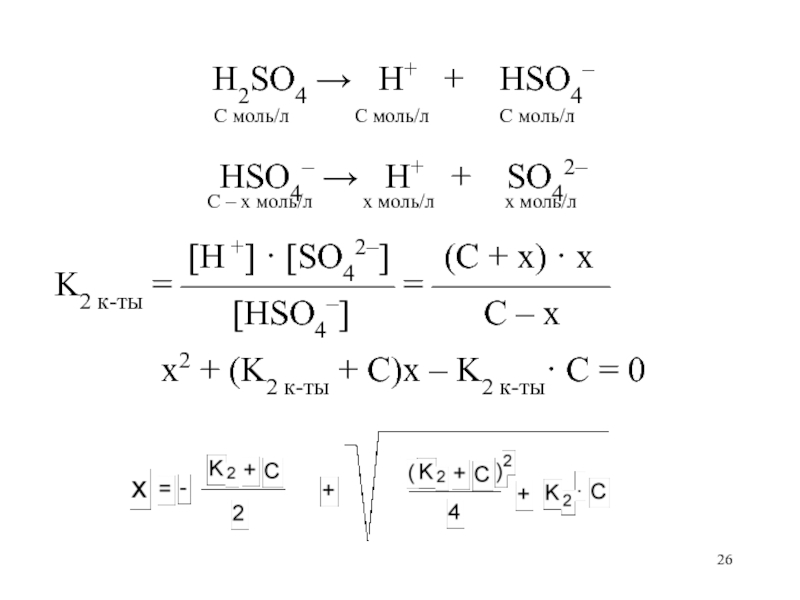
H2SO4 – сильная по I ступени
слабая по II ступени
H2SO4 H+ + HSO4–
C моль/л C моль/л C моль/л
HSO4– H+ + SO42–
C – x моль/л x моль/л x моль/л
Слайд 26
H2SO4 H+ + HSO4–
C моль/л
C моль/л C моль/лHSO4– H+ + SO42–
C – x моль/л x моль/л x моль/л
[H +] · [SO42–] (C + x) · x
K2 к-ты = —————— = —————
[HSO4–] C – x
x2 + (K2 к-ты + С)x – K2 к-ты· C = 0
Слайд 27Вычислить рН 0,01 М раствора азотной кислоты.
Решение.
Определяем, сильная или слабая
кислота
сильное или слабое основание2. Выбираем соответствующую формулу
3. Проверяем концентрацию
рН = – lg Cк-ты
рН = – lg 10–2 = 2
Слайд 28В 300 мл раствора растворили 0,12 г NaOH.
Вычислите рН раствора.
Решение.
0,12
С(NaOH) = ——— = 0,01 (М)
40 · 0,3
рН = 14 + lg Cосн
рН = 14 + lg 0,01 = 12
Слайд 29Вычислить рН 0,5% раствора бензойной кислоты.
pH = ½ pKк-ты –
½ lg Cк-ты
pKк-ты = 4,20
C% · · 10 0,5 · 1 · 10С(C6H5COOH) = ————— = ————— =
M 122,12
= 0,04 M
pH = ½ · 4,20 – ½ lg 0,04 = 2,79
Слайд 30Рассчитайте концентрацию ацетат-иона в 0,02 М растворе уксусной кислоты.
Решение.
Кк-ты
= 1,74·10–5
Слайд 31Рассчитайте степень диссоциации муравьиной кислоты в 1% растворе.
Решение. Кк-ты =
1,8·10–4
1,0 · 1 · 10С(HCOOH) = ————— = 0,0217 (M)
46
или 2,8 %
В 1% растворе муравьиная кислота ионизирована на 2,8%
Слайд 32рН 0,5 М раствора гидразина равна 10,89.
Вычислите константу диссоциации гидразина.
Решение.
рOH = 14 – pH = 14 –
10,89 = 3,11[OH–] = 10–pOH = 10–3,11 = 7,76·10–4 (M)
N2H4 + H2O N2H5+ + OH–
C – 7,76·10–4 7,76·10–4 7,76·10–4
[N2H5+] · [OH–] (7,76·10–4 )2
Kосн = ——————— = ————— = 1,2 ·10–4
[N2H4] 0,5 – 7,76·10–4
Слайд 33При какой концентрации бензойная кислота ионизирована на 3%?
Решение. 3%
или 0,03; Кк-ты = 6,3·10–5
2
Kк-ты = Cк-ты ———
1 –
1 – 6,3·10–5 · (1 – 0,03)
Cк-ты = Kк-ты ——— = ————————— =
2 0,032
= 0,068 (М)
Слайд 34Миндальная кислота в 1,5% растворе ионизирована на 6,5%. Вычислите константу
диссоциации миндальной кислоты.
Решение. 1,5% = 0,1 М
6,5% или 0,0652
Kк-ты = Cк-ты ———
1 –
0,0652
Kк-ты = 0,1 ———— = 4·10–4
1 – 0,065
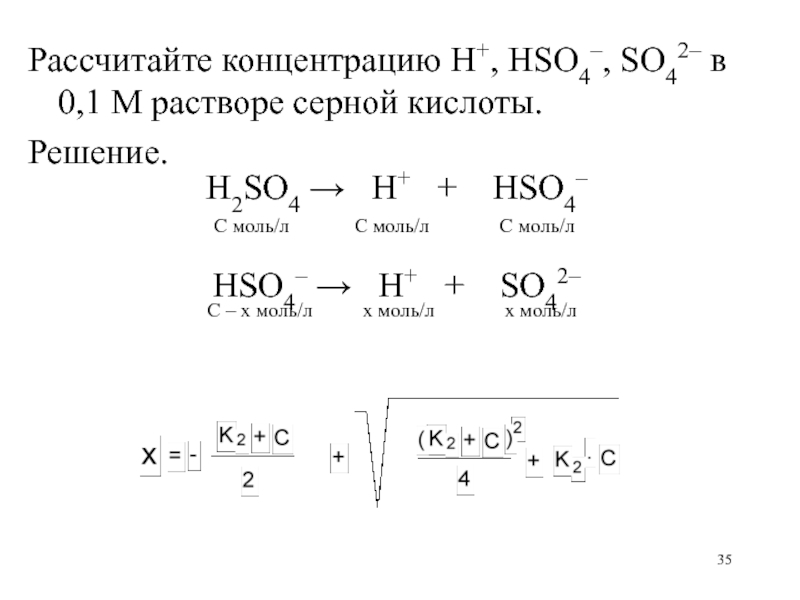
Слайд 35Рассчитайте концентрацию H+, HSO4–, SO42– в 0,1 М растворе серной
кислоты.
Решение.
H2SO4 H+ + HSO4–
C моль/л C моль/л C моль/л HSO4– H+ + SO42–
C – x моль/л x моль/л x моль/л
Слайд 37Вычислить концентрации H+ и OH– в растворе с рН =
4,16
Решение.
[H+] = 10–pH = 10–4,16 = 6,91·10–5 моль/л
[OH–] = 10–pOH
= 10–9,84 = 1,44·10–10 моль/л, т.к. pOH = 14 – 4,16 = 9,84












![1
Кислотно-основные (протолитические)
равновесия
Кислотно-основные реакции – [OH–]2Kосн](/img/thumbs/02ede99708080556304325bd27c04b58-800x.jpg)

![1
Кислотно-основные (протолитические)
равновесия
Кислотно-основные реакции – [H +] · [A–] ( [H +] · [A–] (](/img/thumbs/1ae651e8659c9e88bb147aaa4c31b33e-800x.jpg)










![1
Кислотно-основные (протолитические)
равновесия
Кислотно-основные реакции – K2 к-ты= 1,2·10–2[SO42– ] = x = 0,009 M[H+] = 0,1 K2 к-ты= 1,2·10–2[SO42– ] = x = 0,009 M[H+] = 0,1 + x = 0,109 M[HSO4–]= 0,1](/img/thumbs/c00532a2b6f6f60c0c45be4f954dcce1-800x.jpg)
![1
Кислотно-основные (протолитические)
равновесия
Кислотно-основные реакции – Вычислить концентрации H+ и OH– в растворе с рН = 4,16Решение.[H+] Вычислить концентрации H+ и OH– в растворе с рН = 4,16Решение.[H+] = 10–pH = 10–4,16 = 6,91·10–5](/img/tmb/3/241314/6d552f26cc0cb7b224bca97a339b42e8-800x.jpg)