Застосовується переважно у моторобудуванні.
Бронза - сплав міді (від 80 %)
й олова (до 20 %). Головною відмінністю бронзи є її здатність добре відливатися, завдяки чому вона використовується для художнього лиття. Більша частина бронзи використовується в машинобудуванні.
Мельхіор містить близько 80 % міді й 20 % нікелю. Активно використовується для виготовлення ювелірних виробів, посуду, столових приборів.
Константан - сплав на основі міді, що містить до 4 % нікелю й близько 2 % марганцю.
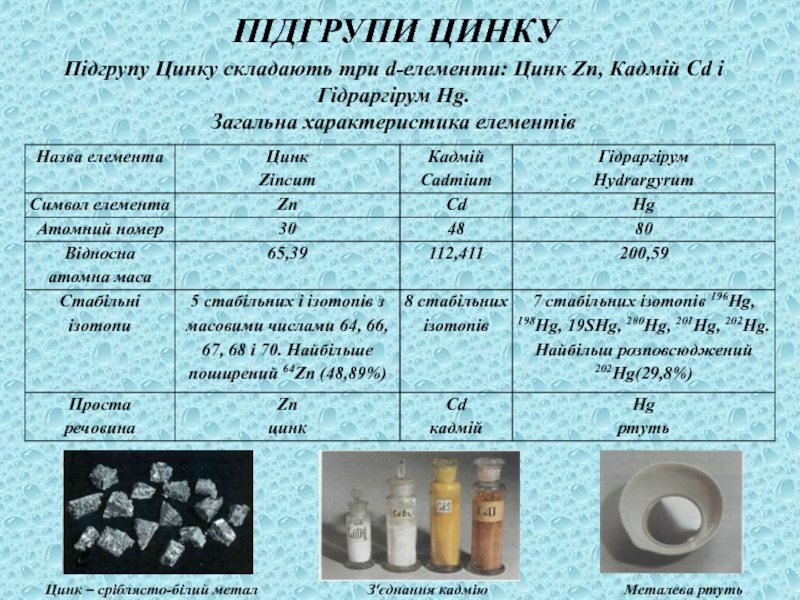
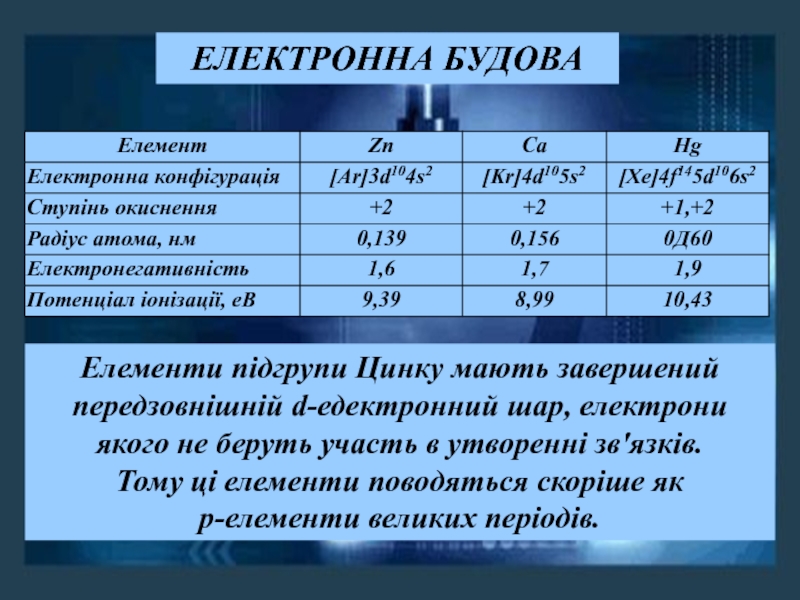
ЗАСТОСУВАННЯ
Майже половина всієї міді, що видобувається, витрачається на виготовлення сплавів, серед яких найвідоміші латунь, бронза, константан і мельхіор.
Найширше мідь застосовується для виготовлення провідників
(завдяки високій електропровідності й пластичності).
Малахіт - оздоблювальний матеріал, часто використовуваний для виготовлення побутових предметів і ювелірних виробів. Малахіт, отриманий штучно, нічим не поступається природному. Одержання малахіту здійснюється відповідно до наступного рівняння реакції:
Мідь - незамінний елемент для нормальної життєдіяльності живих організмів, оскільки є каталізатором внутрішньоклітинних окисних процесів. Добова потреба людини складає 5 мг міді. При нестачі міді розвивається анемія (зниження кількості утвореного гемоглобіну),
при надлишку - отруєння.