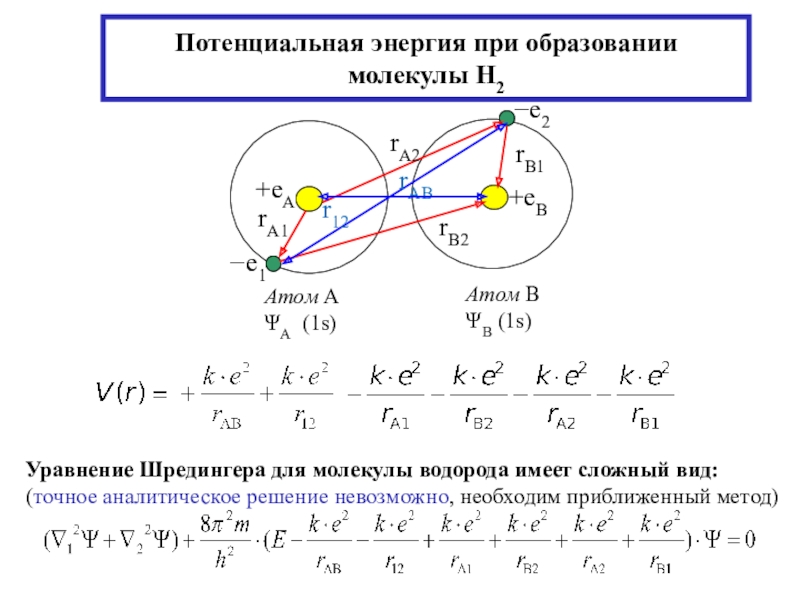
интеграл» - описывает изменение ∆Е энергии системы из-за электростатич.взаимодействия ядер
и эл-нов (в молекуле водорода Н2)
I – «обменный интеграл», «интеграл обменного взаимодействия» - ∆Е вследствие неразличимости эл-нов (электрон принадлежит обоим ядрам)
S – «интеграл перекрывания» - ∆Е вследствие перекрывания АО - 0S<1:
r: Q0, I 0, S 0 – изолированные атомы водорода
r rсв Q < 0, I < 0, причем Q<<I, 0 ≤ S < 1 → (1 ± S2) > 0 →
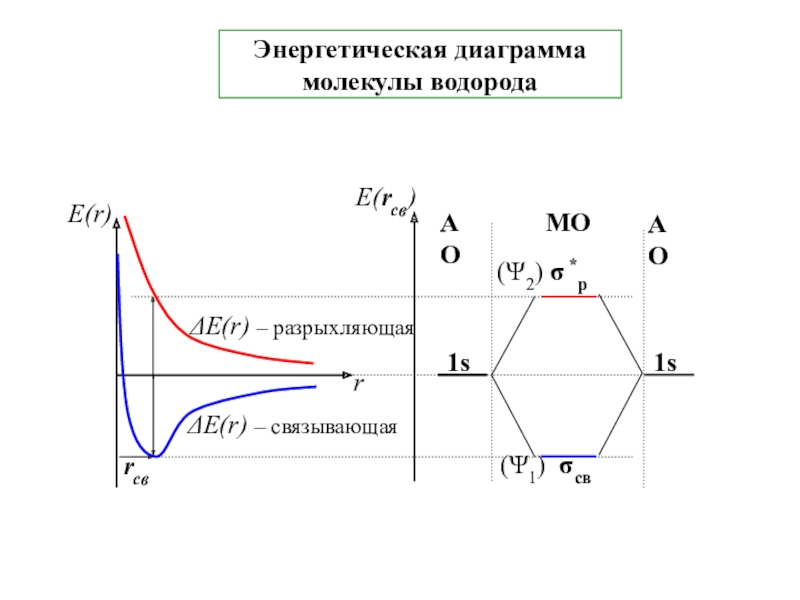
Всё зависит от знака обменного интеграла I в ∆E(r)s и ∆E(r)A [см. слайд 9]
При r rсв получаем ∆E(r)s < 0, а ∆E(r)A > 0.
Для ∆E(r)s [спины электронов (↑↓)] полная Е < 2ЕО - меньше энергии 2-х изолир.атомов Н [Е = 2Ео - ΔЕ(r)S] - выигрыш энергии на величину -∆E(r)s → образование связи между атомами водорода и следовательно молекулы Н2
Для ∆E(r)A [спины электронов (↑↑)] E > 2ЕО– связь между атомами водорода не образуется т.к. энергия Е связанной системы (молекулы Н2) [Е = 2ЕО + ΔЕ(r)A] больше энергии двух изолиров. атомов 2ЕО на величину +∆E(r)A [cм. слайд 9]
Вывод: при образовании хим.связи молекулы Н2 основное значение имеет обменное взаимодействие (знак интеграла I), удовлетворяющее условию антипараллельности (↑↓) спинов электронов атомов водорода

![2-ХИМСВЯЗЬ 2.1 Кривая Морзе. Основные параметры химической связиrсв[Å] - длина химической связиEсв[эВ, 2.1 Кривая Морзе. Основные параметры химической связиrсв[Å] - длина химической связиEсв[эВ, кДжмоль] - энергия химической связи (минимум](/img/tmb/6/594440/7fcf305b26f48a4f538a85f982493c06-800x.jpg)


![2-ХИМСВЯЗЬ Решение ур.Шредингера [подстановка A и S в ур.Шредингера и нахождение Решение ур.Шредингера [подстановка A и S в ур.Шредингера и нахождение ΔЕ(r)A и ΔЕ(r)S соответственно] и](/img/tmb/6/594440/b732f62c549b9a328d079d918b317027-800x.jpg)




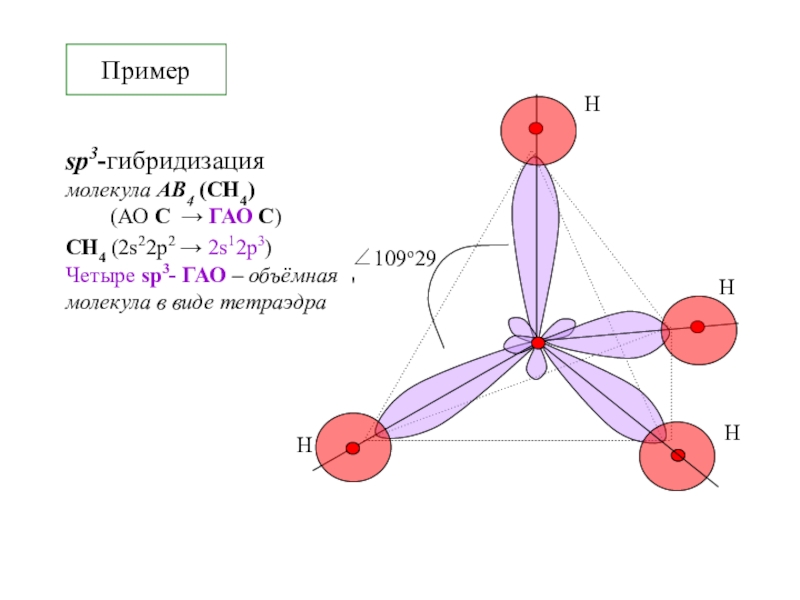
![2-ХИМСВЯЗЬ Примерdsp2-гибридизация для молекулярного иона[CuCl4]-2Из четырёх dsp2–ГАО образуется плоский квадрат Cu Примерdsp2-гибридизация для молекулярного иона[CuCl4]-2Из четырёх dsp2–ГАО образуется плоский квадрат Cu](/img/tmb/6/594440/8936c0f3680e971d14060489ad18fb49-800x.jpg)
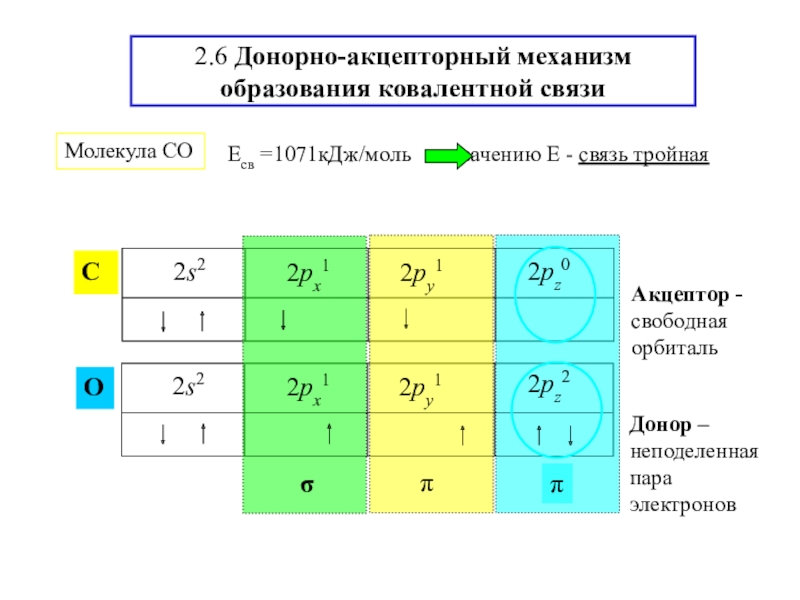
![2-ХИМСВЯЗЬ Ион [NH4]+ NH3 + H+ [NH4]+Из эксперимента - четыре равноценных Ион [NH4]+ NH3 + H+ [NH4]+Из эксперимента - четыре равноценных атома водорода, тетраэдрическая конфигурация sp3-гибридизация](/img/tmb/6/594440/20a3d14dbaee1d00f41c48b0c86f373f-800x.jpg)

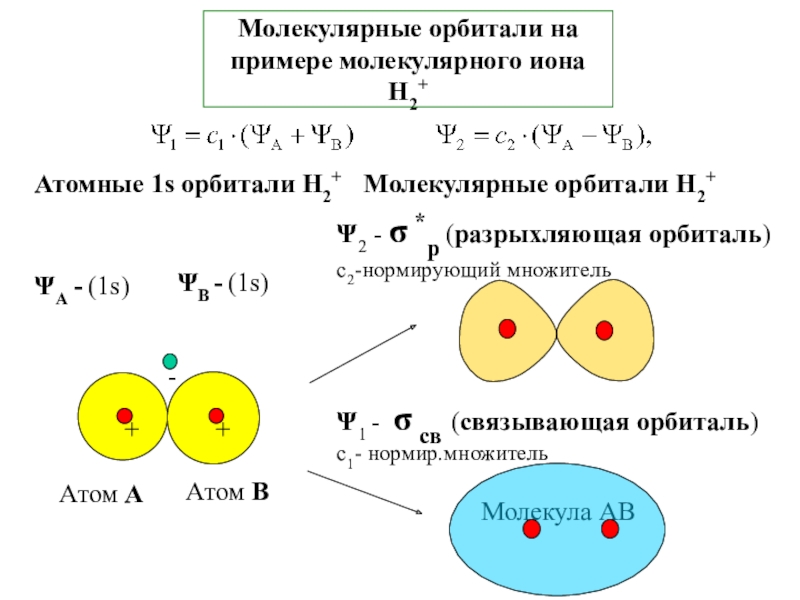

![2-ХИМСВЯЗЬ Пример: энергетическая диаграмма молекулы NOПарамагнетик – наличие неспаренных электронов на МОДиамагнетик Пример: энергетическая диаграмма молекулы NOПарамагнетик – наличие неспаренных электронов на МОДиамагнетик – отсутствие неспаренных электроновNO [св(s)]2 [(s)](/img/tmb/6/594440/2703b672fbf2068ec17149dce7987fb5-800x.jpg)



















