Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
2-лек-А.ppt
Содержание
- 1. 2-лек-А.ppt
- 2. 1.3 Электрон в потенциальном ящикеПотенциальная яма -
- 3. Нахождение волновой функции.a - параметр потенциального ящикаn = 1,2,3…- квантовое число
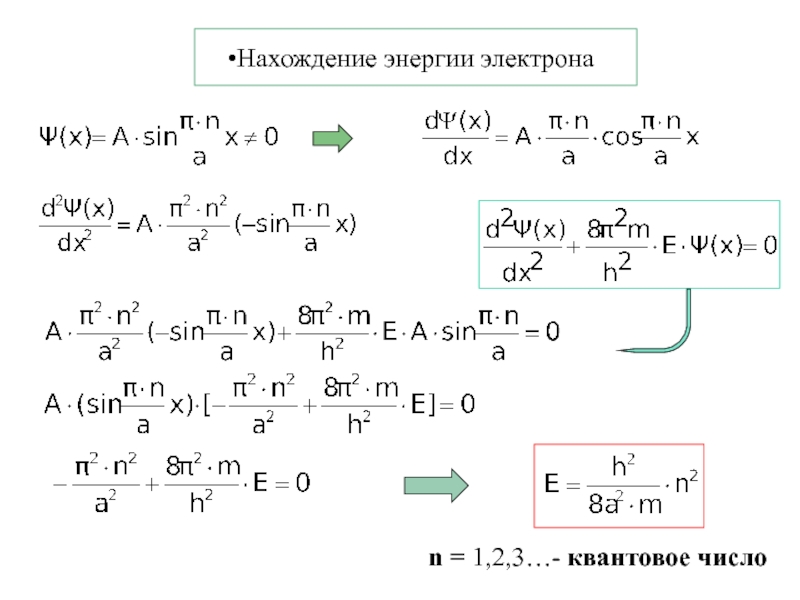
- 4. Нахождение энергии электронаn = 1,2,3…- квантовое число
- 5. Электрон в связанном состоянии Выводы:Полная энергия
- 6. Электрон в трехмерном потенциальном ящике.Решение:a,b,c – параметры
- 7. Вырожденные энергетические состояния одно значение энергии –
- 8. 1.4 Основное состояние атома водорода.x = r⋅sinϑ⋅cosϕ
- 9. Решение уравнения Шредингера для основного состояния атома водорода
- 10. 1.5 Радиальное распределение электронной плотности. Электронная орбиталь.1.41
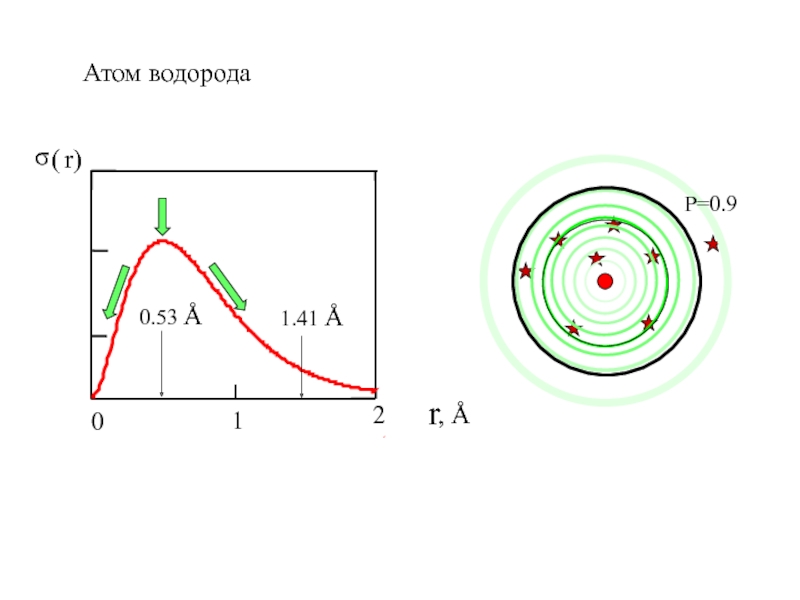
- 11. Атом водорода
- 12. 1.6 Возбужденные состояния атома водорода Волновая функции
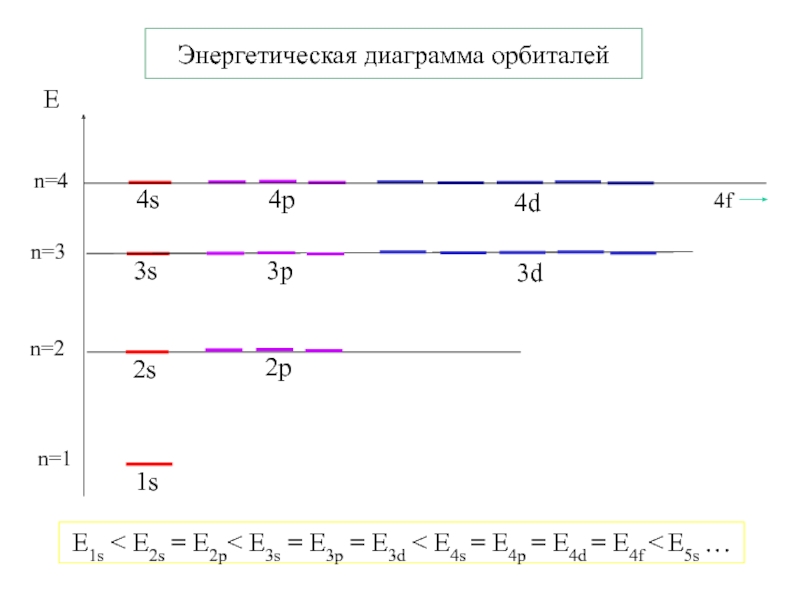
- 13. Квантовые числаглавное – n = 1,2,3,4…∞орбитальное –
- 14. nl = 0,1…(n-1)m = -l,…0,…+lЧислоЭнергия1E2210E10 – s1
- 15. Энергетическая диаграмма орбиталейn=1E1s < E2s = E2p<
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физический смысл волновой функции
Ψ(x,y,z) - пси функция - волновая функция
Макс
Борн
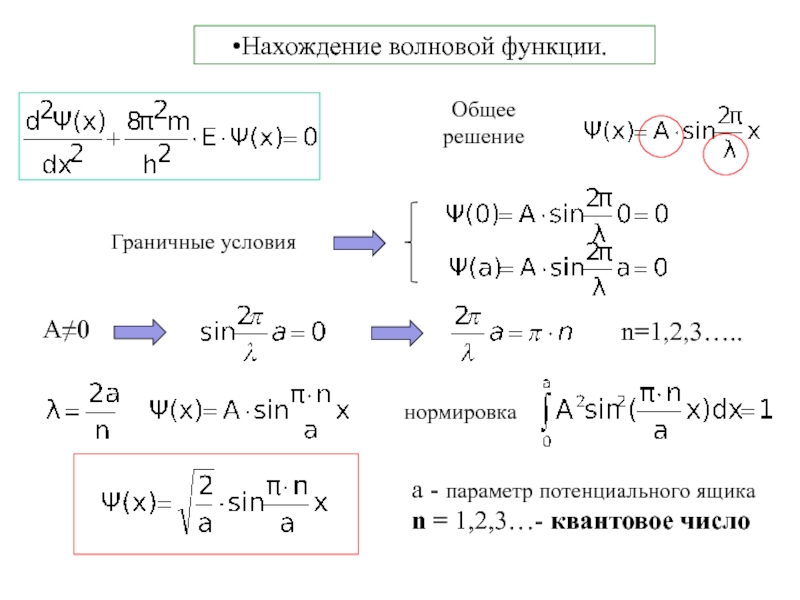
функции пропорционален вероятности (dP) нахождения частицы в элементарном объеме (dV)Слайд 21.3 Электрон в потенциальном ящике
Потенциальная яма - область пространства, в
которой потенциальная энергия частицы меньше, чем в окружающем пространстве (связанное
состояние)Граничные условия:
внутри ящика: V=0 Ψ(x)
на границах ящика: V= ∞ Ψ(0)=0; Ψ(а)=0
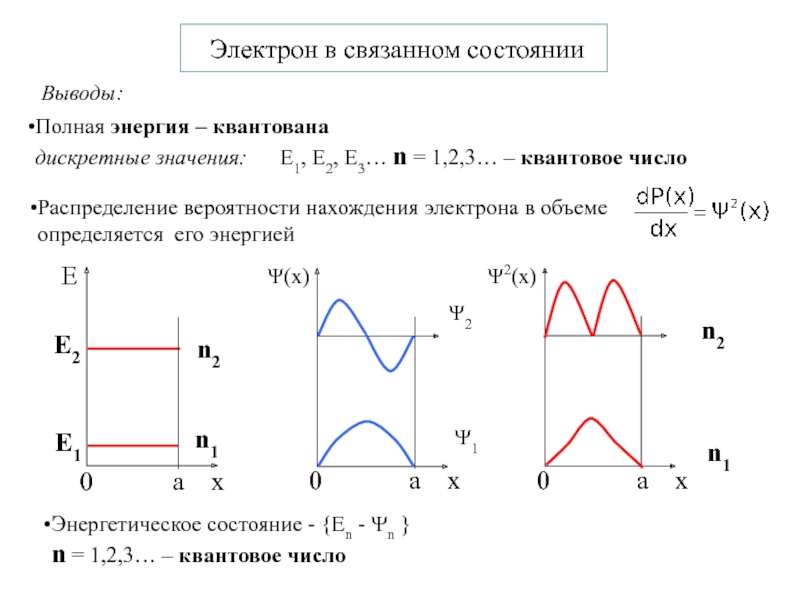
Слайд 5 Электрон в связанном состоянии
Выводы:
Полная энергия – квантована
дискретные
значения: E1, E2, E3… n = 1,2,3… –
квантовое числоЭнергетическое состояние - {En - Ψn }
n = 1,2,3… – квантовое число
Слайд 6Электрон в трехмерном потенциальном ящике.
Решение:
a,b,c – параметры ящика
Выводы:
1. Энергия
электрона квантована.
2. Энергетическое состояние определяется набором из трех квантовых
чисел.
Слайд 7Вырожденные энергетические состояния
одно значение энергии – несколько наборов квантовых
чисел - несколько волновых функций
а = b = c
Е,
[1,1,1]
[2,2,2]
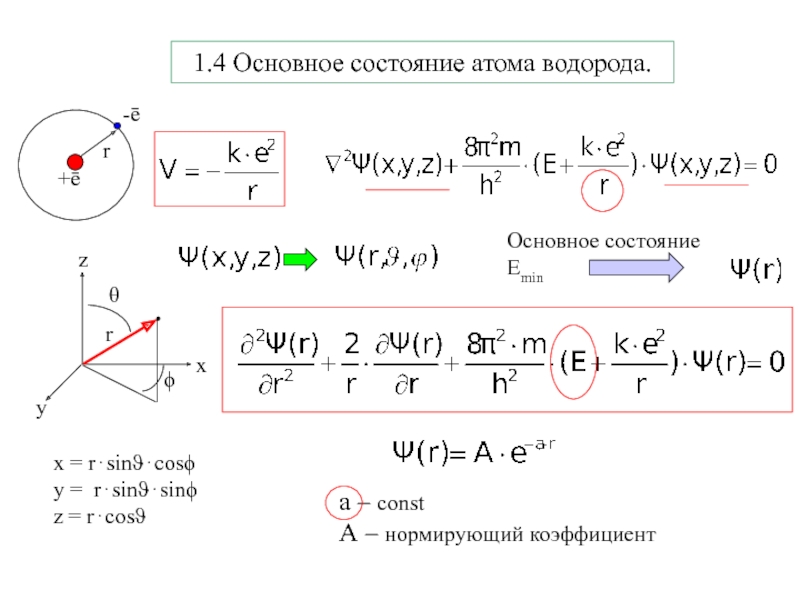
Слайд 81.4 Основное состояние атома водорода.
x = r⋅sinϑ⋅cosϕ
y = r⋅sinϑ⋅sinϕ
z
= r⋅cosϑ
а – const
А – нормирующий коэффициент
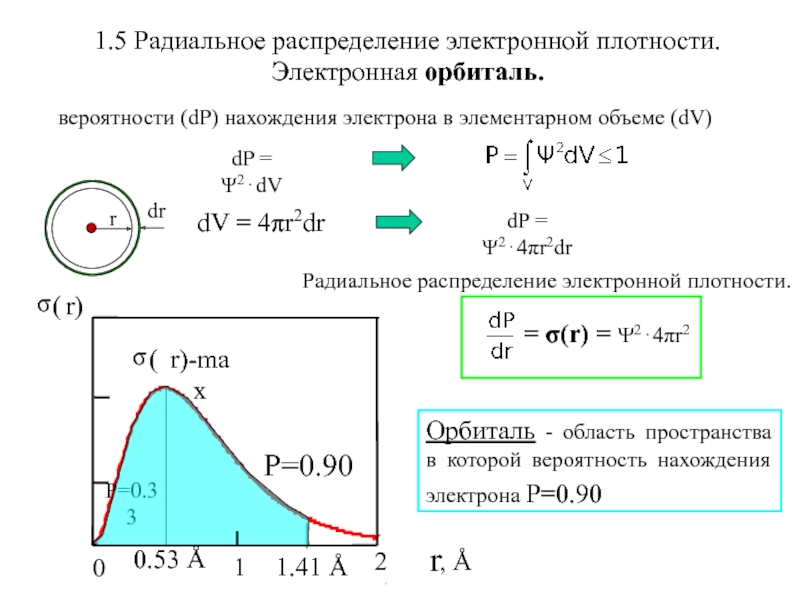
Слайд 101.5 Радиальное распределение электронной плотности. Электронная орбиталь.
1.41 Å
dV = 4πr2dr
Орбиталь
- область пространства в которой вероятность нахождения электрона P=0.90
Слайд 121.6 Возбужденные состояния атома водорода
Волновая функции - Ψ(r,ϑ,ϕ) =
R(r)⋅Y(θ,ϕ)
R(r)n, l - функция радиального распределения электронной плотности
Y(θ,ϕ)l, m -
функция углового распределения электронной плотностиКвантовые числа:
главное – n = 1,2,3,4…∞
орбитальное – l = 0,1,2,3...(n -1)
магнитное – m = -l, (-l+1),...,0,...,(+l–1), +l
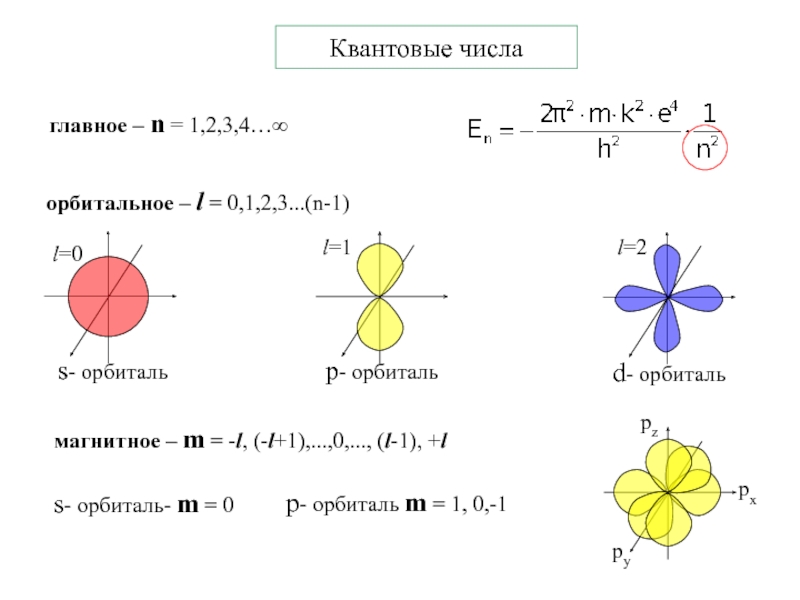
Слайд 13Квантовые числа
главное – n = 1,2,3,4…∞
орбитальное – l = 0,1,2,3...(n-1)
s-
орбиталь
р- орбиталь
d- орбиталь
магнитное – m = -l, (-l+1),...,0,..., (l-1), +l
s-
орбиталь- m = 0р- орбиталь m = 1, 0,-1
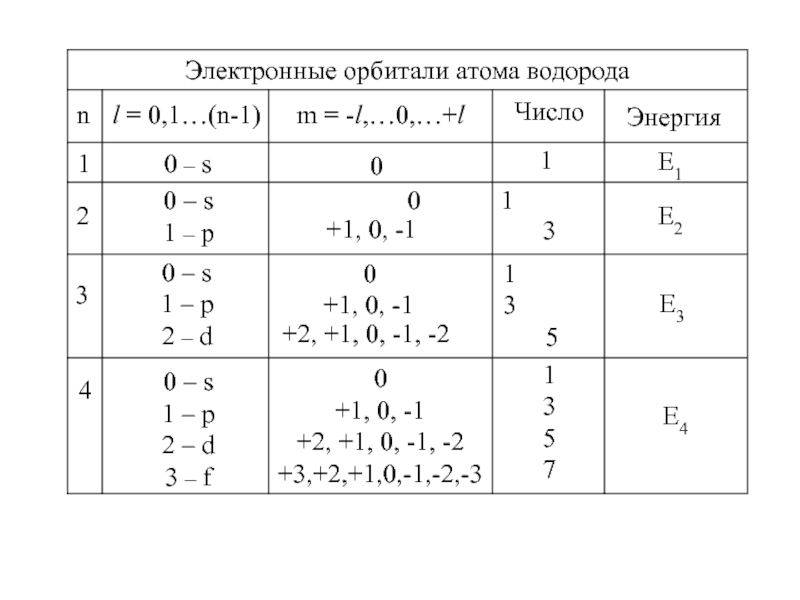
Слайд 14n
l = 0,1…(n-1)
m = -l,…0,…+l
Число
Энергия
1
E2
2
1
0
E1
0 – s
1 – p
0 1
+1,
0, -1
3
E3
5
3
0 – s
1 – p
2 – d
0 1 +1, 0, -1 3
+2, +1, 0, -1, -2
4
0 – s