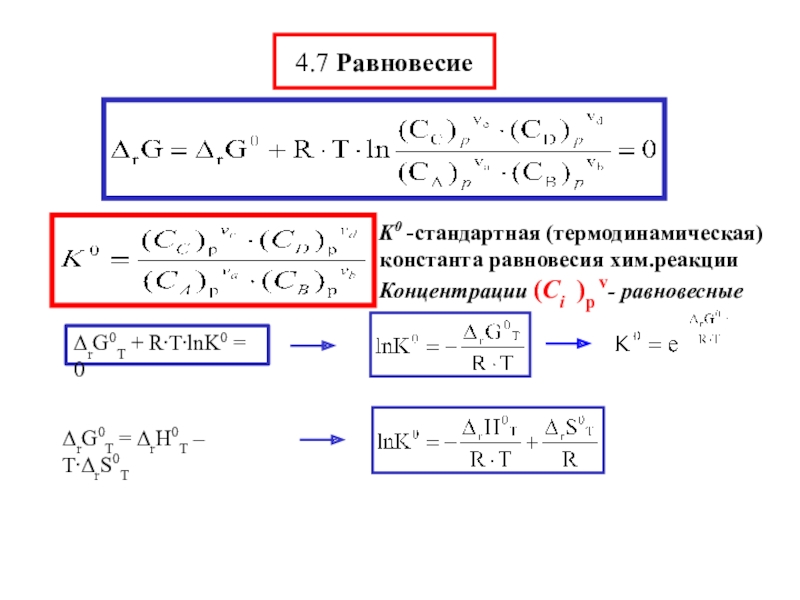
началам (законам) т/д. Всё остальное содержание т/д – есть следствие
из них. Её отличают логичность, последовательность, согласованность количественных результатов, высокая степень формализма. Законы т/д выведены для абстрактных систем и столь общи, что широко используются в физике, биологии, геологии, астрономии, математике, химии.т/д изучает
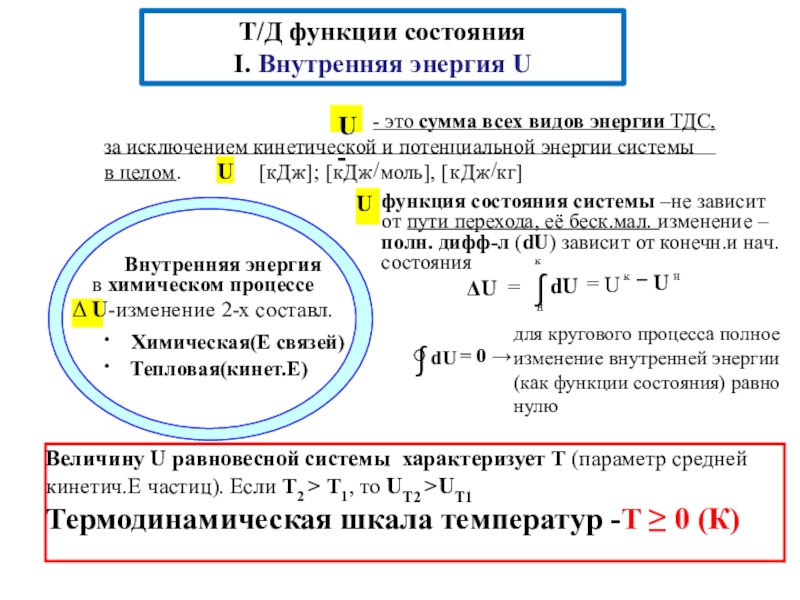
превращения (переходы) энергии из одной формы в другую, от одной части системы к другой
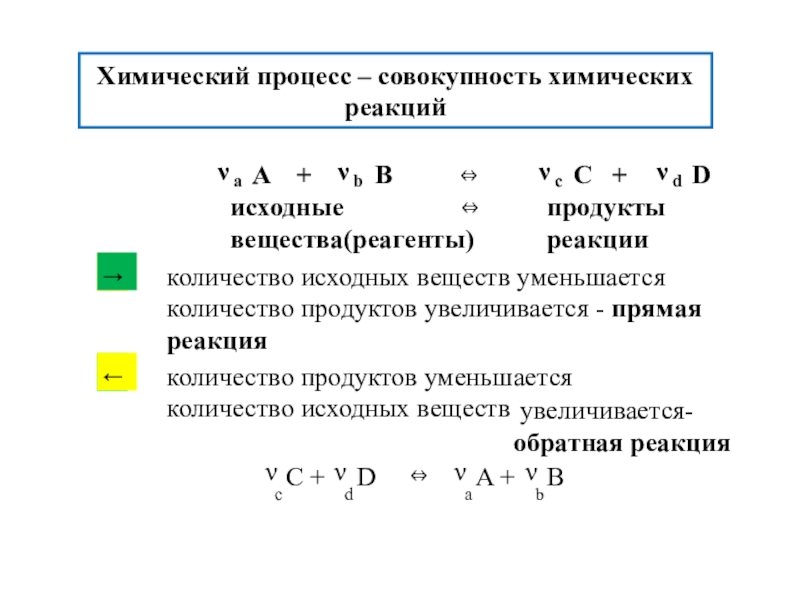
Химическая термодинамика - термодинамика хим. процессов.
Описывает статистически значимые процессы (большое число частиц или случаев)
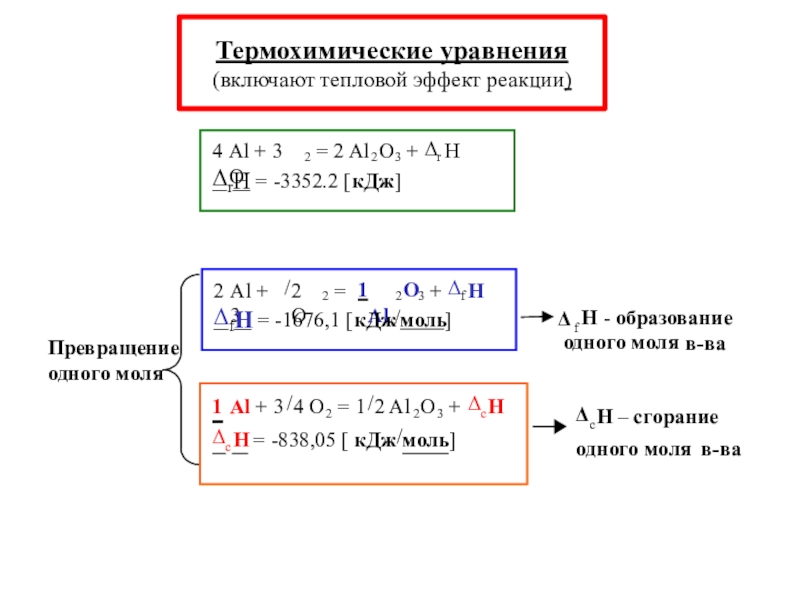
энергетические эффекты, сопровождающие физические и химические процессы
возможность, направления и предел самопроизвольного протекания процессов.


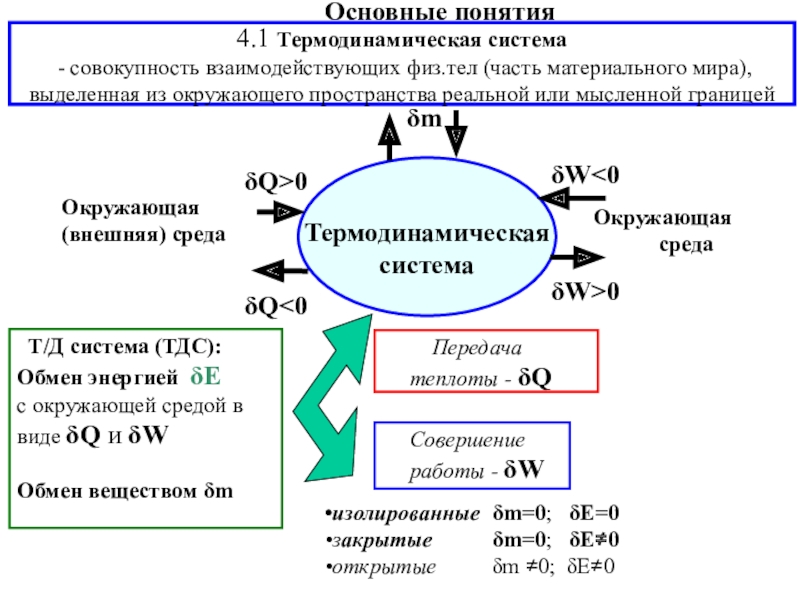
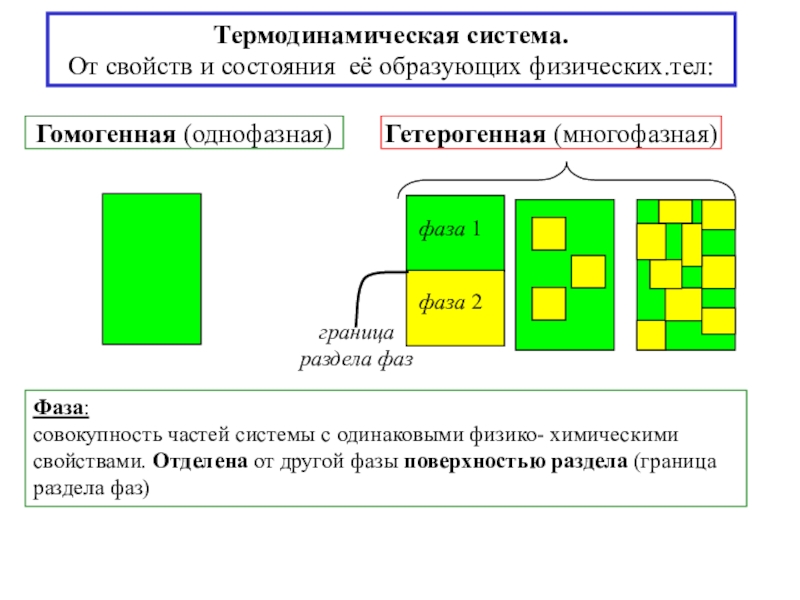
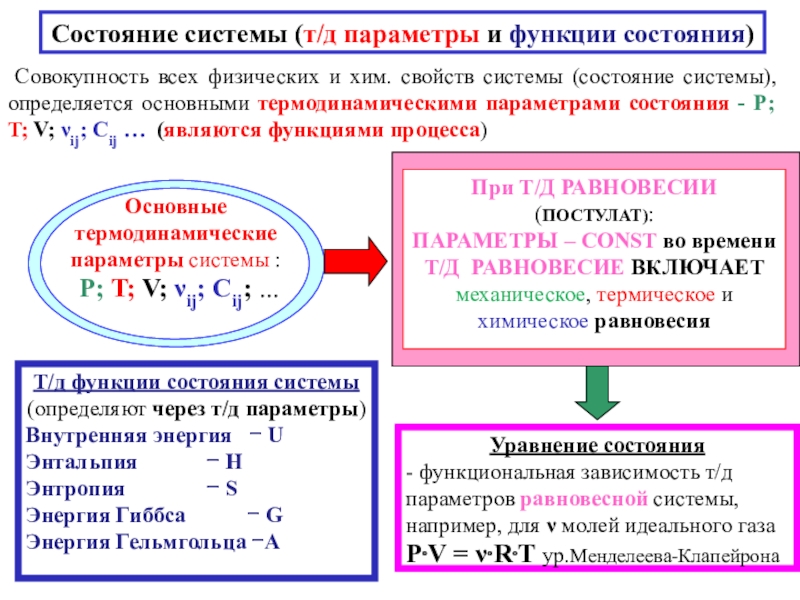
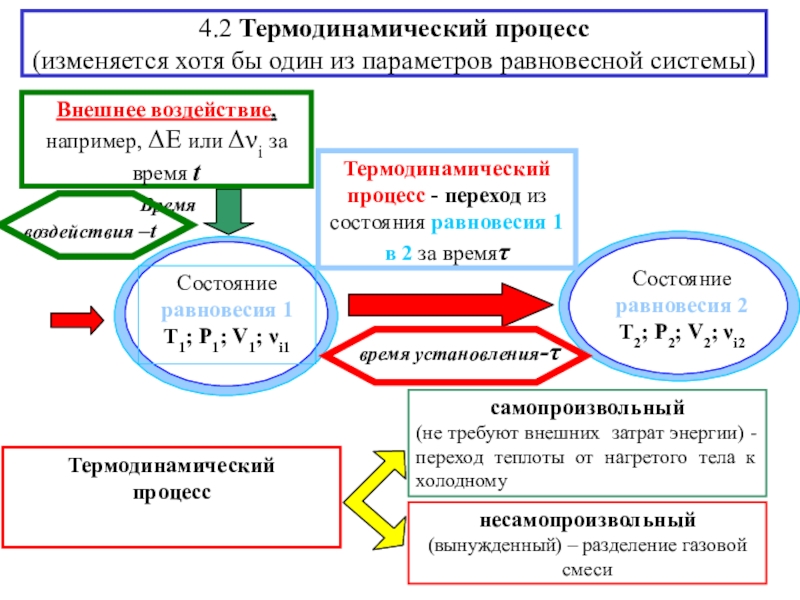
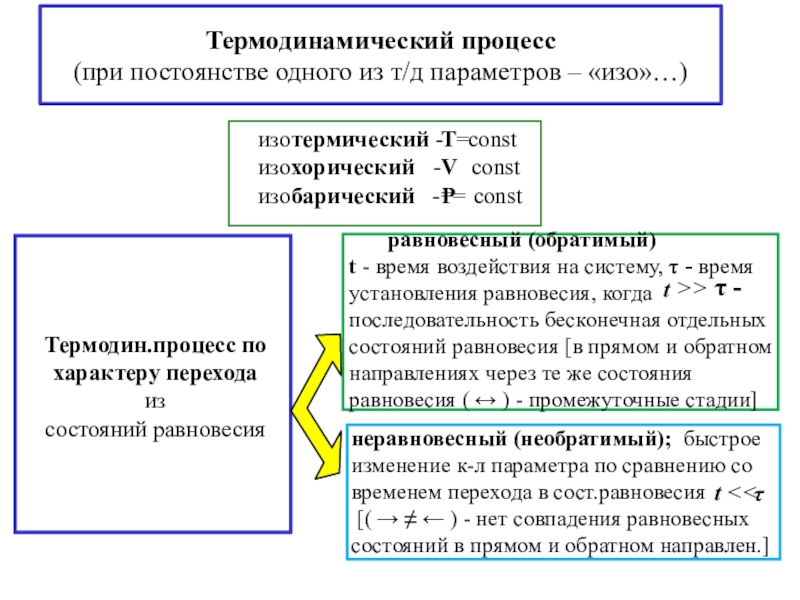







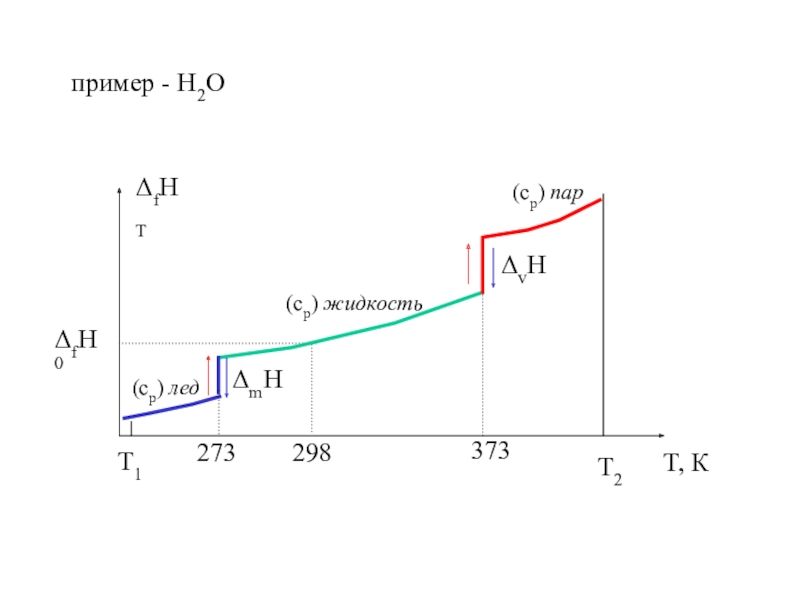




![4-ТЕРМОДИНАМИКА S [ДжК] стандартная - S0298 [ДжмольК] Факторы влияющие на величину энтропии S [ДжК] стандартная - S0298 [ДжмольК] Факторы влияющие на величину](/img/tmb/7/600310/a5c60b597fed693c8c792122021a737c-800x.jpg)