Слайд 15. Концепции классической химии и биологии.
5.1. Учение о составе
вещества.
5.2. Концепция структуры веществ.
5.3.Периодический закон Менделеева.
5.4. Натуралистический этап развития
биологии.
5.5. Теория эволюции в биологии.
5.6. Молекулярно - генетический этап
развития биологии.
Слайд 25.1. Учение о составе вещества
Химия – наука о превращениях веществ,
с изменением их состава или строения.
Основная цель – это
получение веществ с заданными свойствами.
Д.И.Менделеев: «Химия в значительной мере сама создает свой объект изучения».
Роберт Бойль, английский физик и химик (1627 – 1691 г.) - анализ состава тел.
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
Молекула – микрочастица, образованная из атомов, и способная к самостоятельному существованию.
Слайд 3Основные законы:
Закон Ломоносова: массы начальных и конечных веществ, участвующих в
реакции, одинаковы.
Закон Пруста: любое чистое вещество имеет всегда один
и тот же состав.
Законы Дальтона:
а) количества вещества элементов в химических соединениях относятся между собой, как целые числа (АВ, АВ2,…)
б) любое химическое соединение имеет неизменное соотношение компонентов.
Закон Авогадро: при одинаковых давлении и температуре в одном и том же объеме любого газа содержится одинаковое количество молекул.
Слайд 45. Закон сохранения энергии: количество тепловой энергии, принесенной в зону
взаимодействия веществ, равно количеству энергии, вынесенной веществами из этой зоны.
Экзотермические – реакции, идущие с выделением тепла;
Эндотермические – реакции, идущие с поглощением тепла.
Qвнеш - теплота, введенная в процесс извне,
Qэкзотерм - теплота, выделившаяся при
экзотермической реакции,
Qпотерь - потери теплоты в окружающую среду.
Слайд 55.2. Концепция структуры веществ
Структура – это устойчивая пространственная и энергетическая
упорядоченность молекулы.
Йенс Берцелиус, шведский химик (1779 – 1848 г.):
точное измерение атомных весов элементов;
символика
химических элементов, формулы химических соединений и уравнений;
исследования в области электрохимии;
введение понятия «органическая химия» - наука, изучающая соединения углерода с другими элементами.
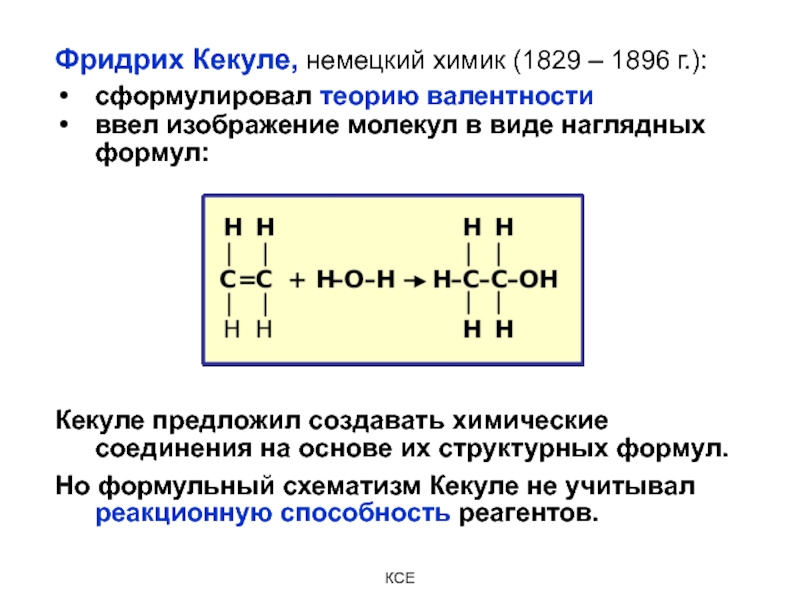
Слайд 6Фридрих Кекуле, немецкий химик (1829 – 1896 г.):
сформулировал теорию валентности
ввел
изображение молекул в виде наглядных формул:
Кекуле предложил создавать химические соединения
на основе их структурных формул.
Но формульный схематизм Кекуле не учитывал реакционную способность реагентов.
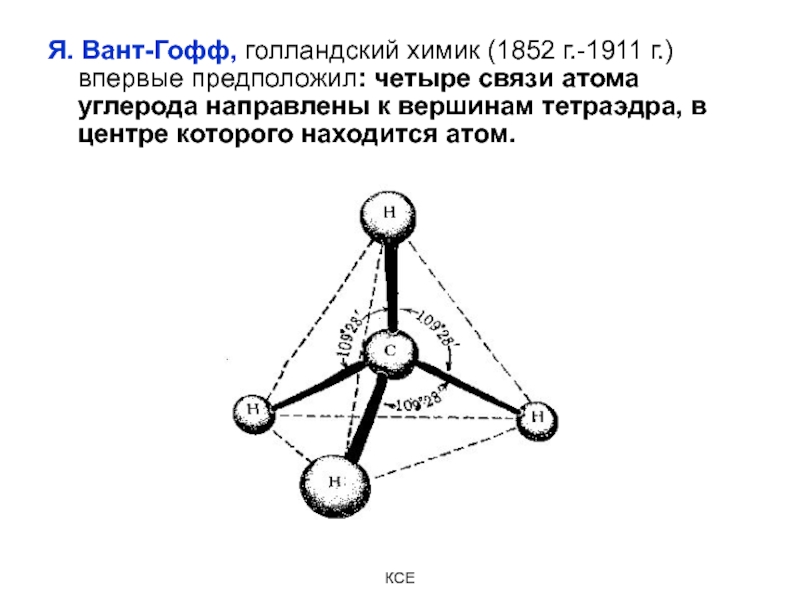
Слайд 7Я. Вант-Гофф, голландский химик (1852 г.-1911 г.) впервые предположил: четыре
связи атома углерода направлены к вершинам тетраэдра, в центре которого
находится атом.
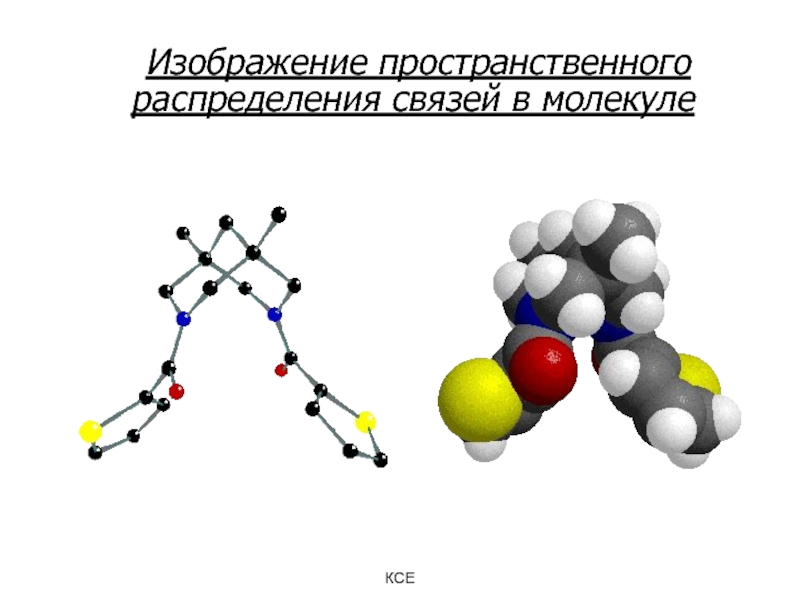
Слайд 8 Изображение пространственного распределения связей в молекуле
Слайд 9Теория А.М.Бутлерова (1861 г.):
Химические и физические свойства соединений зависят как
от природы и числа входящих в их состав атомов, так
и от структуры и конфигурации молекул.
В молекулах существует взаимное влияние как связанных, так и непосредственно не связанных друг с другом атомов.
Для каждой формулы можно вывести определенное число теоретически возможных структур (изомеров).
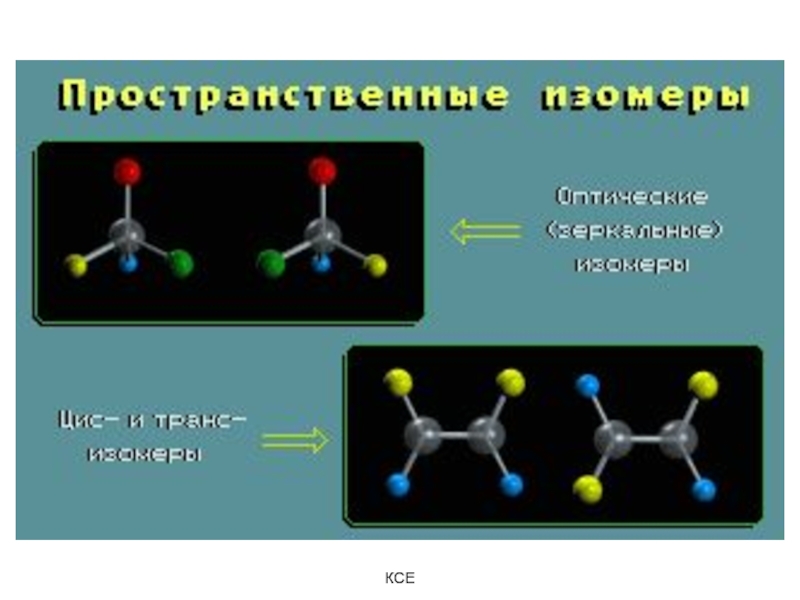
Слайд 10Изомеры – химические соединения, одинаковые по молярной массе и составу,
но различающиеся расположением атомов в пространстве.
1. Структурные изомеры -
молекулы, отличающиеся порядком связей атомов, т.е. химическим строением.
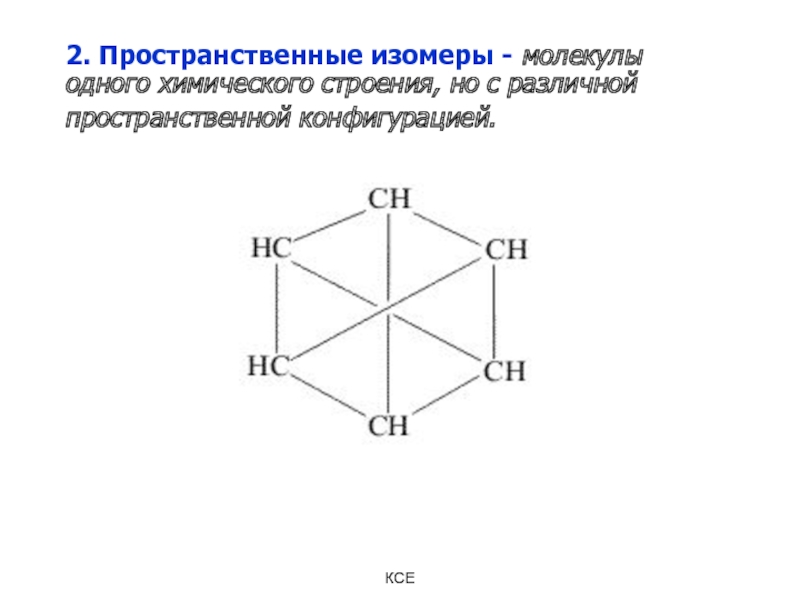
Слайд 112. Пространственные изомеры - молекулы одного химического строения, но с
различной пространственной конфигурацией.
Слайд 135.3. Периодический закон Менделеева.
Формулировка Менделеева (1869 г.): Свойства простых тел,
а также формы и свойства соединений находятся в периодической зависимости
от атомных весов элементов. (67 элементов).
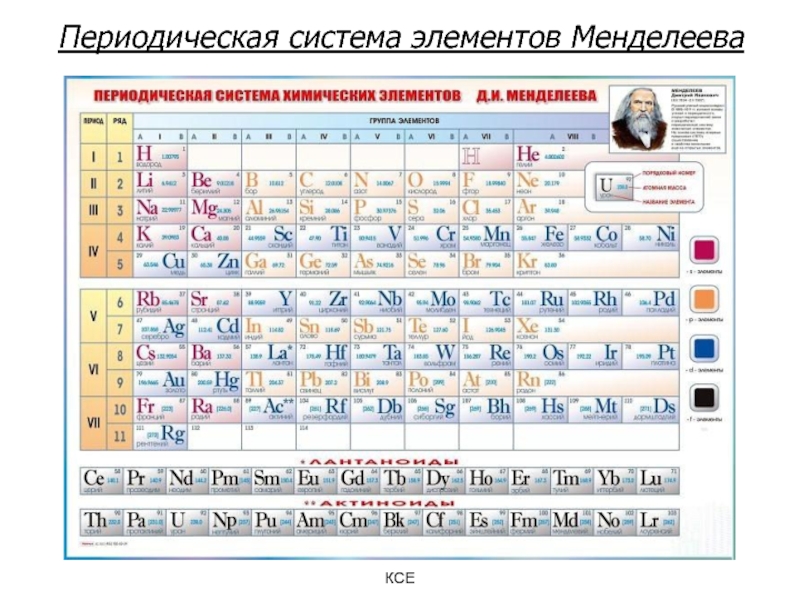
Современная формулировка: строение и свойства химических элементов находятся в периодической зависимости от зарядов атомных ядер элементов и определяются периодически повторяющимися электронными конфигурациями их атомов.
Известно 117 элементов, в природе обнаружено 89.
Слайд 14Периодическая система элементов Менделеева
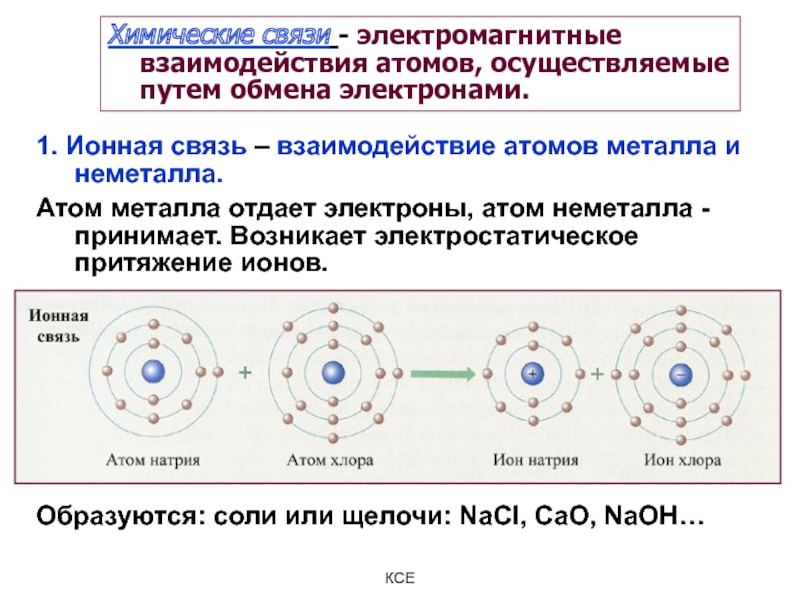
Слайд 15Химические связи - электромагнитные взаимодействия атомов, осуществляемые путем обмена электронами.
1.
Ионная связь – взаимодействие атомов металла и неметалла.
Атом металла
отдает электроны, атом неметалла - принимает. Возникает электростатическое притяжение ионов.
Образуются: соли или щелочи: NaCl, CaO, NaOH…
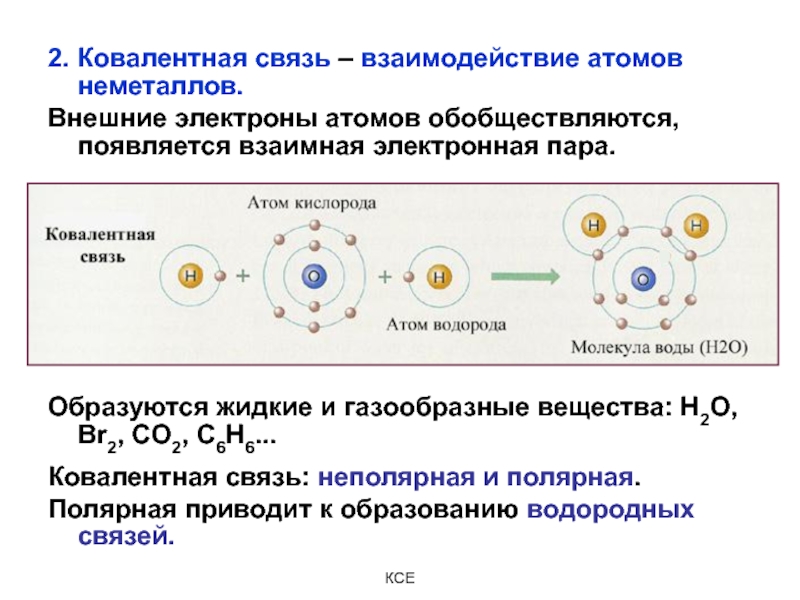
Слайд 162. Ковалентная связь – взаимодействие атомов неметаллов.
Внешние электроны атомов
обобществляются, появляется взаимная электронная пара.
Образуются жидкие и газообразные вещества:
Н2О, Br2, CO2, C6H6...
Ковалентная связь: неполярная и полярная.
Полярная приводит к образованию водородных связей.
Слайд 173. Металлическая связь.
Каждый атом отдает один или два внешних электрона.
Образуется атомная решетка, внутри которой находятся свободные электроны.
Слайд 18Основные направления современной структурной химии
- создание кристаллов с максимальным приближением
к идеальной решетке для получения материалов с высокими техническими показателями:
максимальной прочностью, термической стойкостью и др.;
- создание кристаллов с запрограммированными дефектами решетки для производства материалов с заданными электрическими, магнитными и другими свойствами.
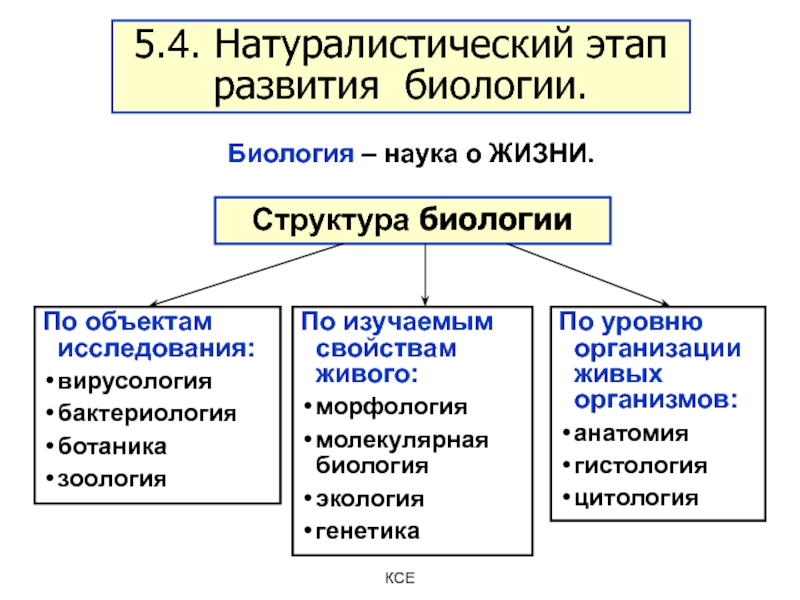
Слайд 19Структура биологии
По изучаемым свойствам живого:
морфология
молекулярная биология
экология
генетика
По уровню организации живых организмов:
анатомия
гистология
цитология
По
объектам исследования:
вирусология
бактериология
ботаника
зоология
5.4. Натуралистический этап развития биологии.
Биология – наука о ЖИЗНИ.
Слайд 20Первые попытки классификации – Аристотель.
Карл Линней, шведский биолог-натуралист (1707 –
1778 г.) - основоположник общепринятой системы классификации.
В систему классификации
входят:
Царство (5 царств)
Тип (отдел - у растений)
Класс (4 класса)
Отряд (порядок – у растений)
Семейство
Род
Вид (особи, способные к
скрещиванию между собой).
Классификация Линнея
Слайд 215.5. Теория эволюции в биологии.
Жан Ламарк, французский биолог (1744 –
1829 г.) – основоположник эволюционной теории.
Две основные причины эволюции:
Стремление
живой природы к совершенствованию своей организации, заложенное Творцом.
Изменение видов под влиянием внешней среды. Эти изменения передаются по наследству.
Слайд 22Чарльз Дарвин, английский ученый, (1809-1882 г.) – создатель теории эволюции
«Происхождение
видов путем естественного отбора» (1859 г.)
Слайд 23Теория Дарвина
В пределах каждого вида существует индивидуальная наследственная изменчивость:
- определенная изменчивость: способность особей одинаковым образом реагировать на изменения
внешних условий;
- неопределенная изменчивость (мутация), не связанная с изменениям внешних условий.
Живые организмы размножаются в геометрической прогрессии.
Борьба за существование: борьба особи за жизнь и борьба за успех в размножении.
Естественный отбор: выживают и дают потомство наиболее приспособленные особи.
Естественный отбор особей в разных условиях ведет к расхождению их признаков и к видообразованию.
Слайд 245.6. Молекулярно - генетический этап развития биологии.
Иоганн Мендель, австрийский
монах, естествоиспытатель, (1822 – 1884 г.) - основатель генетики.
«Опыты по
гибридизации растений», 1866 г:
… наследственность передается дискретными частицами - генами.
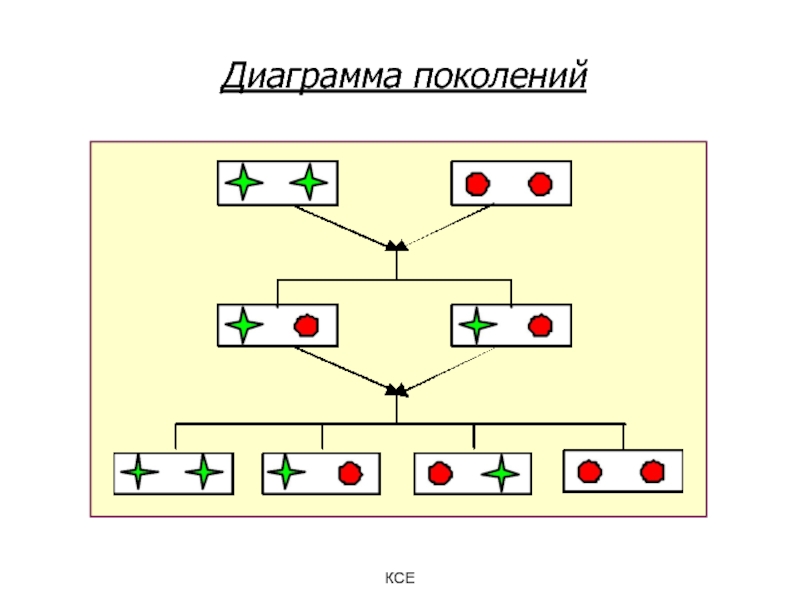
Слайд 25Законы Менделя
Закон единообразия первого поколения: при скрещивании двух особей,
различающихся по одной паре альтернативных признаков, первое поколение единообразно, в
нем проявляется только один признак.
Этот признак называется доминантным. Второй признак называемый рецессивным, в первом поколении подавляется.
Закон расщепления: при скрещивании особей первого поколения второе поколение дает расщепление по анализируемому признаку в отношении 3 : 1.
Закон независимого комбинирования признаков: при скрещивании особей, отличающихся по двум и более парам альтернативных признаков, гены и соответствующие им признаки наследуются независимо друг от друга и комбинируются во всех возможных сочетаниях.