Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
8-лек-ТД.ppt
Содержание
- 1. 8-лек-ТД.ppt
- 2. теплота - δQ работа - δWизолированные δm=0;
- 3. Фаза:совокупность частей системы, обладающих одинаковыми физическими и химическими свойствами, имеет границыТермодинамическая система
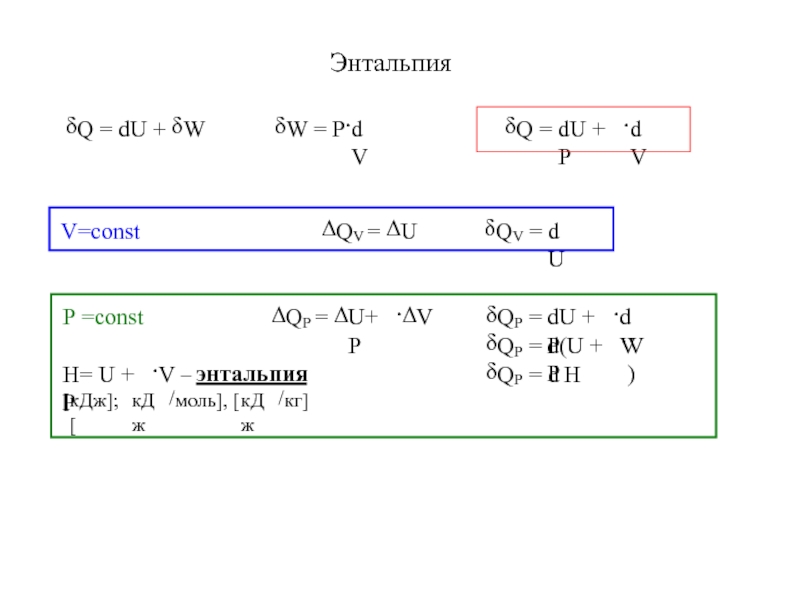
- 4. Функции состоянияВнутренняя энергия − U Энтальпия − H
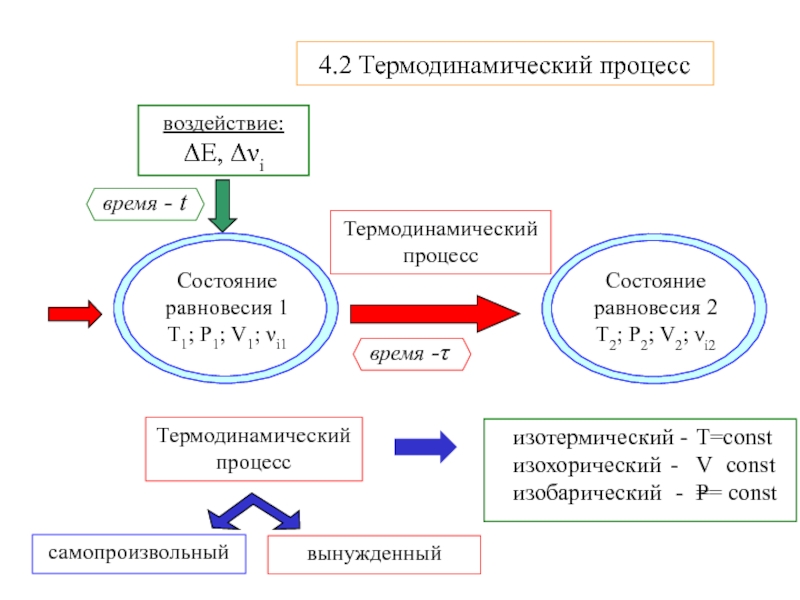
- 5. Термодинамический процесс4.2 Термодинамический процессТермодинамический процесс
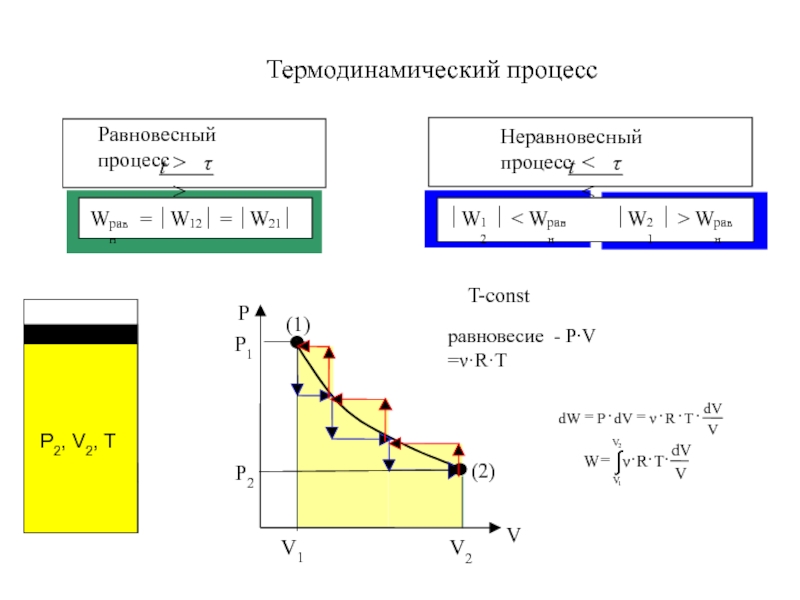
- 6. T-constТермодинамический процессравновесие - P∙V =ν·R·T
- 7. Химическая реакция
- 8. Теплота (Δ Q), сообщенная термодинамической системе, идет
- 9. если Т2 > Т1, то UТ2 >UТ1термодинамическая шкала температурТ, КВнутренняя энергия (U)[кДж]; [кДж/моль]; [кДж/кг]
- 10. Энтальпия
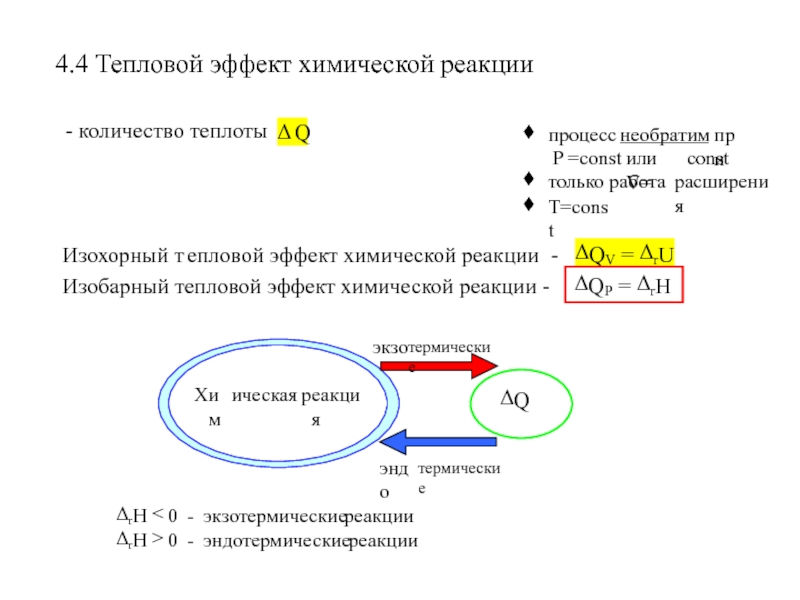
- 11. 4.4 Тепловой эффект химической реакции
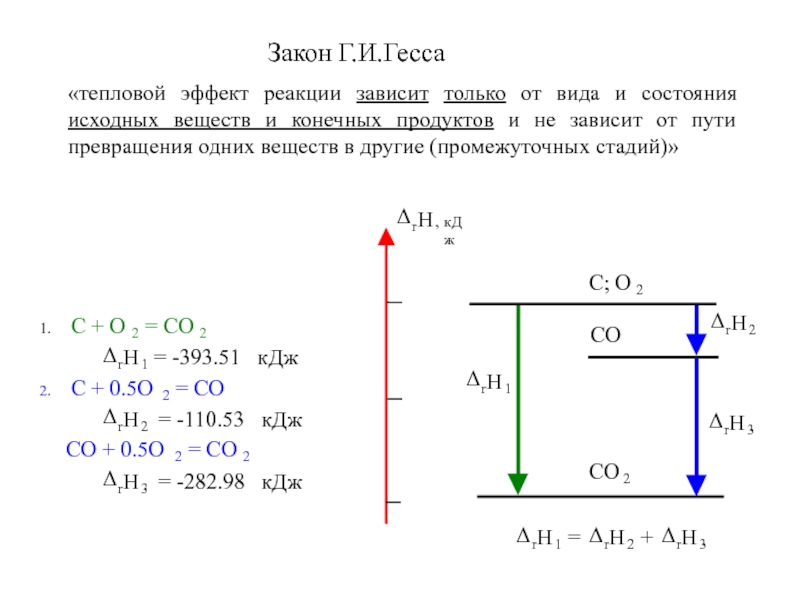
- 12. Закон Г.И.Гесса«тепловой эффект реакции зависит только от
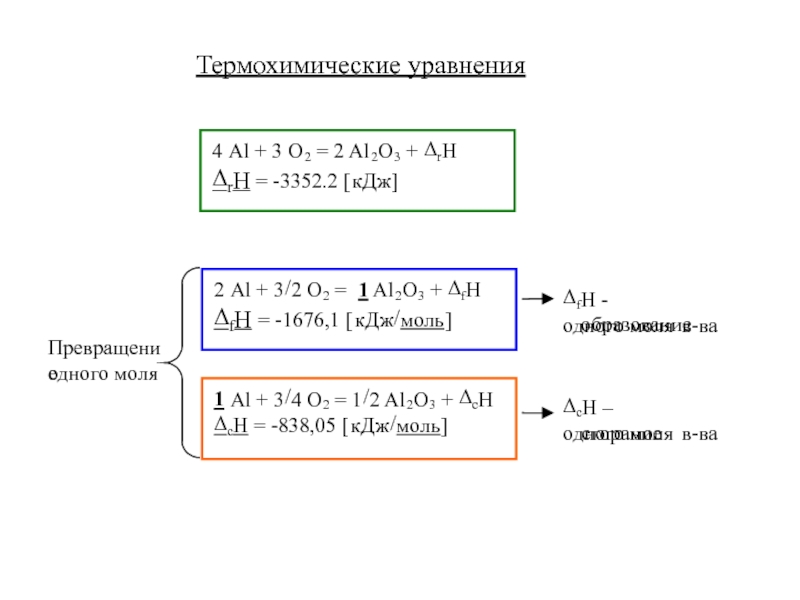
- 13. Термохимические уравнения
- 14. Стандартные условия: Р0 = 1,013⋅105 Па
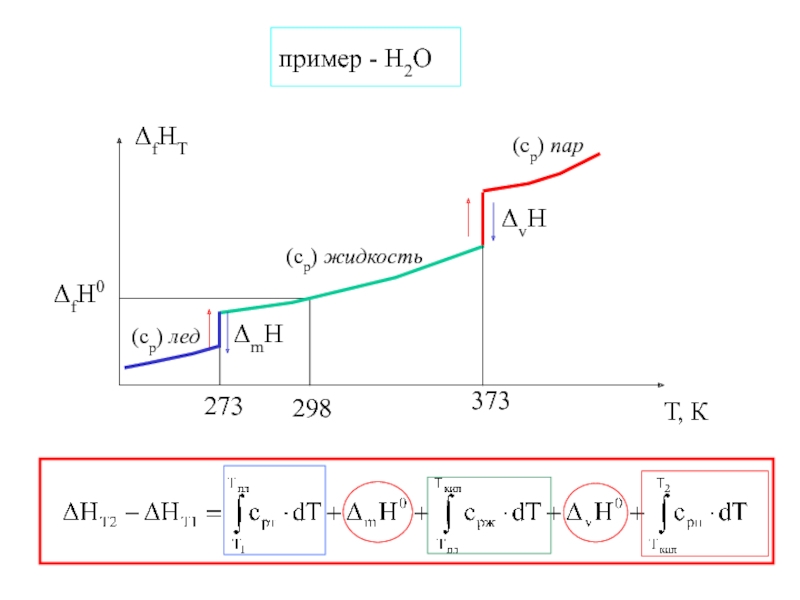
- 15. Следствие из закона Гесса:ΔrН0298 = (∑ νi⋅ΔfН0i)продукты
- 16. Зависимость энтальпии образования в-ва от температурыcp(Т) = а + b⋅Т + c⋅Т2 +…
- 17. пример - Н2О
- 18. Скачать презентанцию
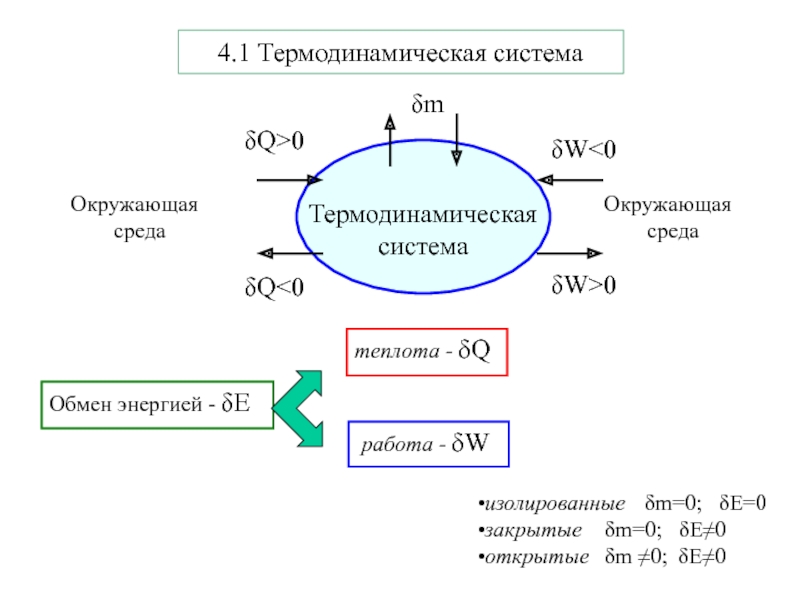
теплота - δQ работа - δWизолированные δm=0; δE=0закрытые δm=0; δE≠0открытые δm ≠0; δE≠04.1 Термодинамическая система
Слайды и текст этой презентации
Слайд 14. Термодинамика
Химическая термодинамика -
термодинамика химических процессов.
тепловой эффект химической реакции
термодинамическая
возможность протекания реакции
Слайд 2теплота - δQ
работа - δW
изолированные δm=0; δE=0
закрытые
δm=0; δE≠0
открытые δm ≠0; δE≠0
4.1 Термодинамическая система
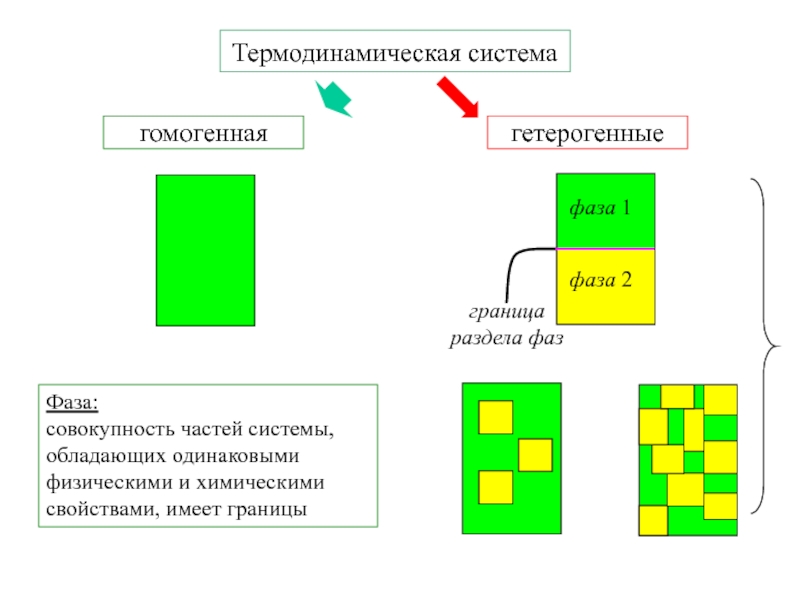
Слайд 3
Фаза:
совокупность частей системы, обладающих одинаковыми физическими и химическими свойствами, имеет
границы
Термодинамическая система
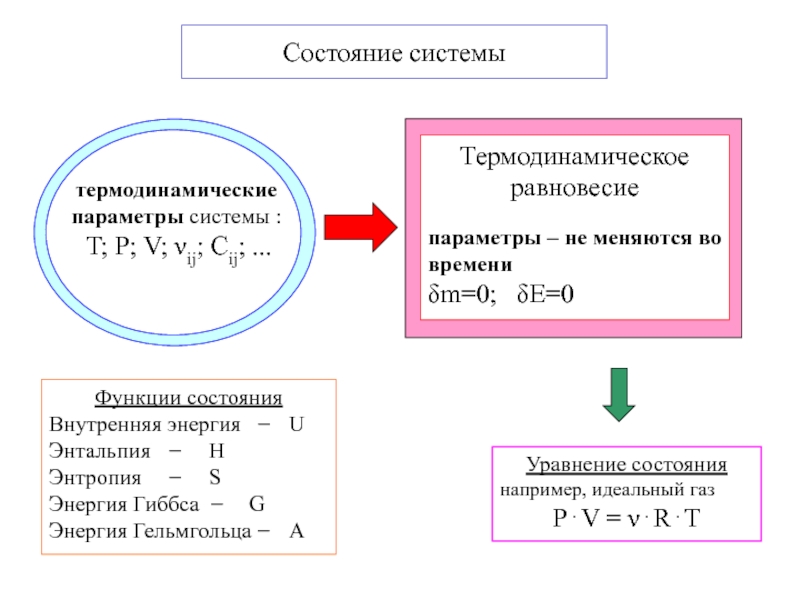
Слайд 4Функции состояния
Внутренняя энергия − U
Энтальпия − H
Энтропия − S
Энергия
Гиббса − G
Энергия Гельмгольца − A
Состояние системы
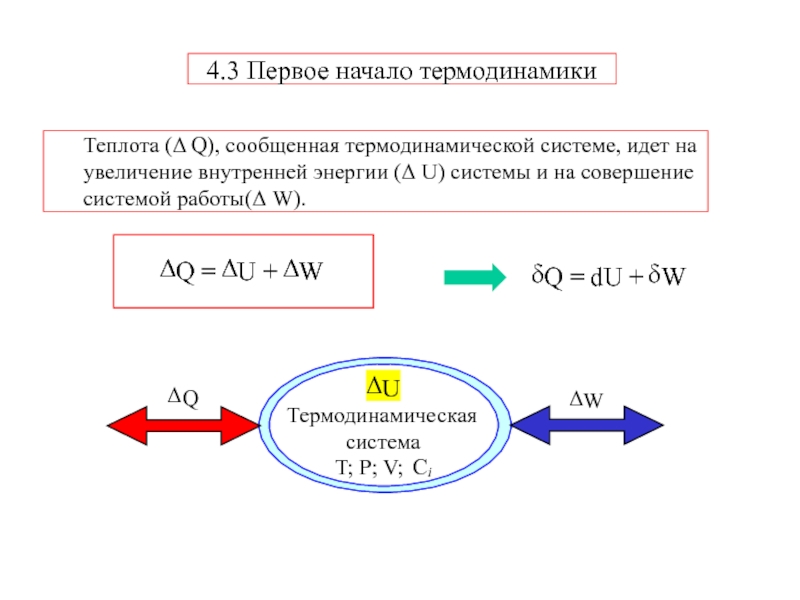
Слайд 8Теплота (Δ Q), сообщенная термодинамической системе, идет на увеличение внутренней
энергии (Δ U) системы и на совершение системой работы(Δ W).
4.3
Первое начало термодинамикиСлайд 9
если Т2 > Т1, то UТ2 >UТ1
термодинамическая шкала температур
Т, К
Внутренняя
энергия (U)
[кДж]; [кДж/моль]; [кДж/кг]
Слайд 12
Закон Г.И.Гесса
«тепловой эффект реакции зависит только от вида и состояния
исходных веществ и конечных продуктов и не зависит от пути
превращения одних веществ в другие (промежуточных стадий)»Слайд 14Стандартные условия:
Р0 = 1,013⋅105 Па
Т0 = 298,15
К
С0 = 1моль/л
ΔrН0298
Энтальпия
образования веществТермохимические расчеты
2. сложные в-ва
ΔfН0298= ΔQР кДж/моль
1/2 А2 + 1/2 В2 = АВ + ΔfН0298
Слайд 15Следствие из закона Гесса:
ΔrН0298 = (∑ νi⋅ΔfН0i)продукты – (∑ νi⋅ΔfН0i)исходные
вещества
Пример.
реакция : CH4 (газ) + CO2 (газ) = 2 CO (газ) +
2H2 (газ)ΔfН0298, кДж/моль –74,85 –393,51 –110,5 0
Расчет теплового эффекта реакции:
ΔrН0298 = [2⋅(–110,5) + 2⋅0] – [(–74,85) + (–393,51)] = 247,36 [кДж]


![8-лек-ТД.ppt если Т2 > Т1, то UТ2 >UТ1термодинамическая шкала температурТ, КВнутренняя энергия (U)[кДж]; [кДж/моль]; [кДж/кг] если Т2 > Т1, то UТ2 >UТ1термодинамическая шкала температурТ, КВнутренняя энергия (U)[кДж]; [кДж/моль]; [кДж/кг]](/img/thumbs/f47f410cbad747decdcafb9d64cfddab-800x.jpg)