Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
9-лек-ТД.ppt
Содержание
- 1. 9-лек-ТД.ppt
- 2. S = k⋅lnω k = 1,38⋅10-23Дж/К –
- 3. В изолированной системе самопроизвольно будут протекать процессы
- 4. S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии
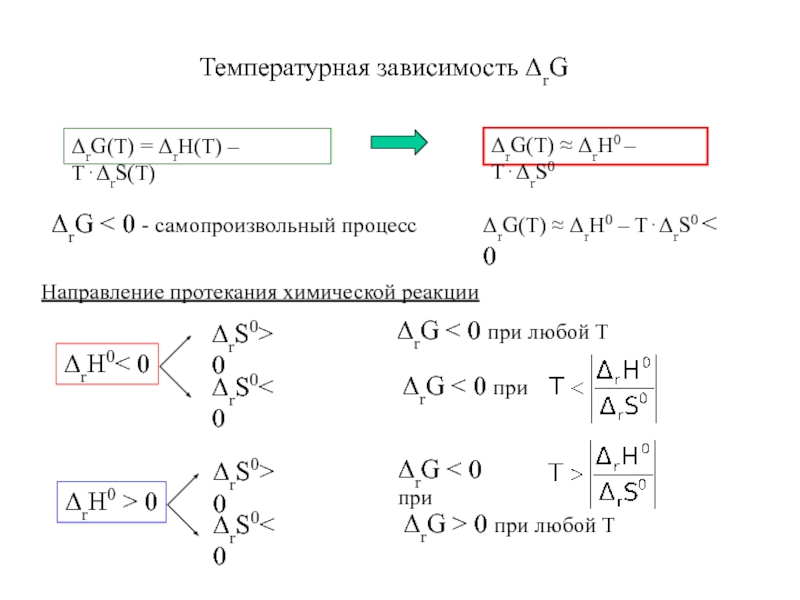
- 5. 4.6 Направление химического процесса
- 6. Энергия Гиббса реакцииЭнергии Гиббса образования в-ва ΔfG0298ΔrG0298 = (∑ νi⋅ΔfG0i)продукты – (∑ νi⋅ΔfG0i)исходные вещества
- 7. Температурная зависимость ΔrGНаправление протекания химической реакции
- 8. Энергия Гиббса реакцииС ≠С0 ΔfGi =ΔfG0i
- 9. 4.7 Равновесие
- 10. Сдвиг равновесияИзобара реакции Р-constΔrН00 – K(T) возрастающая функцияИзотерма реакции T-const
- 11. Скачать презентанцию
S = k⋅lnω k = 1,38⋅10-23Дж/К – константа Больцмана (k = R/NА)ω – термодинамическая вероятность состояния системы Энтропия
Слайды и текст этой презентации
Слайд 14.5 Второе начало термодинамики
dU + p⋅dV -T⋅dS ≤ 0
в изолированной
системе
0) равновесие - S максимальна (dS = 0)Слайд 2S = k⋅lnω
k = 1,38⋅10-23Дж/К – константа Больцмана (k
= R/NА)
ω – термодинамическая вероятность состояния системы
Энтропия
Слайд 3В изолированной системе самопроизвольно будут протекать процессы с увеличением термодинамической
вероятности, а состояние равновесия соответствует состоянию с максимальной вероятностью.
*Энтропия идеального
кристалла при 0 К равна нулю число частиц должно быть велико, статистически значимо
число частиц - конечно
Второе начало термодинамики



![9-лек-ТД.ppt S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/img/thumbs/c22b9b8e406fd3d492d73b14b87bc704-800x.jpg)