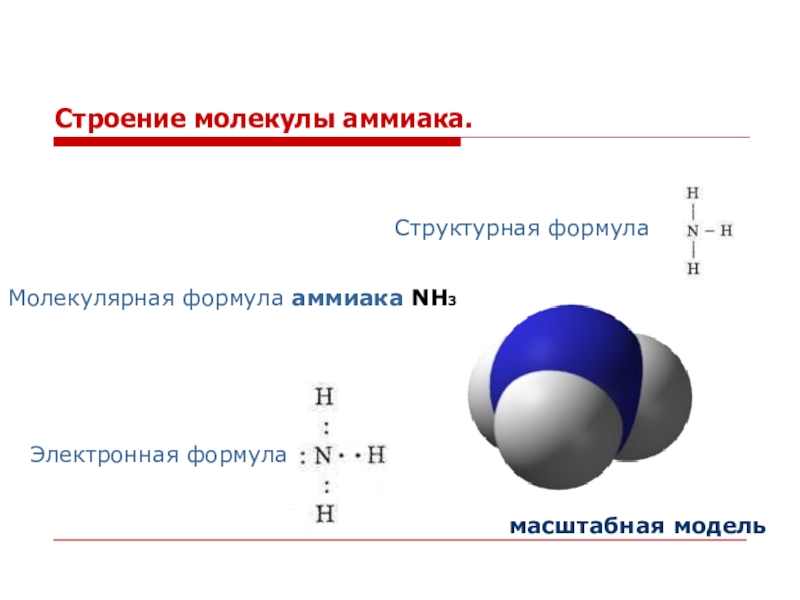
и солей аммония.
Уметь составлять уравнения реакций, отражающие свойства этих
веществ.Развивать наблюдательность, внимание, умение работать самостоятельно и в группе, умение анализировать.