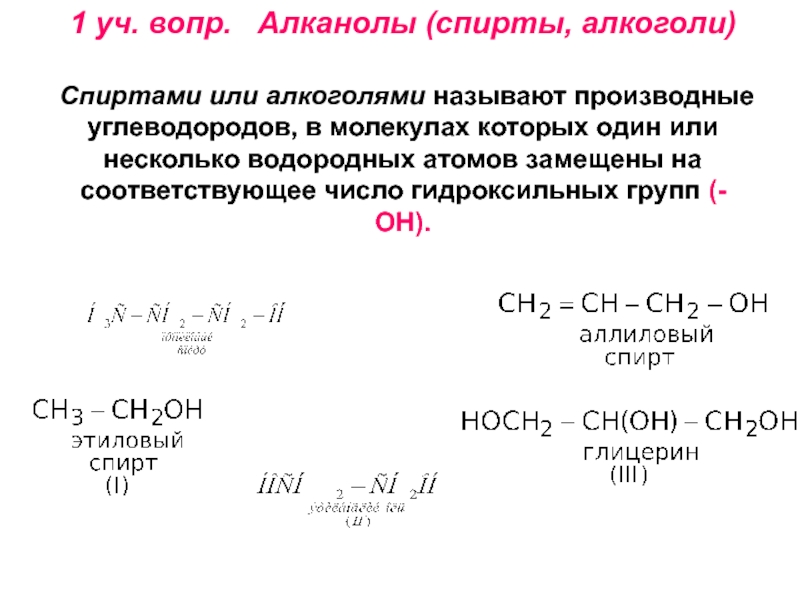
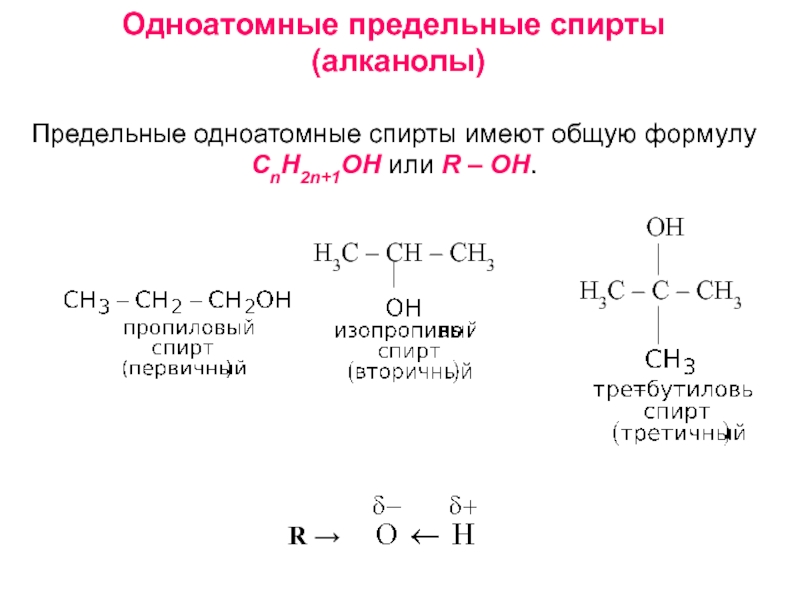
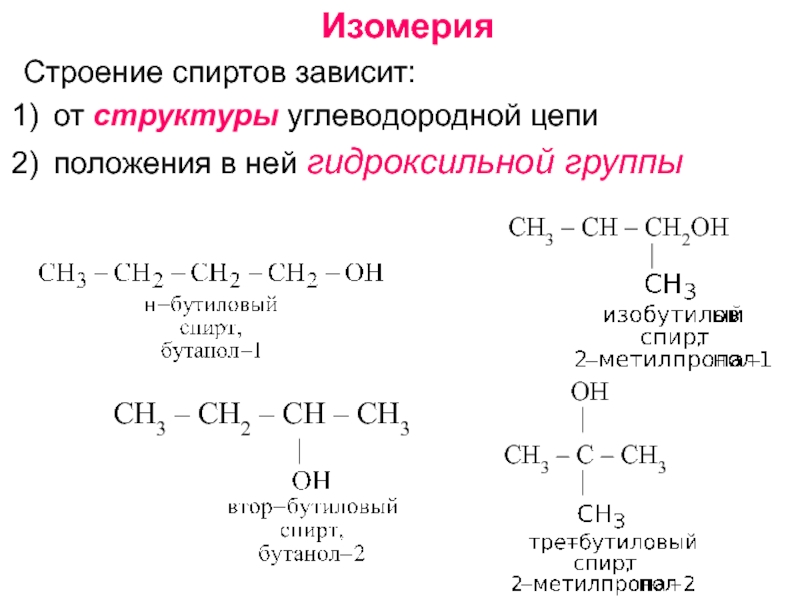
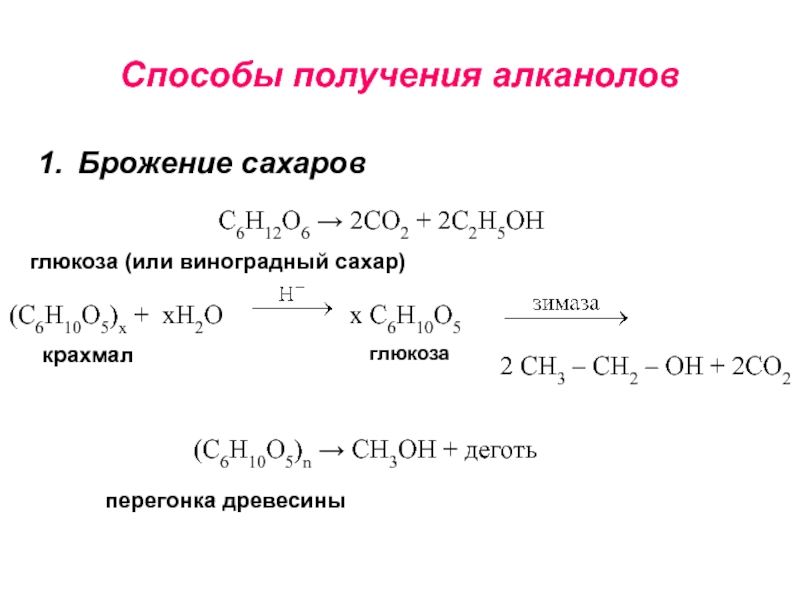
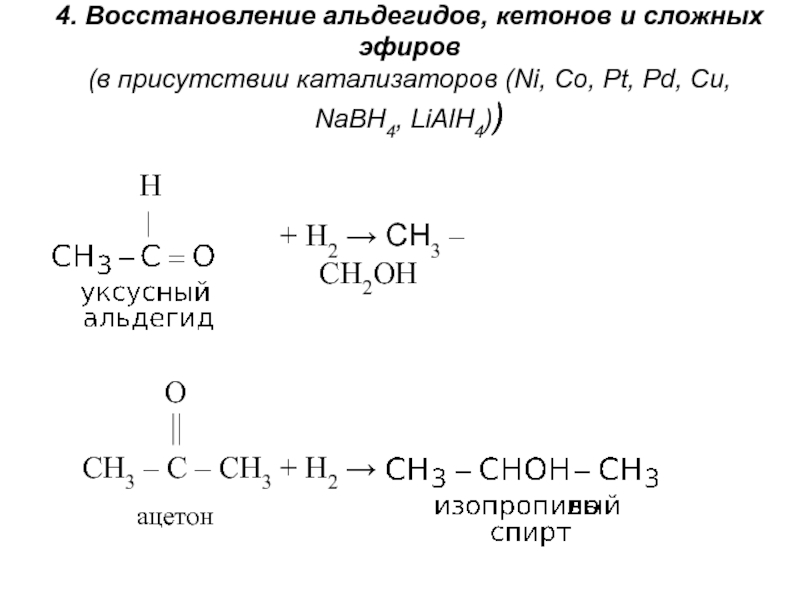
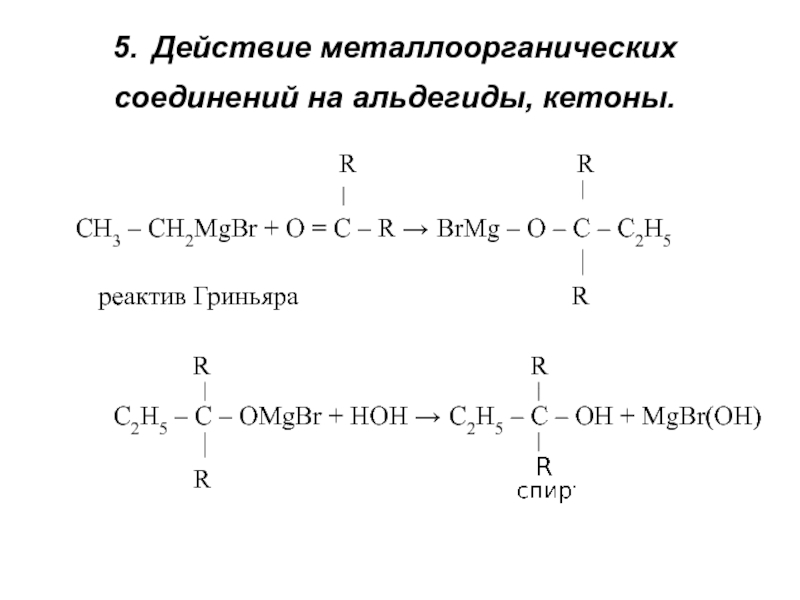
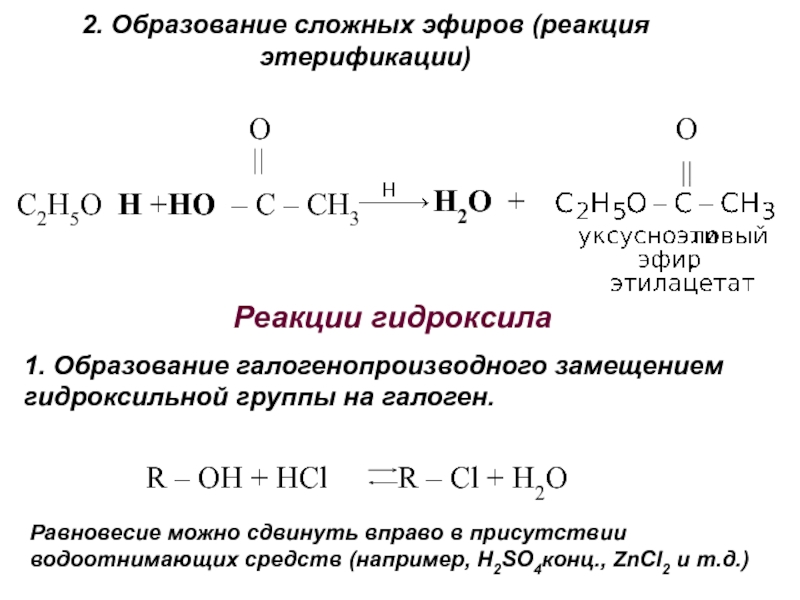
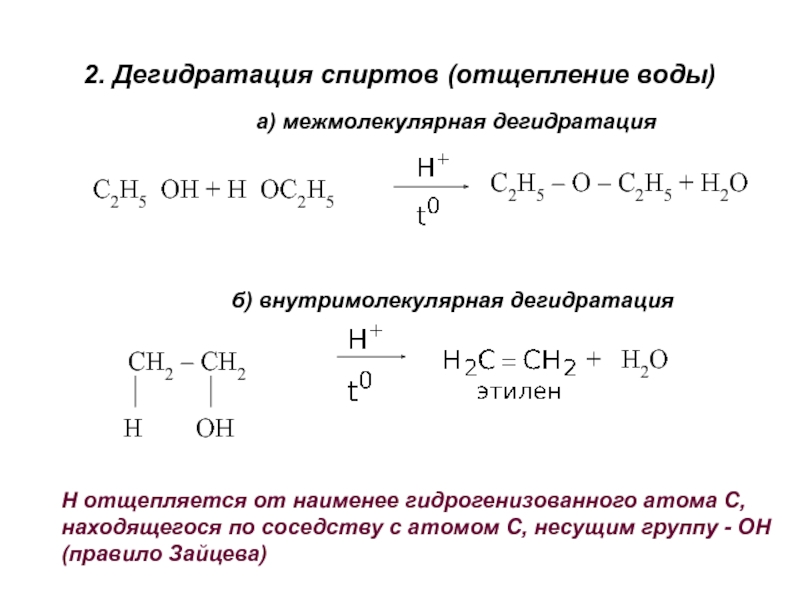
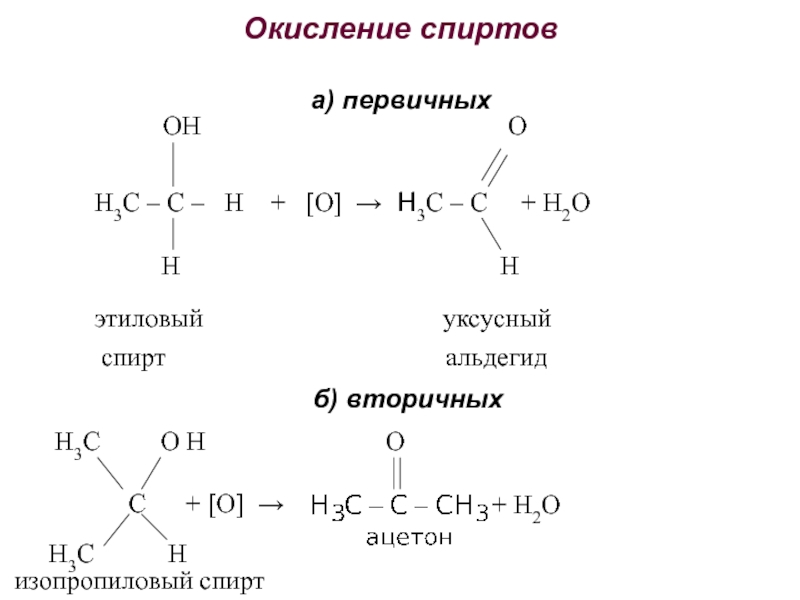
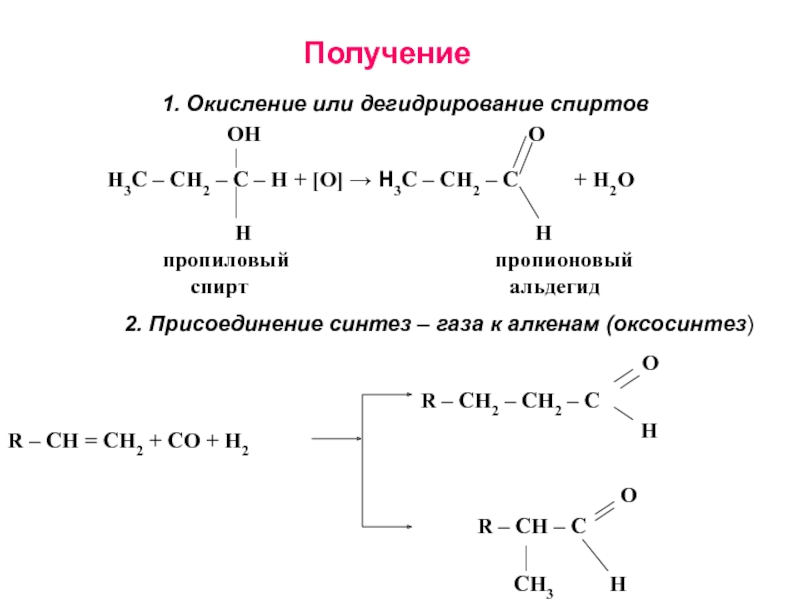
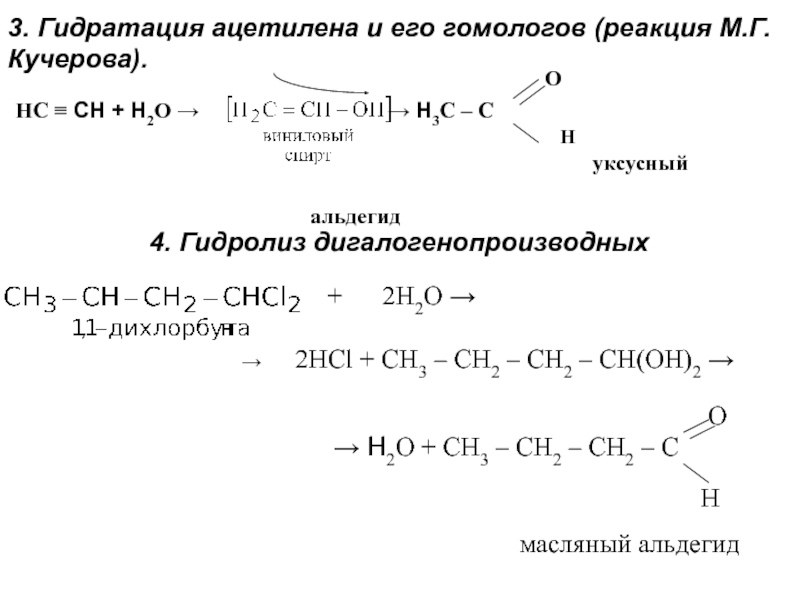
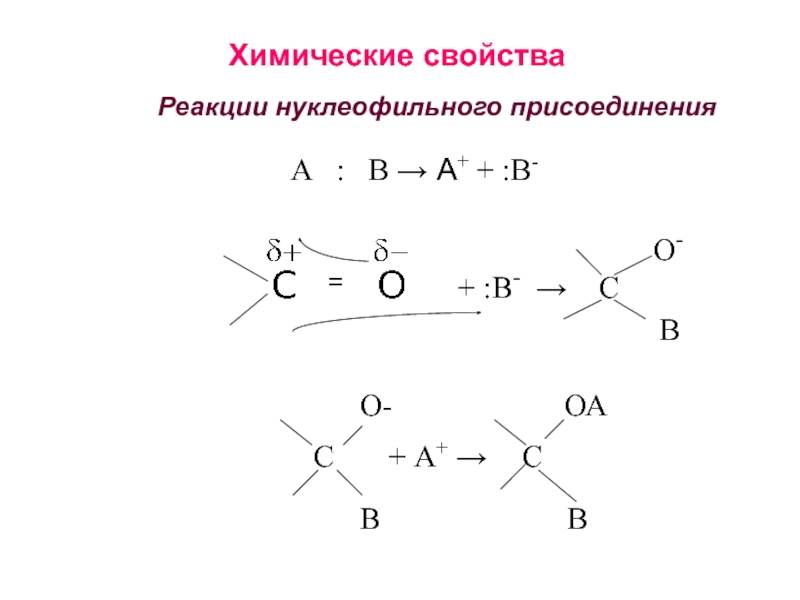
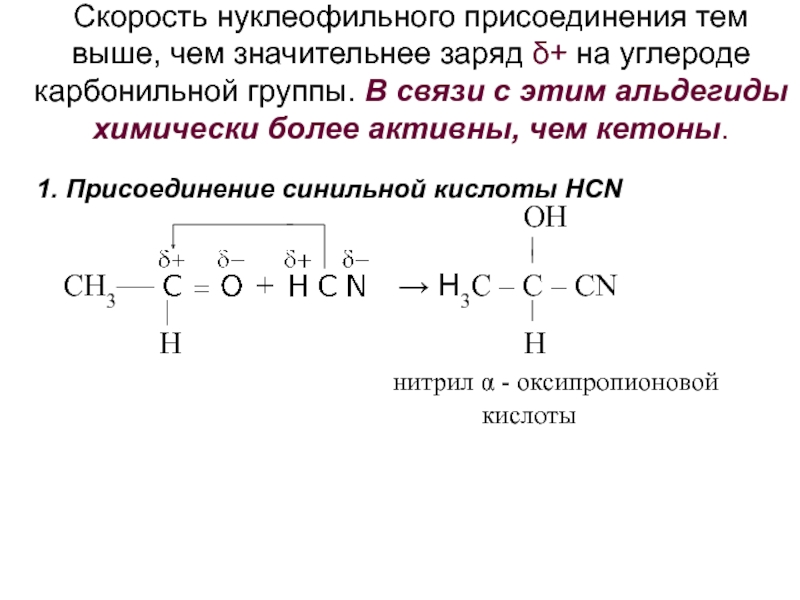
получения алканолов. Физические свойства, реакционная способность.
2. Общие сведения
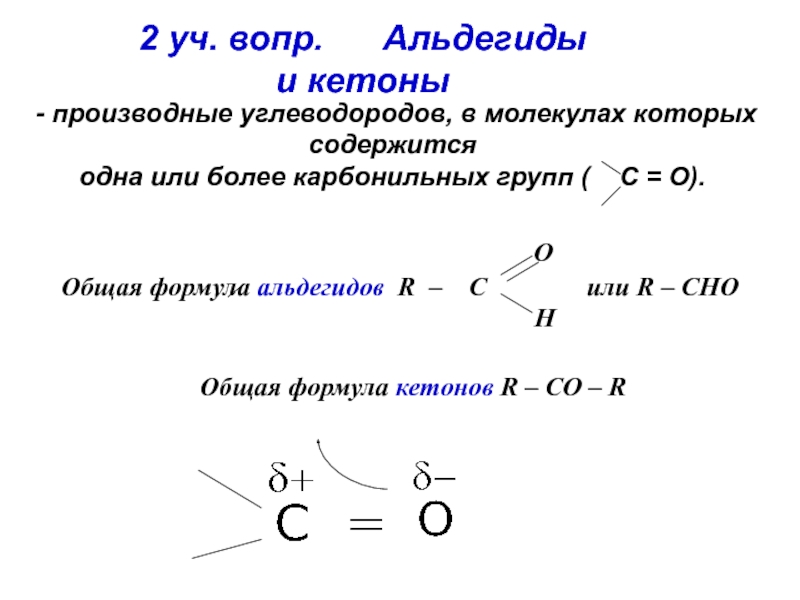
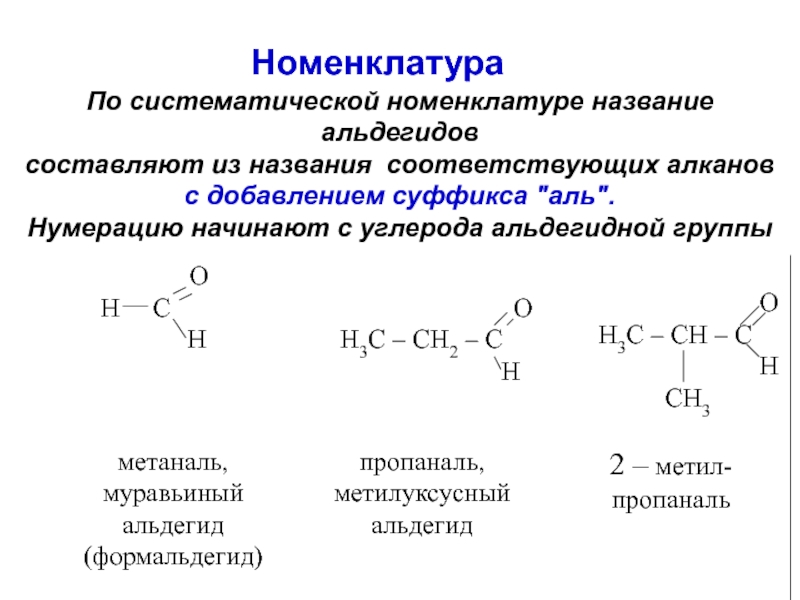
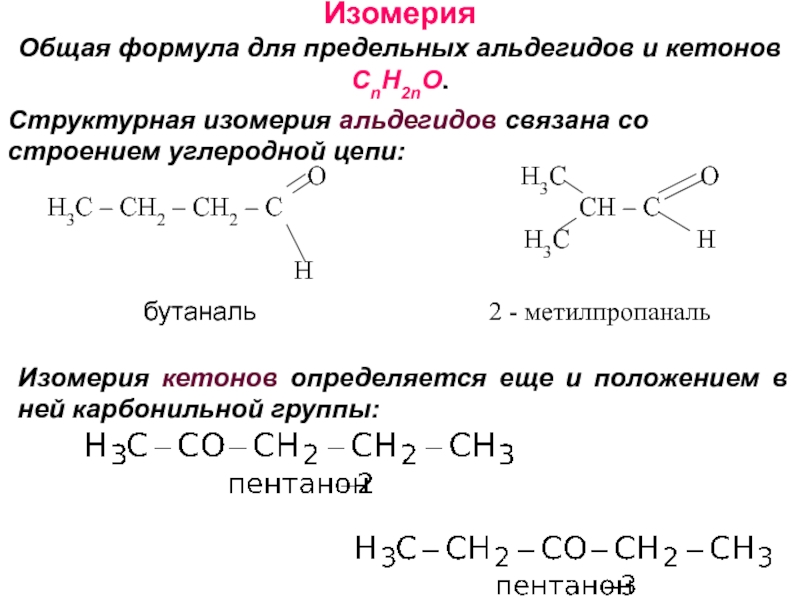
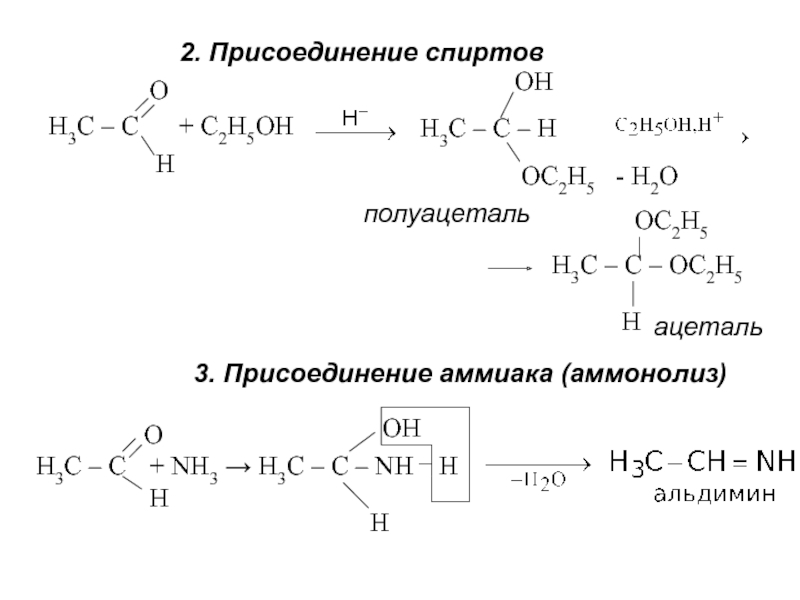
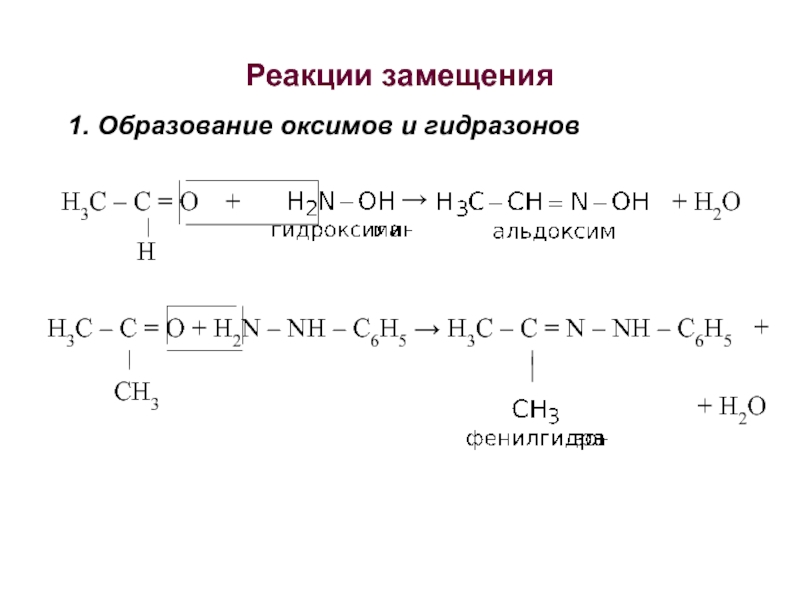
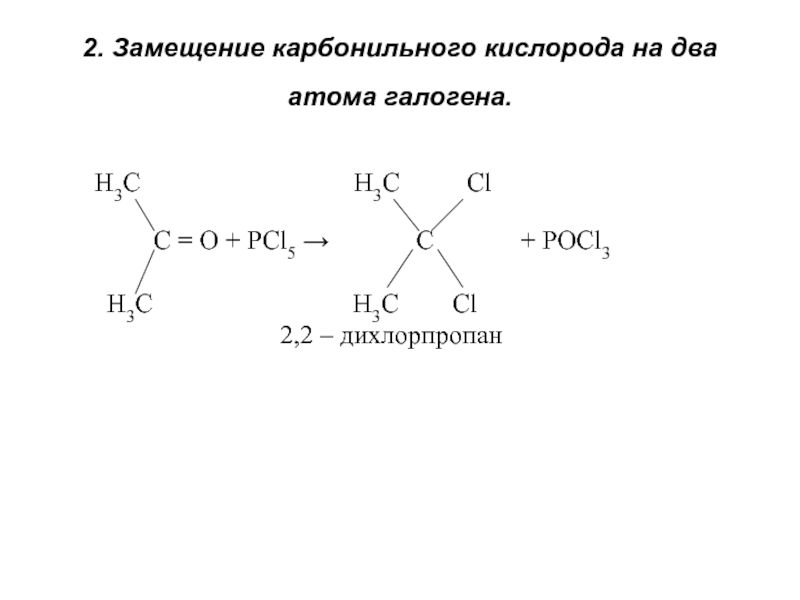
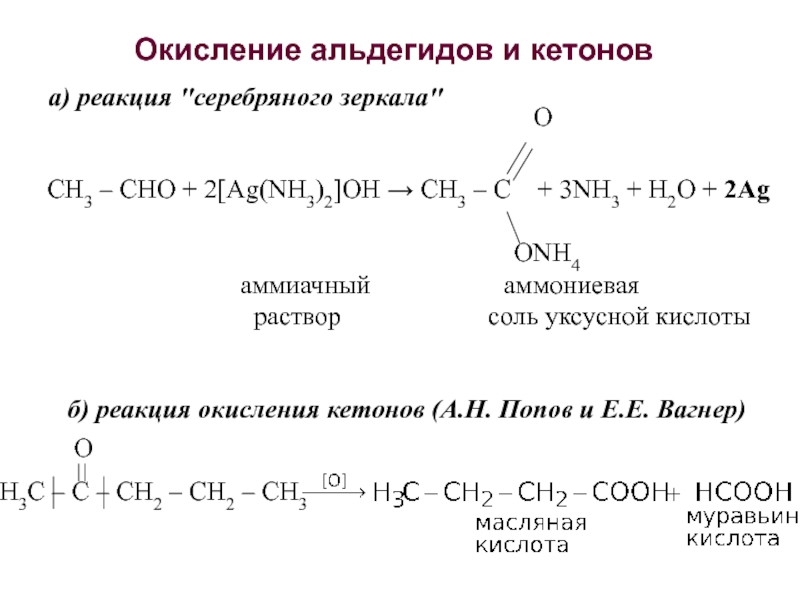
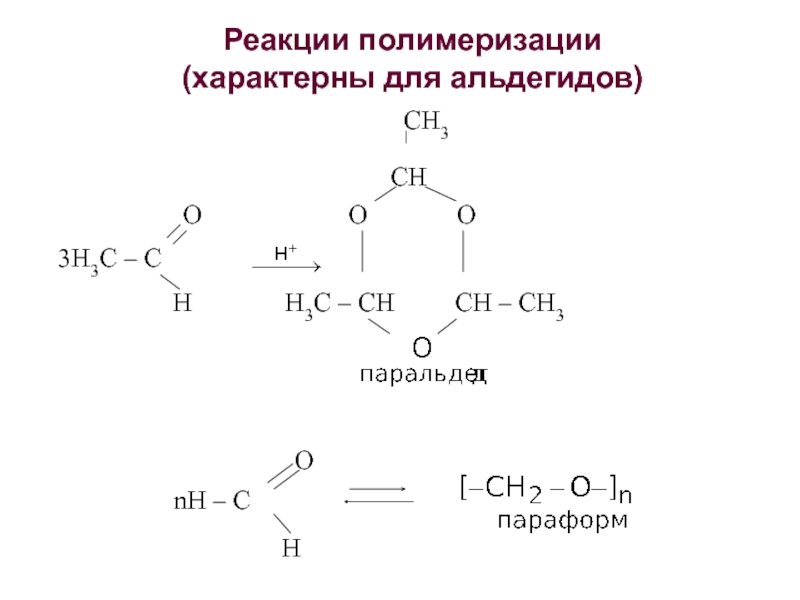
об альдегидах и кетонах. Строение карбонильной группы. Изомерия. Номенклатура. Способы получения. Химические свойства. Применение. 3. Карбоновые кислоты. Номенклатура. Изомерия. Получение. Свойства. Механизмы реакций.