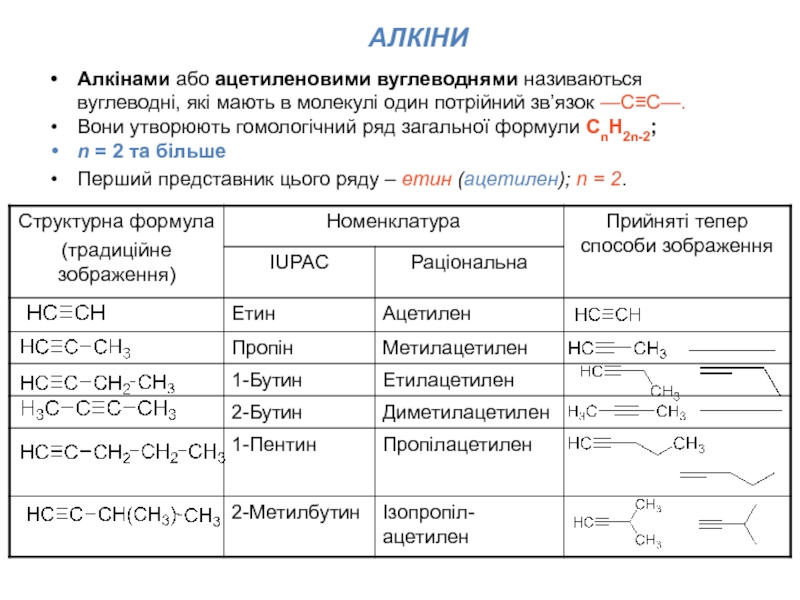
Слайд 1Алкінами або ацетиленовими вуглеводнями називаються вуглеводні, які мають в молекулі
один потрійний зв’язок —СС—.
Вони утворюють гомологічний ряд загальної формули СnН2n-2;
n = 2 та більше
Перший представник цього ряду – етин (ацетилен); n = 2.
АЛКІНИ
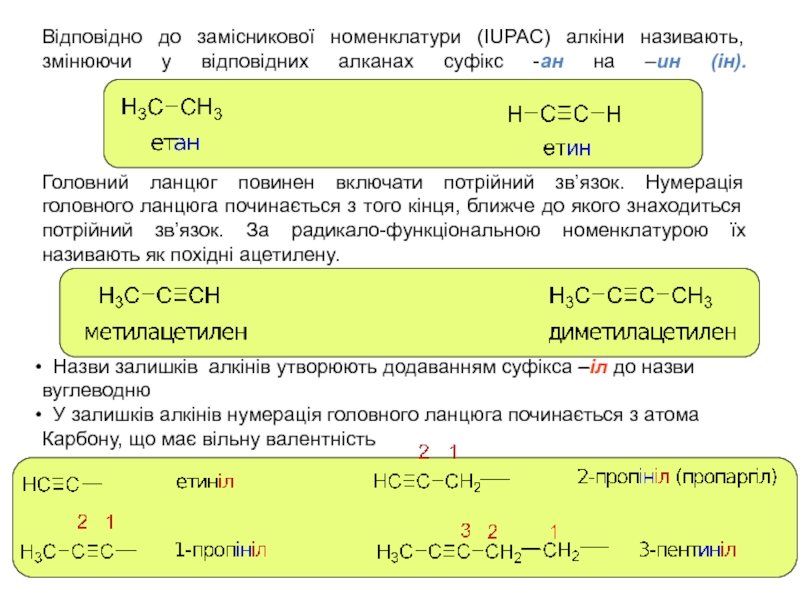
Слайд 2Відповідно до замісникової номенклатури (IUPAC) алкіни називають, змінюючи у відповідних
алканах суфікс -ан на –ин (ін).
Головний ланцюг повинен включати потрійний
зв’язок. Нумерація головного ланцюга починається з того кінця, ближче до якого знаходиться потрійний зв’язок. За радикало-функціональною номенклатурою їх називають як похідні ацетилену.
Назви залишків алкінів утворюють додаванням суфікса –іл до назви вуглеводню
У залишків алкінів нумерація головного ланцюга починається з атома Карбону, що має вільну валентність
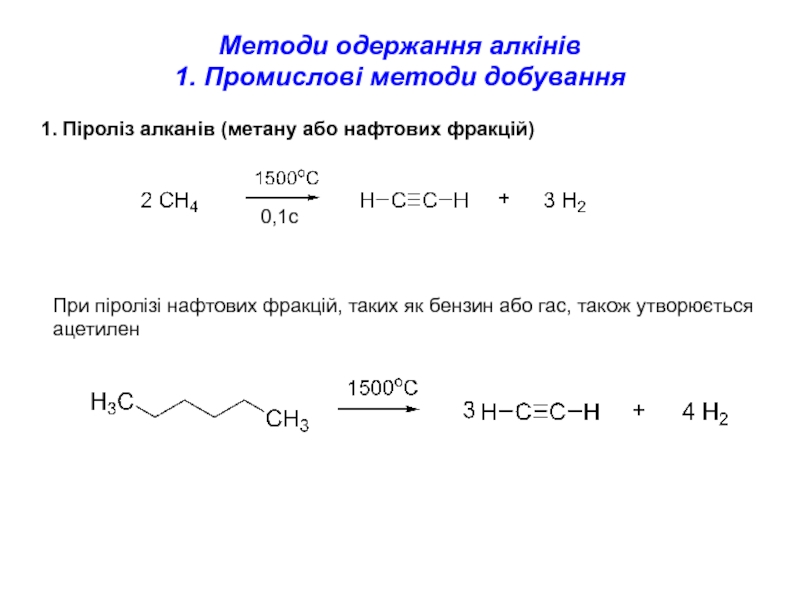
Слайд 3Методи одержання алкінів
1. Промислові методи добування
1. Піроліз алканів (метану або
нафтових фракцій)
При піролізі нафтових фракцій, таких як бензин або гас,
також утворюється ацетилен
0,1с
Слайд 42. З кальцій карбіду (карбідний метод)
При взаємодії з водою він
легко гідролізується з утворенням ацетилену:
При спіканні вапна з коксом при
2000оС, утворюється кальцій карбід (СаС2).
Магній карбід за аналогічною реакцією утворює пропін
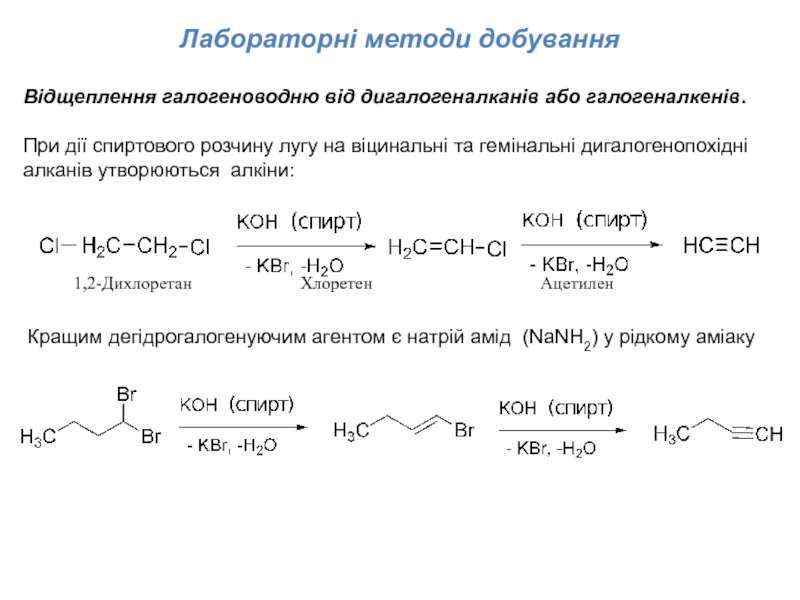
Слайд 5Лабораторні методи добування
1,2-Дихлоретан
Хлоретен
Ацетилен
Відщеплення галогеноводню від дигалогеналканів або галогеналкенів.
При дії спиртового розчину лугу на віцинальні та гемінальні дигалогенопохідні алканів утворюються алкіни:
Кращим дегідрогалогенуючим агентом є натрій амід (NaNH2) у рідкому аміаку
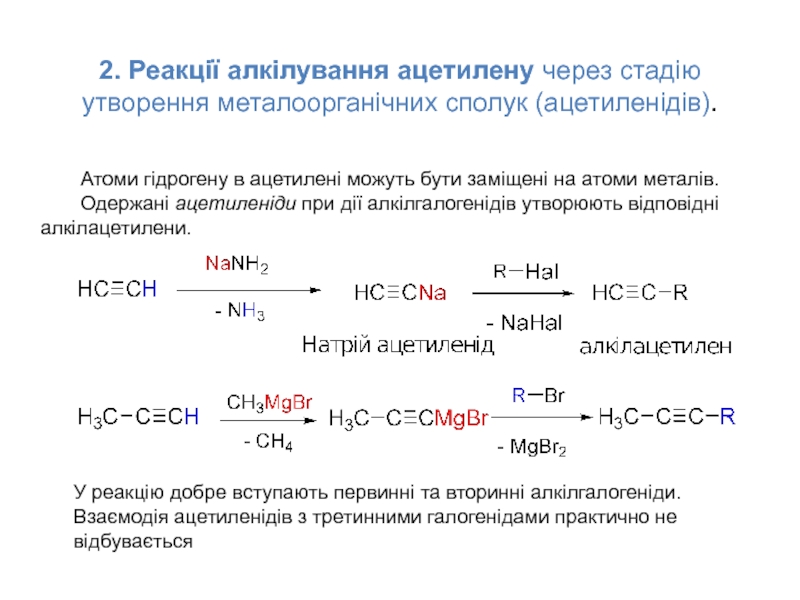
Слайд 62. Реакції алкілування ацетилену через стадію утворення металоорганічних сполук (ацетиленідів).
У
реакцію добре вступають первинні та вторинні алкілгалогеніди.
Взаємодія ацетиленідів з
третинними галогенідами практично не відбувається
Атоми гідрогену в ацетилені можуть бути заміщені на атоми металів.
Одержані ацетиленіди при дії алкілгалогенідів утворюють відповідні алкілацетилени.
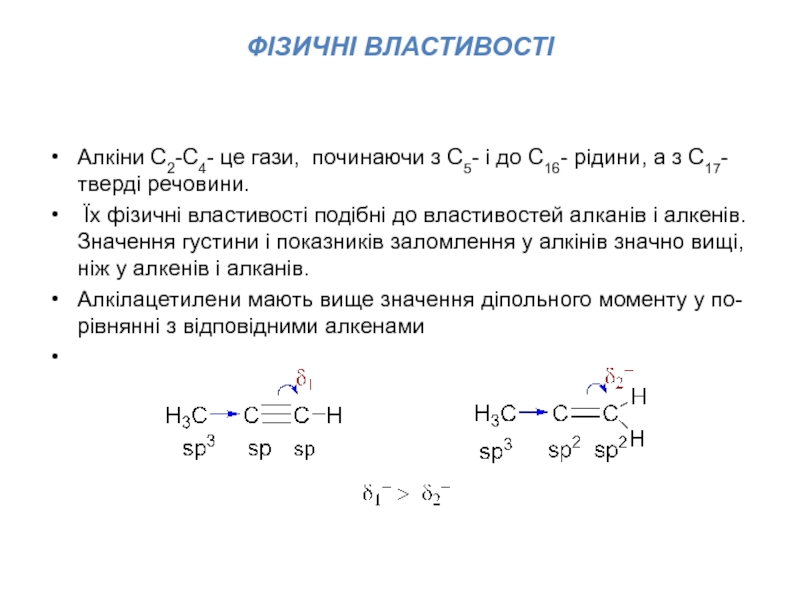
Слайд 7ФІЗИЧНІ ВЛАСТИВОСТІ
Алкіни С2-С4- це гази, починаючи з С5- і до
С16- рідини, а з С17-тверді речовини.
Їх фізичні властивості
подібні до властивостей алканів і алкенів. Значення густини і показників заломлення у алкінів значно вищі, ніж у алкенів і алканів.
Алкілацетилени мають вище значення діпольного моменту у по-рівнянні з відповідними алкенами
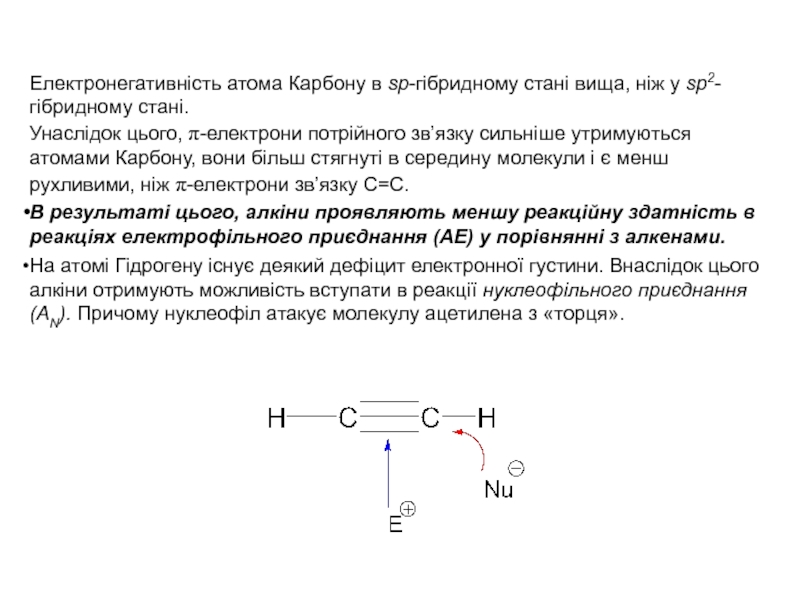
Слайд 9Електронегативність атома Карбону в sp-гібридному стані вища, ніж у sp2-гібридному
стані.
Унаслідок цього, π-електрони потрійного зв’язку сильніше утримуються атомами Карбону,
вони більш стягнуті в середину молекули і є менш рухливими, ніж π-електрони зв’язку С=С.
В результаті цього, алкіни проявляють меншу реакційну здатність в реакціях електрофільного приєднання (АЕ) у порівнянні з алкенами.
На атомі Гідрогену існує деякий дефіцит електронної густини. Внаслідок цього алкіни отримують можливість вступати в реакції нуклеофільного приєднання (АN). Причому нуклеофіл атакує молекулу ацетилена з «торця».
Слайд 10
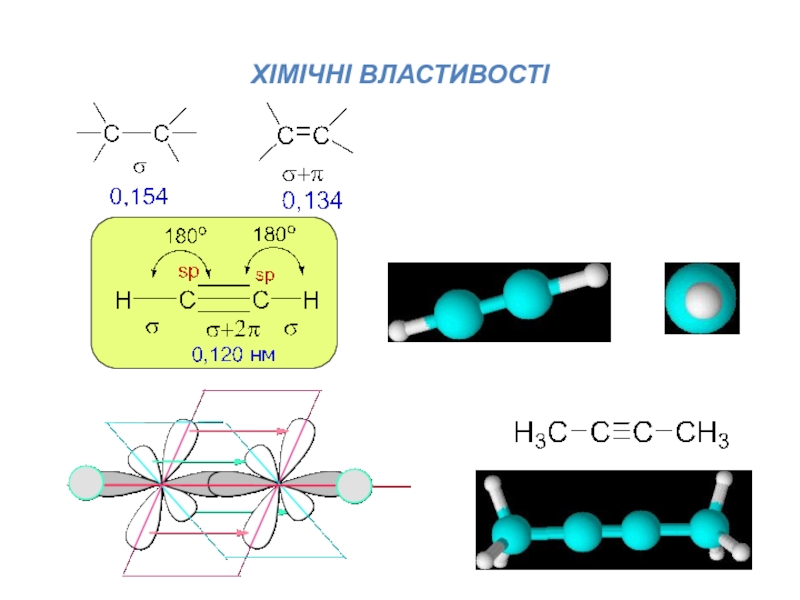
В молекулі ацетилену зв’язок С-Н утворений sp-гібридною орбіталлю атома С.
Відомо,
що електронегативність гібридної орбіталі зростає зі збільшенням у ній частки
s-орбіталі: sp3 – 2,5; sp2 – 2,75; sp – 3,2 (за шкалою Л.Полінга)
Вища електронегативність атома Сsp призводить до того, що електрона густина σ-зв’язку Csp-H зміщена до атома С, унаслідок чого зв’язок С-Н є полярним, а на Гідрогені виникає дефіцит електронної густини.
Це означає, що атоми Гідрогену в ацетилені протонізовані значно більше, ніж в етилені або в етані. Це полегшує відрив атома Н основою.
Про це свідчать значення констант йонізації цих сполук:
рК (ацетилен) = 25;
рК (етилен) = 44.
Для порівняння рК (Н2О) = 15,7.
Отже ацетилен проявляє кислотні властивості (С-Н кислота), хоча є слабшою кислотою, ніж вода.
Слайд 11Унаслідок кислотності атомів Гідрогену біля потрійного зв’язку C≡C алкіни реагують
з сильними основами з утворенням солей:
Загальна реакція:
Приклади:
Ацетиленіди лужних металів за
своїми властивостями є солями,
зв’язок С-Ме – йонний.
Слайд 12У ацетиленідах важких металів звязок С-Ме близький до полярного
ковалентного
полярного зв’язку
Слайд 13Таким чином для алкінів характерні реакції приєднання (АЕ та АN),
полімеризації, окиснення, та заміщення за "кислим” воднем.
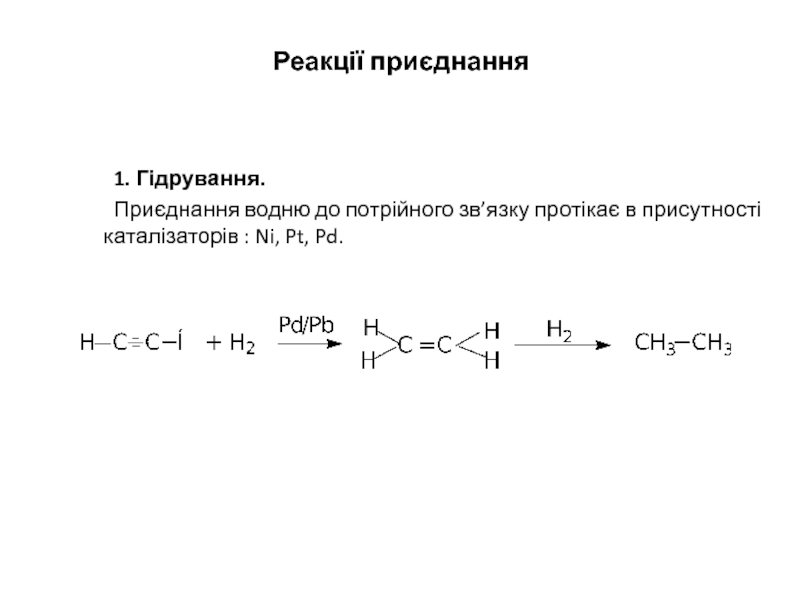
Слайд 14Реакції приєднання
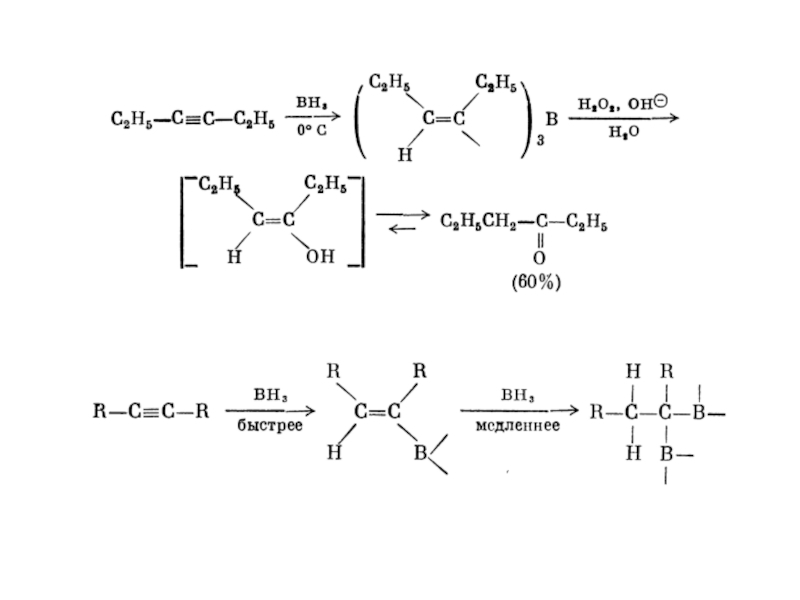
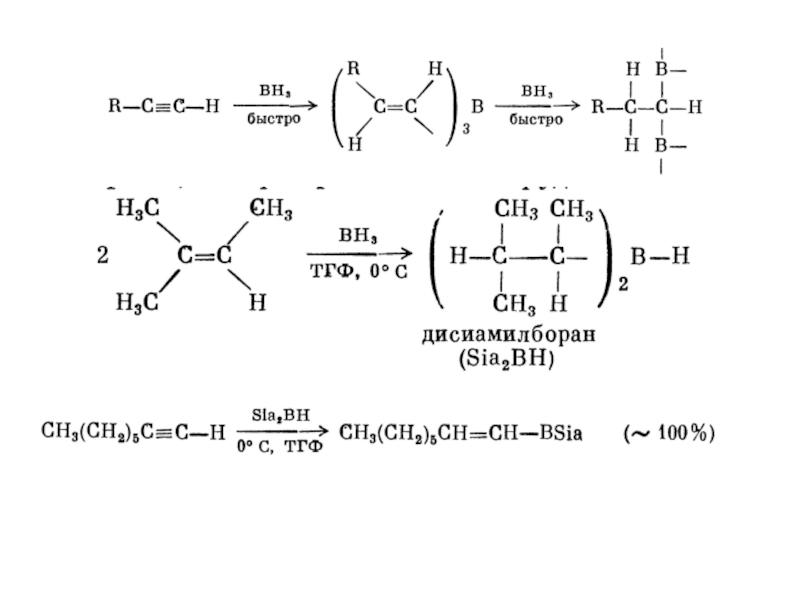
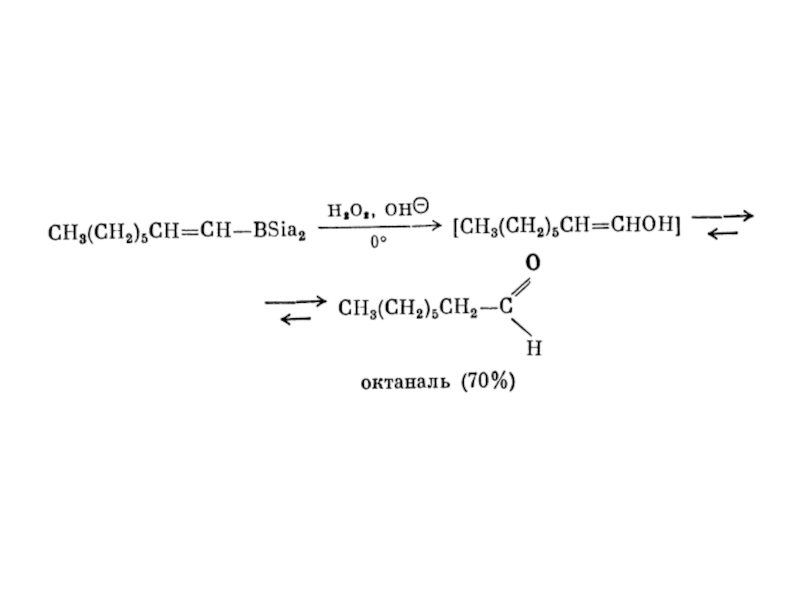
1. Гідрування.
Приєднання водню до потрійного зв’язку протікає в присутності
каталізаторів : Ni, Pt, Pd.
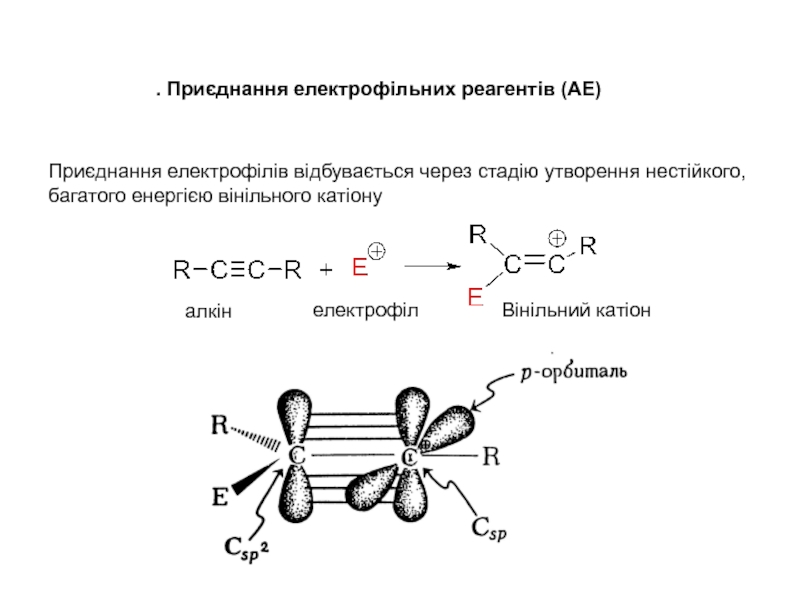
Слайд 15Приєднання електрофілів відбувається через стадію утворення нестійкого, багатого енергією вінільного
катіону
. Приєднання електрофільних реагентів (АЕ)
Вінільний катіон
алкін
електрофіл
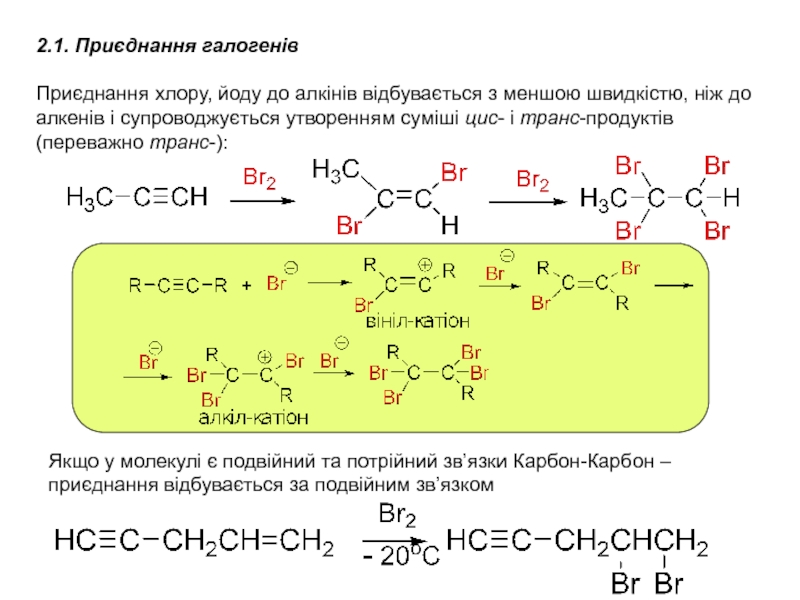
Слайд 16Якщо у молекулі є подвійний та потрійний зв’язки Карбон-Карбон –
приєднання відбувається за подвійним зв’язком
2.1. Приєднання галогенів
Приєднання хлору, йоду до
алкінів відбувається з меншою швидкістю, ніж до алкенів і супроводжується утворенням суміші цис- і транс-продуктів (переважно транс-):
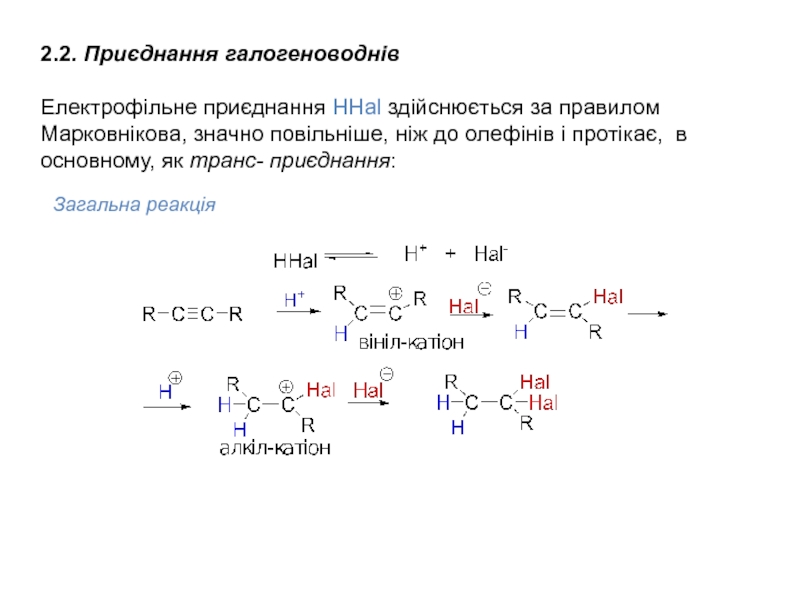
Слайд 172.2. Приєднання галогеноводнів
Електрофільне приєднання НHal здійснюється за правилом Марковнікова, значно
повільніше, ніж до олефінів і протікає, в основному, як транс-
приєднання:
Загальна реакція
Слайд 18Приклади:
Дана реакція лежить в основі першого промислового методу добування вінілхлориду
з ацетилену
Для алкілацетиленів на обидвох стадіях приєднання відбувається згідно правила
Марковнікова
Приєднання HBr у присутності ініціаторів вільнорадикальних реакцій для ацетиленів, як і у випадку алкенів, відбувається проти правила Марковнікова (за Карашем)
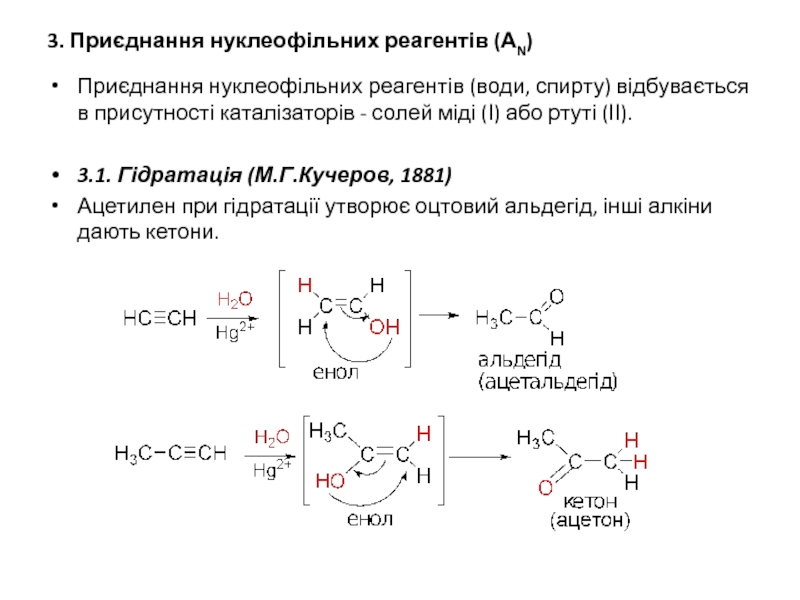
Слайд 193. Приєднання нуклеофільних реагентів (АN)
Приєднання нуклеофільних реагентів (води, спирту) відбувається
в присутності каталізаторів - солей міді (І) або ртуті (ІІ).
3.1. Гідратація
(М.Г.Кучеров, 1881)
Ацетилен при гідратації утворює оцтовий альдегід, інші алкіни дають кетони.
Слайд 20
Структура з НО-групою при подвійному зв’язку називається енолом. Еноли, як
правило, нестійки і в момент утворення ізомеризуються у відповідні кетони
або альдегіди.
Структурні ізомери, які можут легко переходити один в одного і існують у рівновазі називаються таутомерами, а така ізомерія - таутомерією. Даний вид таутомерії називається кето-енольною таутомерією.
Слайд 243.2. Приєднання спиртів
Спирти приєднуються до алкінів у присутності солей Сu+,
Hg2+, а також у присутності алкоголятів лужних металів.
3.3. Приєднання кислот
3.3.1.
Приєднання оцтової кислоти.
Приєднання оцтової кислоти приводить до утворення вінілацетату, який має промислове значення для виробництва полімерів (ПВА):
Слайд 253.3.2. Приєднання ціанідної кислоти
У результаті реакції утворюється мономер - акрилонітрил
(нітрил акрилової кислоти), який широко застосовується для синтезу полімерів та
каучуків:
Реакції 2.2, 3.2 і 3.3 називаються реакціями вінілування ― утворення вінільних мономерів, які в свою чергу можуть полімеризуватись з утворенням полімерних матеріалів.
Слайд 264. Карбонілування алкінів (В.Реппе, 1944-1949).
Карбонілування – це введення карбонільної групи
. У присутності нікелевих каталізаторів типу Ni(CO)4, алкіни взаємодіють з
оксидом вуглецю (ІІ) і водню з утворенням ненасичених кислот або їх похідних:
Якщо замість води взяти спирт, то утворюється естер акрилової кислоти.
Такі естери є цінними мономерами для одержання прозорих пластиків.
Слайд 275. Приєднання альдегідів і кетонів
Приєднання формальдегіду (Реппе) відбувається у присутності
ацетиленіду міді:
Приєднання ацетону протікає в присутності твердого КОН у середовищі
абсолютного (повністю зневодненого ) етеру (реакція О.Фаворського):
Слайд 28
Реакції полімеризації
І. Реакції димеризації
Ацетилен у присутності каталізатора Сu2СІ2 у кислому
середовищі утворює вінілацетилен (єніновий вуглеводень):
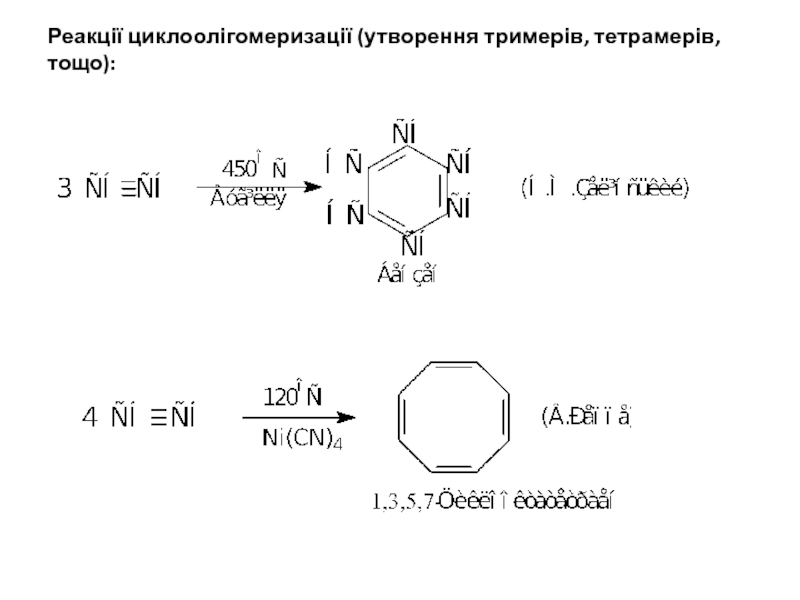
Слайд 29Реакції циклоолігомеризації (утворення тримерів, тетрамерів, тощо):
Слайд 303. Полімеризація
У присутності ініціаторів або металоорганічних каталізаторів утворюються спряжені полієни
(від грецького поліс - багато). Макромолекула (від грецького макрос -
великий) полієну складається практично тільки з вуглецевих атомів, з’єднаних між собою спряже-ними подвійними зв’язками:
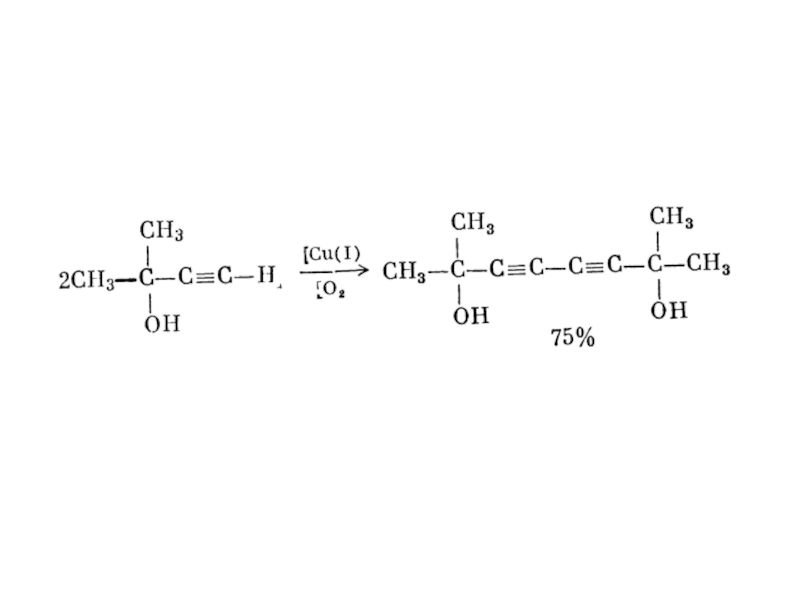
Ацетилен полімеризується також у присутності солей Сu+ та окиснювача:
Вважають, що карбін є третьою алотропною видозміною вуглецю разом з алмазом та графітом. Причому, карбіну приписують ще і кумуленову будову макромолекули ...С=С=С=С=С...
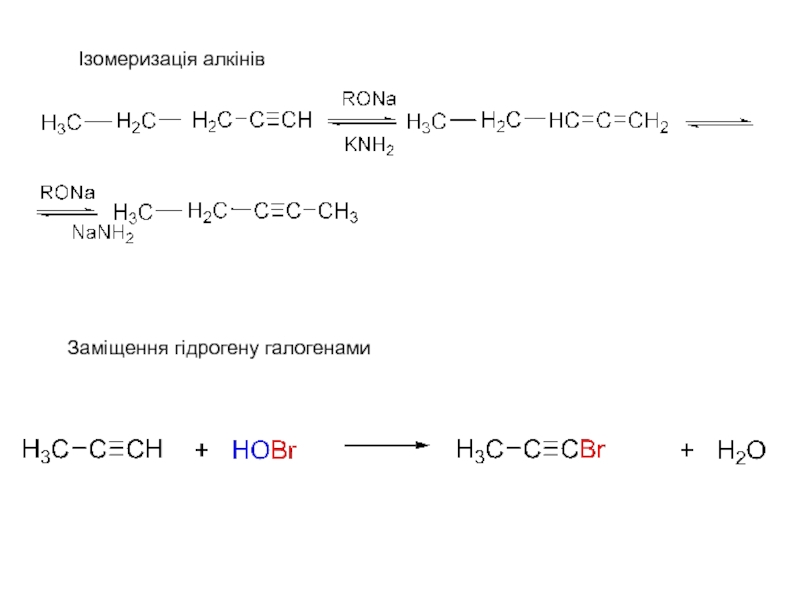
Слайд 32Ізомеризація алкінів
Заміщення гідрогену галогенами
Слайд 33Окиснення алкінів
Сильні окиснювачі (КMnO4, K2Cr2O7 у кислому середовищі, озон) окиснюють
алкіни за аналогією до алкенів по потрійних зв’язках з їх
розщепленням і утворенням у кінцевому результаті карбонових кислот: