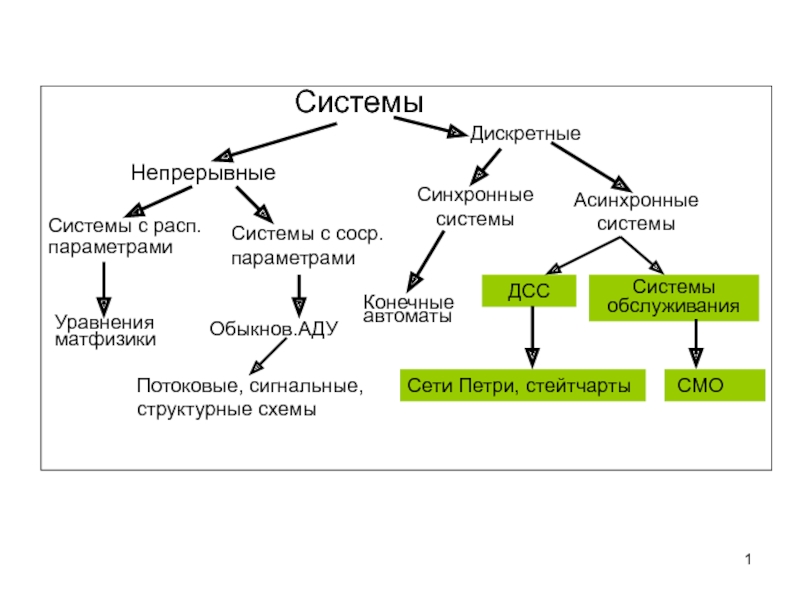
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аллотропные модификации углерода
Содержание
- 1. Аллотропные модификации углерода
- 2. Аллотропные модификации углеродаУглерод – единственный из элементов
- 3. АлмазАлмаз – прозрачное вещество, имеет атомную кристаллическую
- 4. Алмаз
- 5. АлмазАлмазы применяют для изготовления наконечников инструментов, используемых
- 6. ГрафитГрафит – темно-серое вещество, жирное на ощупь,
- 7. Графит
- 8. ГрафитГрафит используется для изготовления электродов (это вызвано
- 9. КарбинКарбин – порошок черного цвета, линейный полимер
- 10. Карбин
- 11. КарбинВпервые карбин синтезирован в 60-х годах XX
- 12. Химическое строение алмаза, графита и карбина
- 13. ФуллереныФуллерены представляют собой шарообразные молекулы С60 или
- 14. Фуллерены
- 15. ФуллереныФуллерены были открыты в 80-х годах XX
- 16. Аллотропные модификации углеродаАллотропные модификации углерода взаимопревращаемы.В настоящее
- 17. Скачать презентанцию
Аллотропные модификации углеродаУглерод – единственный из элементов IV группы, встречающийся в свободном состоянии. Существует он в виде нескольких аллотропных модификаций, важнейшими из которых являются алмаз, графит, карбин и фуллерены. Различаются аллотропные
Слайды и текст этой презентации
Слайд 3Алмаз
Алмаз – прозрачное вещество, имеет атомную кристаллическую решетку, в ней
все четыре электрона каждого атома углерода образуют прочные ковалентные связи
с четырьмя соседними атомами, поэтому алмаз – самое твердое вещество, найденное в природе.Слайд 5Алмаз
Алмазы применяют для изготовления наконечников инструментов, используемых для сверления, бурения,
резки.
Алмазы сильно преломляют лучи света, «играя» ослепительным блеском, поэтому используются
для изготовления украшений. Алмаз – самый дорогой из драгоценных камней. Наиболее крупные алмазы шлифуют, получая бриллианты. Масса алмазов выражается в каратах (1 карат = 0,2 г). Слайд 6Графит
Графит – темно-серое вещество, жирное на ощупь, имеющее металлический блеск.
В отличие от алмаза, в кристаллической решетке графита атомы углерода
расположены слоями, состоящими из шестиугольников. Три электрона каждого атома углерода образуют прочные ковалентные связи, а четвертый остается свободным. Этим объясняется металлический блеск, электро- и теплопроводность графита. Графит химически устойчив, тугоплавок (его температура плавления выше 3500°С).Слайд 8Графит
Графит используется для изготовления электродов (это вызвано его хорошей электропроводностью).
Слои
атомов углерода в кристалле графита находятся на довольно большом расстоянии,
слабо связаны друг с другом, поэтому графит легко расслаивается на чешуйки, чем обусловлено его использование в качестве материала для изготовления карандашей.Углерод – самое тугоплавкое простое вещество, поэтому его используют в ядерных реакторах для замедления нейтронов.
Слайд 9Карбин
Карбин – порошок черного цвета, линейный полимер (в нем атомы
углерода выстроены в одну прямую цепочку).
Встречается в двух формах:
…-С≤*С-С ≤С-С ≤С… или …=С=С=С=С=С=…
≤ – тройная связь.
По твердости карбин занимает промежуточное положение между алмазом и графитом. Он обладает полупроводниковыми свойствами.
Слайд 11Карбин
Впервые карбин синтезирован в 60-х годах XX века советскими химиками
В.В Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым. Позднее он был найден
в метеоритном кратере Рис в Баварии.Карбин пока еще не нашел широкого применения, как алмаз или графит, но, несомненно, у него большое будущее.
Слайд 13Фуллерены
Фуллерены представляют собой шарообразные молекулы С60 или С70, по форме
близки к дынеобразному мячу по регби. Поверхность молекул фуллеренов состоит
из 5- и 6-угольников, образованных атомами углерода, внутри молекулы полые.Фуллерены встречаются, как правило, в виде желтых или бурых кристаллов с плотностью 1,65 г/см3. Они мягкие и скользкие на ощупь, подобно графиту. Под большим давлением фуллерены превращаются в аморфную разновидность, твердость которой приближается к твердости алмаза. Фуллерены хорошо растворимы в бензоле (С6Н6), их следы можно обнаружить в местах удара молний.
Слайд 15Фуллерены
Фуллерены были открыты в 80-х годах XX века американскими учеными
Р. Смолли и Р. Керл и британским ученым Г. Крото.
В 1996 году они получили за это открытие Нобелевскую премию.Фуллерены в будущем могут быть использованы в качестве материала для полупроводниковой техники, также рассматривается вопрос их применения в фармакологии в качестве компонентов противоаллергических средств.