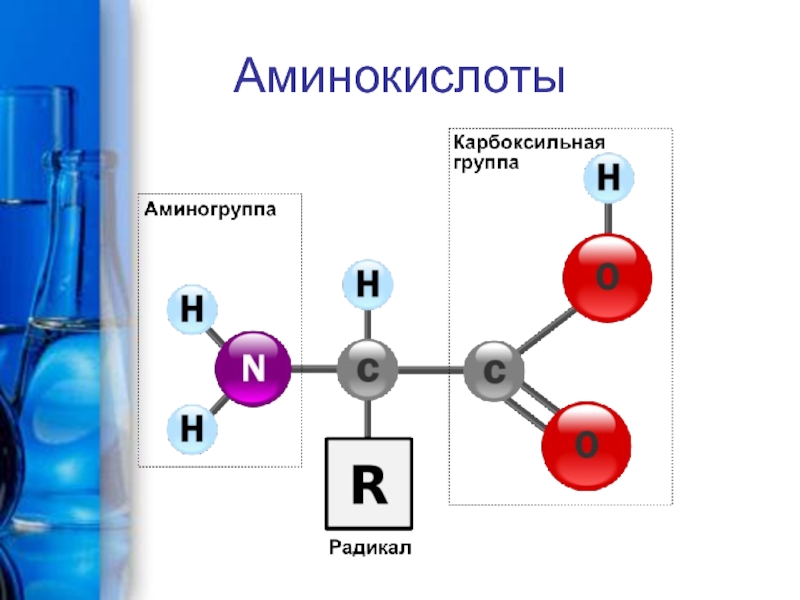
карбоксильная группа СООН и аминогруппа NH2 , связанные
углеводородным радикалом RNH2 – CH - COOH
|
R
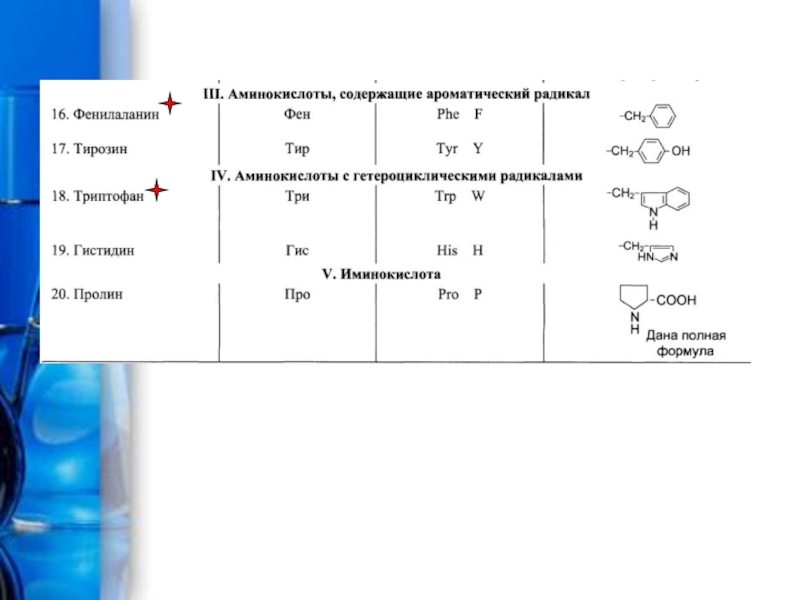
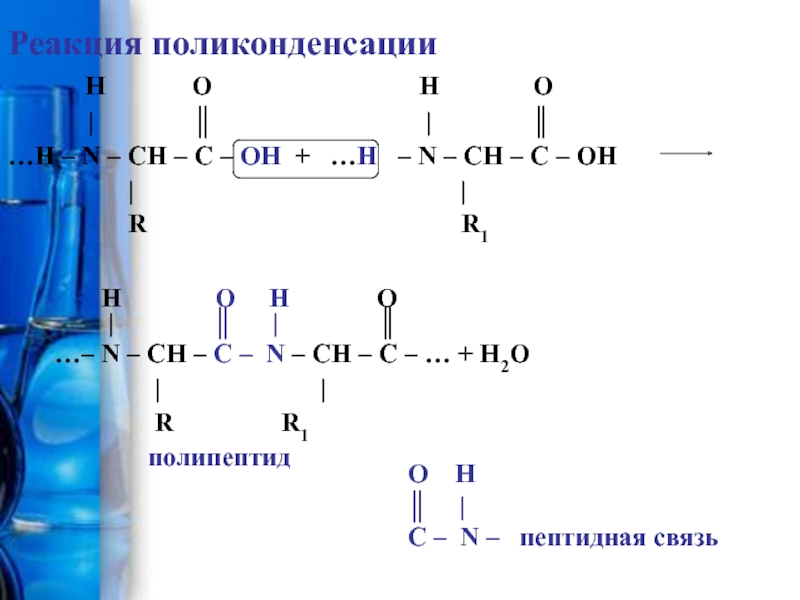
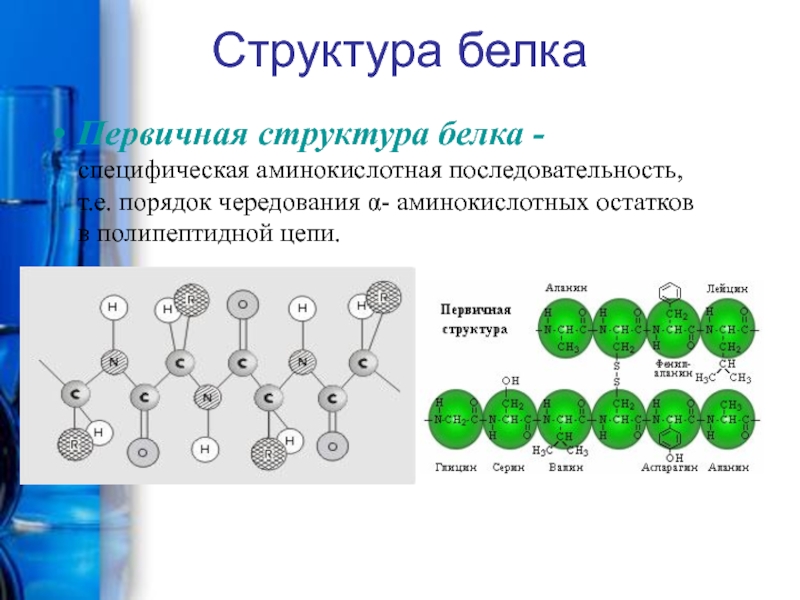
Производные карбоновых кислот, у которых атом Н в радикале замещен на аминогруппу
СН3СООН уксусная кислота
H – СН - СООН аминоуксусная кислота (глицин)
|
NH2